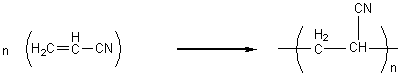COLLES ET ADHESIFS
Gérard GOMEZ
1) Définitions
:
Lorsqu'on veut fixer deux surfaces
l'une par rapport à l'autre, on place entre elles une substance liquide ou
pâteuse, en couche mince, qui en "séchant" forme un lien généralement
très solide et définitif.
On donne à cette substance
le nom d'adhésif si elle est synthétique et de colle si elle est naturelle.
Dans l'exposé qui suit on
utilisera exclusivement le terme d'adhésif étant entendu que ce qui sera dit
sera aussi valable pour les colles.
Remarques :
- Il existe des cas où on ne souhaite pas que le collage soit définitif
("post-it" par exemple) mais au contraire qu'il permette la
séparation facile des surfaces et une adhérence renouvelée à chaque contact (annexe 9).
- Il existe des cas où le collage peut se faire directement entre les
deux surfaces sans qu'on ait besoin de mettre d'interface c'est-à-dire
d'adhésif : c'est le cas des collages
moléculaires.
- Des colles particulières : les colles biologiques à usage
chirurgical.
2) Mécanisme
du collage – Conditions d'un bon collage :
2-1) Mécanisme du collage :
Lorsqu'on souhaite tracter
une voiture en panne au moyen d'un autre véhicule on sait qu'il faut :
- fixer
solidement un lien à l'un des véhicules,
- fixer ce même lien tout aussi solidement à l'autre
véhicule,
- on sait aussi qu'il faut de préférence que ce lien soit
rigide c'est-à-dire qu'une barre est préférable à une corde.
Pour un collage on a le même
schéma, l'adhésif doit se fixer solidement sur les deux surfaces en vis-à-vis
et il doit se rigidifier pour former un lien résistant.
2-2) La chimie du collage :
- L'adhésif doit se fixer solidement sur les surfaces :
Comme les vernis, peintures,
teintures et encres qui doivent "s'accrocher" au support, les
molécules d'adhésif doivent former avec les molécules du support des liaisons
fortes (covalentes ou ioniques) ; elles peuvent aussi former des liaisons de
plus faible énergie (liaisons hydrogène par exemple) qui, si elles sont seules
à s'exercer, doivent être en plus grand nombre pour permettre une fixation
suffisante.
- L'adhésif doit se rigidifier :
Tous les adhésifs sont des
polymères ; certains ont déjà leur structure et sont dans un solvant approprié
(eau ou solvant organique), c'est par évaporation du solvant qu'ils deviennent
rigides ; d'autres sont à l'état de monomère et ils deviennent rigides en se
polymérisant ; pour d'autres encore qui se présentent en deux parties ce n'est
qu'en mélangeant ces deux parties que la polymérisation a lieu.
Un exemple de collage à liaison covalente :
Lorsqu'on colle deux plaques
de verre par des adhésifs à base de silanols par exemple, des liaisons Si-O-Si se forment ;
l'énergie d'adhérence est grande ; c'est un collage efficace :
On représente ainsi la
plaque de verre
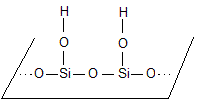
L'adhésif en présence
d'humidité donne un silanol :
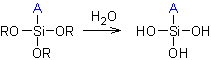
A pouvant être un groupe
hydroxyle, amine ou autre.
Le collage se déroule comme
suit :
a) Le verre adsorbe l'adhésif : des liaisons hydrogène s'établissent
entre le verre et l'adhésif
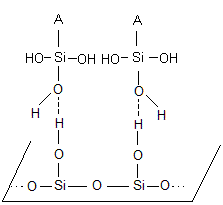
b) Des liaisons hydrogène s'établissent à l'intérieur de
l'adhésif
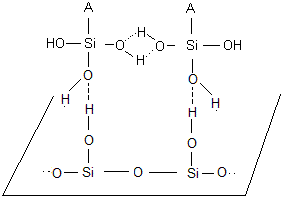
c) Une polymérisation par condensation se produit
(élimination de molécules d'eau) et des liaisons covalentes s'établissent :
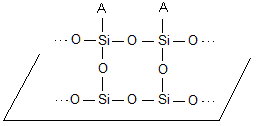
Une deuxième surface de
verre située au dessus (dans ce schéma) serait
traitée dans des conditions identiques. Une réticulation à base de liaisons
Si-O-Si assure la cohésion de l'ensemble d'où la solidité recherchée.
2-3) Considérations physiques lors d'un collage :
a) Il est capital que les liaisons entre adhésif et
support soient résistantes, encore faut-il qu'elles puissent s'établir
c'est-à-dire qu'il y ait un bon contact entre l'adhésif et les surfaces à
coller.
L'adhésif doit pouvoir
s'étaler sur le support, on dit qu'il doit pouvoir mouiller la surface sur
laquelle on l'applique ; cela met en jeu une notion de physique : la tension
superficielle.
Versons une goutte d'eau sur
une surface lisse ; on peut observer deux phénomènes différents selon l'état de
propreté de la surface :
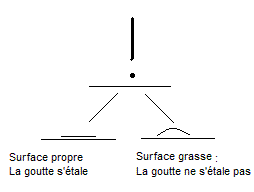
La présence d'un film gras,
de poussières ou de salissures diverses, augmente la tension superficielle et
empêche la goutte d'eau de s'étaler ; au contraire un tensio-actif diminue la
tension superficielle et permet cet étalement, on dit que le liquide mouille
mieux la surface.
Pour améliorer le contact
entre adhésif et support on a donc intérêt à avoir un support propre et
notamment dégraissé.
b) Les micro-cavités
présentes à la surface du support seront aussi un facteur favorable au collage
; elles doivent pouvoir recevoir l'adhésif (qui doit être suffisamment fluide)
et seront des points d'ancrage de l'adhésif sur le support. Parfois on passe un
agent abrasif à la surface des supports lisses pour multiplier ces micro-cavités :
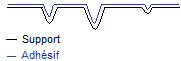
2-4) Les conditions d'un bon collage :
En rassemblant ce qui vient
d'être dit on résume les conditions d'un bon collage :
- Il convient d'adapter la nature chimique de l'adhésif à
celle du support pour qu'il s'établisse des liaisons chimiques si possible de
forte énergie.
- Il convient de nettoyer parfaitement les surfaces à
coller pour agir sur la tension superficielle (en la diminuant) et pour
permettre à l'adhésif de s'étaler sur le support.
- Les micro-cavités des
surfaces à coller sont intéressantes comme points d'ancrage de l'adhésif ; on
peut donc au besoin les créer avec un agent abrasif.
3) Quelques
types de colles et d'adhésifs et les surfaces sur lesquelles ils
s'appliquent :
Il a été dit plus haut que
tous les adhésifs sont des polymères ; ils peuvent déjà être sous forme de
polymère dissous dans un solvant (ou dans l'eau) et ils deviennent rigides par
évaporation du solvant (ou de l'eau), ou se ramollir sous l'effet de la chaleur
et se solidifier en se refroidissant ; dans tous les cas c'est un processus
physique qui leur donne leur rigidité.
Pour d'autres ils ne
préexistent pas sous forme de polymère mais sous forme de monomères ou d'oligomères et se polymérisent
au moment du collage ; c'est un processus chimique qui leur donne leur
rigidité.
3-1) La rigidité de l'adhésif est obtenue par un
processus physique :
a) par évaporation de l'eau :
- Nature chimique :
v
C'est le cas des colles à
base de protéines ; par exemple le collagène que l'on peut
recueillir en faisant bouillir des os, des tendons, de divers tissus
conjonctifs de mammifères et de poissons ; le produit obtenu, gélatineux, est
transformé en poudre.
v
On peut également avoir des
colles à base de polyholosides (amidon, dextrines (annexe 1)) à disperser dans l'eau.
v
C'est encore le cas du poly(alcool vinylique) (annexe 2) et du poly(acétate de vinyle) (annexe
2) en émulsion dans l’eau, colle blanche pour carton et bois
Par évaporation de l'eau l'adhésif
ou la colle forme un film continu. Sur le support déjà enduit, le film retrouve
ses propriétés adhésives par réhumidification
- Utilisation de
ces colles et adhésifs :
On les utilise pour coller
le papier et les papiers peints, les étiquettes qui ne sont pas auto-adhésives…..
v
Dans cette catégorie, on
peut aussi classer l'adhésif urée-formol (annexe 3)
; il est utilisé pour le bois (contreplaqué, aggloméré).
b) par évaporation d'un solvant autre que
l'eau :
- Nature chimique
Ce sont des adhésifs à base
de polymères vinyliques (poly(acétate de
vinyle)) (annexe 2), de polyméthacrylate
de méthyle (annexe 4), de caoutchouc naturel et synthétique
(annexe 5), de polyuréthane (annexe 6)
- Nature du solvant
Il s'agit d'un mélange comprenant des esters
(acétate d'éthyle notamment), des hydrocarbures aliphatiques (éther de
pétrole), des cétones (propanone notamment).
- Utilisation de
ces colles et adhésifs :
On les utilise comme colles
domestiques (bois, cartons, tissus) ou pour coller les conduits en PVC.
Une autre façon d'utiliser
certains de ces adhésifs (colle Néoprène : polychloroprène
(annexe 5)) :
Colle contact : On applique la colle sur les deux faces à joindre
; on laisse sécher puis on applique les deux surfaces l'une contre l'autre ; la
prise est très rapide.
La colle contact est surtout
utilisée pour coller le bois, le caoutchouc, le cuir, les objets en plastique
souple, les mousses rigides.
c) Les adhésifs thermoplastiques :
- Nature chimique
:
Ce sont des adhésifs à base
de polyamides ou de polyesters
(PET, EVA) (annexe 8)
Le polymère se ramollit
lorsqu'on le chauffe (les chaînes macromoléculaires linéaires ou avec quelques
ramifications peuvent glisser les unes sur les autres à partir d'une certaine
température d'où une certaine malléabilité) ce qui permet de l'étaler ; il est
alors collant ; il se rigidifie par refroidissement (enchevêtrement des
chaînes).
- Utilisation de
ces adhésifs :
Collage du bois, du cuir,
emballages, reliure, industrie textile…
d) Les auto-adhésifs :
La différence avec les
précédents est qu'ils sont appliqués sur un support et qu'ils gardent à l'état
sec leurs propriétés adhésives ; il suffira alors de mettre la face collante du
premier support en contact avec un autre support.
- Nature chimique :
Deux familles :
* A base de polymères acryliques (annexe 7) dispersés dans l'eau (émulsion) ; on ajoute
des agents antibactériens ; on laisse évaporer l'eau.
* A base de caoutchoucs naturels ou synthétiques
(annexe 5) associés à des résines aliphatiques ou
aromatiques, à des plastifiants, à des charges (talc, silice, carbonate de
calcium), à des "tacktifiants" qui
permettent de moduler la force du collage et à des anti-oxydants.
Après élimination des
solvants utilisés pour mettre ces substances en solution ou en émulsion, on
obtient un solide. Ce solide est fondu et pulvérisé au pistolet pour pouvoir
être appliqué (adhésifs (hot-melt)).
- Utilisation de
ces adhésifs
Rubans autoadhésifs,
étiquettes autocollantes (qui peuvent revenir plusieurs fois sur leur support
d'origine (feuille de polyester siliconé)), post-it (qui peut aussi se coller
plusieurs fois mais sur n'importe quel support)……
3-2) Les adhésifs à durcissement chimique :
3-2-1) Adhésifs à deux composants :
Le durcissement résulte de
la réaction entre une résine (polymère) et un durcisseur.
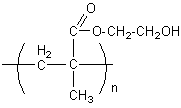
a) Polyuréthanes :
- Nature chimique :
·
La résine est formée d'un
polymère hydroxylé comme par exemple le polyméthacrylate
de 2-hydroxyéthyle :
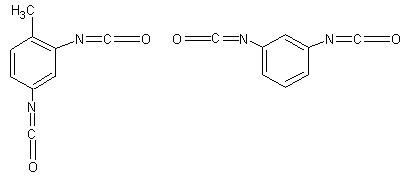
·
Le durcisseur est par
exemple le toluène-2,4-diisocyanate ou le toluène-2,6-diisocyanate (TDI) :
Le polymère rigide obtenu
est :
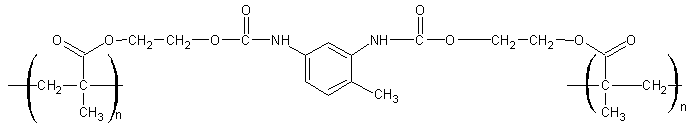
- Utilisation de ces adhésifs :
§ Collage de polymères en mousse : Polyuréthane (PUR), Polyéthylène (PE)
ou Polystyrène (PS) expansé.
§ Collage d'emballages souples (on appelle emballages
souples des films ou des sachets dont l'épaisseur ne dépasse pas 100µm).
§ Collage des pare-brise.
b) Polymères à partir d'époxydes :
- Nature chimique :
·
La résine :
C'est une résine époxyde à
base de bisphénol A.
La macromolécule peut se représenter ainsi :
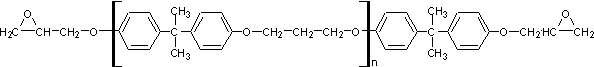
Elle est appelée résine diglycidyléther du bisphénol A (DGEBA). Elle peut s'obtenir
par action du bisphénol A :
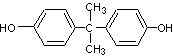
Sur l'épichlorhydrine
:
![]()
·
Le durcisseur :
C'est une amine, la 3-(N,N-diméthylaminopropyl)-propan-1,3-diamine :
![]()
·
La mise en contact de la
résine et du durcisseur conduit à une réaction de réticulation.
On abrège la représentation
de la résine afin de simplifier son écriture en faisant ressortir sa fonction
active :
![]()
On fait de même pour le
durcisseur dont la fonction active est la fonction amine :
![]()
On obtient alors les
équations de réticulation :

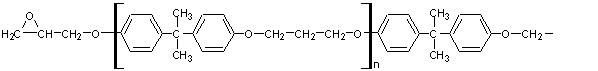
- Utilisation de
ces adhésifs :
Araldite ® est une dénomination très connue de ce type
d'adhésif. On utilise ces colles dites "époxy" pour verre, céramique,
marbre, métal. Ces colles "époxy" sont presque toujours
indispensables quand un métal est concerné. En outre elles donnent satisfaction
dans les zones collées où une très forte résistance est nécessaire (réparations
de clubs de golf).
3-2-2) Adhésifs monocomposants
:
a) Adhésifs cyano-acryliques
:
- Nature chimique :
Le cyanoacrylate de méthyle
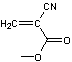
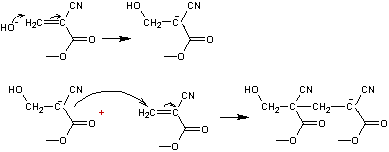
est un monomère qui se polymérise très rapidement en
présence d'un nucléophile (souvent HO-) pour donner une colle très
résistante :
- Utilisation de
ces adhésifs :
Superglue ® est une
dénomination très connue de ce type d'adhésif. Ces adhésifs très résistants et
à prise très rapide ont des usages industriels et domestiques.
Les colles cyanoacryliques sont susceptibles de convenir à tous les
matériaux sauf le téflon. Dans les cas difficiles, polyéthylène par exemple, il
faut ajouter un activateur spécifique.
Le cyanoacrylate de 2-octyle
(Dermabond ®)
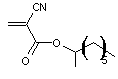
a trouvé des applications médicales, il permet dans
certains cas d'éviter l’usage de fils ou d’agrafes pour suturer les plaies.
b) Adhésifs à base de polysilanes
:
- Nature chimique :
On appelle silanes
les composés du silicium les plus simples ne comportant aucune liaison Si-O ; par exemple :
·
Des molécules renfermant
silicium et hydrogène : SiH4
monosilane Si2H6
disilane
·
Des molécules
chlorées : SiH3Cl
monochlorosilane Si2Cl6
hexachlorodisilane
·
Des dérivés organiques du silicium : Si(C6H5)4 tétraphénylsilane SiH2(CH3)2
diméthylsilane
·
Des dérivés organiques
chlorés : Si(C2H5)2Cl2
dichlorodiéthylsilane Si(C6H5)HCl2 dichlorophénylsilane
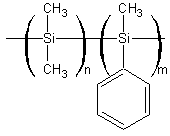
Les polysilanes
sont des polymères obtenus à partir des silanes chlorés ; on peut par exemple fabriquer le poly(diméthylsilane) polymère cristallisé par une réaction
comparable à celle de Wurtz :
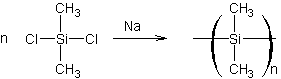
On peut aussi copolymériser
de la même façon du diméthylsilane et du méthylphénylsilane pour obtenir un polymère non cristallisé
(plus facilement soluble donc) :
- Utilisation de
ces adhésifs :
Ces adhésifs adhèrent
pratiquement à tous les supports ; Ces colles se distinguent surtout dans les
cas où des joints de construction élastiques sont nécessaires.
c) Adhésifs à base de polysiloxanes
(silicones) :
- Nature chimique :
On appelle siloxanes
les composés renfermant dans leur molécule une ou plusieurs liaisons Si-O-Si
On peut citer par exemple l' hexaméthyldisiloxane (CH3)3Si-O-Si(CH3)3 .
On appelle silicones des polysiloxanes c'est-à-dire des polymères ayant un grand
nombre de liaisons Si-O-Si.
Les adhésifs au silicone monocomposant durcissent par polycondensation amorcée par
l'humidité.
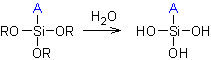
A pouvant être un groupe
hydroxyle, amine, époxyde ou autre.
Puis des liaisons Si-O se créent par polycondensation avec perte d'eau :

- Utilisation de
ces adhésifs :
Les adhésifs au silicone
permettent des collages sur des supports en verre et en céramique ; ils offrent
une grande résistance à l'humidité et sont souvent utilisés dans les
installations sanitaires comme joints d'étanchéité.
d) Adhésifs en anaérobie :
(renseignements copiés sur le site de la marque Bostik
: http://www.bostik.com/_upload/ressources/our_activity/types_de_collage_1.pdf)
- Technologie utilisée :
Les adhésifs en anaérobie
sont basés sur la chimie des diacrylates ; ce sont
des colles monocomposant qui durcissent rapidement
pour former une surface d'adhésion résistante entre deux surfaces ne pouvant
présenter aucune inclusion d'air.
- Procédé de collage :
L'oxygène est un inhibiteur
pour les colles anaérobies. En présence d'oxygène dans l'air, le produit ne
réagit pas et reste à l'état liquide. Les deux conditions suivantes sont
nécessaires pour un durcissement correct :
•Contact avec une surface métallique.
• Absence d'oxygène ou d'air.
- Applications :
Ces colles sont recommandées
pour une utilisation sur des surfaces métalliques, pour le blocage de boulons.
C'est une technique qui est
apparue dans les années 1980 en microélectronique. Elle permet par exemple de
coller deux plaques de silicium ou deux plaques de silicium oxydées en surface,
sans faire appel à un produit spécifique intermédiaire.
On rapproche le plus
possible les deux plaques c'est-à-dire qu'on les rend suffisamment lisses pour
que les atomes de l'une soient à une distance de l'ordre de quelques nanomètres
des atomes de l'autre ; les forces attractives entre les deux structures sont
alors assez élevées pour provoquer l'adhérence moléculaire ; ce sont des forces
de Van der Walls qui, on le sait, sont d'autant plus importantes que la
distance entre les surfaces est faible. Dans beaucoup d'applications ces
collages moléculaires sont réalisés à température et pression ordinaires après
un nettoyage chimique des surfaces.
Si on veut renforcer les
énergies de collage (c'est-à-dire rendre le collage plus résistant) on peut
mettre en œuvre un traitement thermique ; plus les températures seront hautes
et plus les énergies de collage seront importantes. Au-delà d'une certaine température
(qui dépend de la nature hydrophile ou hydrophobe de la surface et du nettoyage
de celle-ci) la majorité des liaisons entre les deux surfaces sera des liaisons
covalentes.
Deux exemples :
- Le collage de deux plaques de silicium dont les
surfaces sont hydrophobes pourra par exemple être suivi d'un traitement
thermique à 600°C. Il en résultera des liaisons covalentes Si-Si
- Le collage de deux plaques de silicium oxydées dont les
surfaces sont hydrophiles mettra en jeu à 150°C des liaisons hydrogènes (avec
les monocouches moléculaires d'eau adsorbée à leur surface) plus
"résistantes" que les forces de Van der Walls. Chauffées vers 700°C
il se formera des liaisons Si-O-Si covalentes.
La création de structures
SOI (Silicium sur isolant) pour la réalisation de circuits intégrés, s'appuie
largement sur le collage par adhérence moléculaire.
5) Coller une matière anti-adhésive :
Le PTFE est thermostable
(Fusion à 327°C) et lorsqu'il constitue le revêtement anti-adhésif
d'un ustensile de cuisine le fabricant conseille une utilisation de l'ustensile
jusqu'à environ 250°C ; il est chimiquement inerte et anti-adhésif
donc ayant un coefficient de frottement très faible, ce qui s'explique,
chimiquement parlant, par le fait que sa longue barrière d'atomes de fluor
l'isole et qu'il refuse toute alliance avec l'extérieur.
Pour fixer le téflon sur un
métal on peut envisager deux méthodes :
- Première méthode :
un sablage de la surface métallique qui la rend rugueuse ; une première
couche de téflon s'agrippe grâce aux aspérités ; une deuxième couche de
téflon rend la surface propre à la cuisson, sans matière grasse et sans
accrocher.
- Deuxième méthode :
une première couche d'un polymère P adhère au métal ; on applique une
deuxième couche d'un polymère qui a autant d'affinité que possible avec le
polymère P et le téflon ; enfin on applique une troisième couche faite de
téflon.
6) Des
matières qui ne peuvent pas se coller :
Les produits actuels
permettent des collages de deux matières éventuellement très différentes l'une
de l'autre. Comme colles polyvalentes et d'une grande efficacité on peut citer
sans doute les cyano-acryliques et les
"époxy".
Pourtant, polyéthylène,
polypropylène, particulièrement inertes, refusent de fixer les colles même
réputées les plus performantes, sauf par addition d'un activateur spécifique.
L'amidon natif se présente
sous forme de grains de taille variable insolubles dans l'eau froide. Dans
l'eau chaude (70°C environ), l'amidon gonfle (empois) et l'on peut séparer ses
deux constituants principaux : l'amylose (ou amidon linéaire) environ 20%, peu
soluble dans l'eau froide et l'amylopectine 80% (ou amidon ramifié). Ce sont
deux polymères du glucose, l'amylose ayant une masse molaire de l'ordre de 500
000 g.mol-1 et l'amylopectine de plusieurs millions de g.mol-1.
Dans l'amylopectine il y a un enchaînement 1-6 environ tous les 25 unités
glucose.


Si on hydrolyse complètement
l'amidon soit par des enzymes soit par un acide on peut arriver au glucose ; si
on s'arrête en cours de fermentation on obtient un sirop composé de glucose, de
maltose et d'holosides de plus grande masse molaire. Le mélange est appelé
dextrines.
Le motif du poly(alcool vinylique) s'écrit :
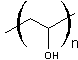
Il s'obtient par hydrolyse
du poly(acétate de vinyle) :
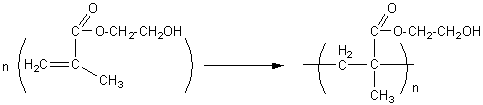
Le polyméthacrylate
de méthyle ou PMMA
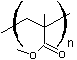
s'obtient par polymérisation du méthacrylate de méthyle
suivant l'équation :
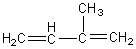
Les caoutchoucs appartiennent à la famille des élastomères.
Ce sont des substances qui sous l'effet de la traction subissent un allongement
important (seules sont intéressantes celles dont les dimensions peuvent au
moins tripler) qui cesse quand l'action mécanique cesse.
- Le caoutchouc naturel extrait du latex de l'hévéa est le polyisoprène,
l’isoprène étant le 2-méthylbuta-1,3-diène :
![]()
Le
motif du caoutchouc naturel :
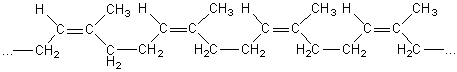
correspond à un enchaînement (Z) 1,4 de
l'isoprène :
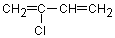
- Les caoutchoucs synthétiques sont nombreux ; on utilise
notamment le poly(chloroprène) (polymère
correspondant au 2-chlorobuta-1,3-diène ):
![]()
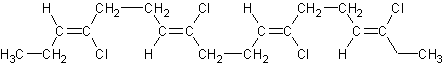
Le motif du poly(chloroprène) :
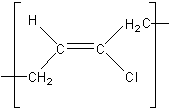
correspond à un enchaînement (Z) 1,4 du chloroprène.
Résultent de l’action d’un
di-isocyanate sur un diol
![]()
Remarque : c’est une polycondensation sans élimination. On fabrique
couramment le polyuréthane pour lequel R est C6H5-CH3
et p = 4 ; le 4,4'-diphénylméthane
diisocyanate (ou 4,4'-MDI) est aussi très
utilisé.
Ce sont des polymères
dérivant de l’acide acrylique CH2=CH-COOH
- de
méthyle : ou PMMA
- de 2-hydroxyéthyle:
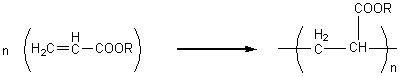
Polyacrylonitrile : ou PAN
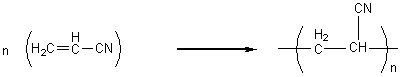
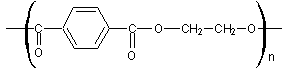
PET (Poly(téréphtalate
d'éthylène glycol)) :
EVA (Copolymère éthylène-acétate de vinyle) :
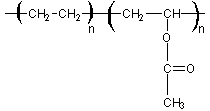
La colle des "post-it" fait l'objet d'un brevet
(US 3691140 A) dont voici le résumé :
Infusible,
solvent-dispersible, solvent-insoluble, inherently tacky, elastomeric copolymer
microspheres consist essentially of about 90 percent to about 99.5 percent by
weight of at least one alkyl acrylate ester and about 10 to about 0.5 percent
by weight of at least one monomer selected from the group consisting of
substantially oil-insoluble, water-soluble, ionic monomers and maleic
anhydride. The microspheres are prepared by aqueous suspension polymerization
utilizing emulsifier in an amount greater than the critical micelle
concentration in the absence of externally added protective colloids or the
like.
….Et
la traduction :
Les microsphères de copolymère élastomère infusibles,
insolubles dans la plupart des solvants, dispersables dans ceux-ci,
intrinsèquement collantes, sont essentiellement composées d'environ 90 % à
environ 99,5 % en poids d'au moins un ester d'acrylate d'alkyle et d'environ 10
% à environ 0,5 % en poids d'au moins un monomère choisi dans le groupe
constitué de monomères ioniques et d'anhydride maléique substantiellement
insolubles dans l'huile et solubles dans l'eau. Les microsphères sont préparées
par polymérisation en suspension aqueuse en utilisant un émulsifiant en
quantité supérieure à la concentration critique en micelles, en l'absence de
colloïdes protecteurs ou similaires ajoutés.
Il s'agit en fait d'un copolymère obtenu à partir de
90 à 99,5% en masse d'un ester, un acrylate d'alkyle
![]()
et
de 10 à 0,5 % en masse d'un monomère ionique (insoluble dans l'huile, soluble
dans l'eau)
en
présence d'anhydride maléique
![]() .
.