POLYCETIDES,
ACIDES GRAS ET DERIVES DU MEVALONATE.
Jacques
BARON
Gérard GOMEZ
Plan de
l'étude :
1) Généralités
1-1) Sur les
polycétides
1-2) Acides
gras et familles dérivées du mévalonate
2) Principales molécules mises en œuvre
2-1) ATP
2-2) Coenzyme
A et Acétylcoenzyme A
2-3) ACP
2-4) Coenzyme
Nicotinamide – Adénine – Dinucléotide (NAD+ /NADH)
2-5) Coenzyme
Nicotinamide – Adénine – Dinucléotide Phosphate (NADP+/NADPH)
2-6) Acide
malonique –Malonylcoenzyme A
2-7) Acide
mévalonique – HMG-CoA
3) Biosynthèse des polycétides
3-1) Equations
fondamentales de départ d'une chaîne polycétide
3-2) Biosynthèse
de polycétides fondamentaux
3-3) Biosynthèses
de quelques molécules dérivées de polycétides
3-3-1) de tétracétides
3-3-2) d'octocétides
4) Biosynthèses d'autres familles
4-1) Acides
gras saturés
4-2) Terpènes
– Stéroïdes – Caroténoïdes
4-2-1) Schéma général de synthèse
4-2-2) Les terpènes
4-2-2-1)
Biosynthèse des monoterpènes à partir du
diphosphate de géranyle (GPP)
4-2-2-2)
Biosynthèse des sesquiterpènes à partir du
diphosphate de farnésyle (FPP)
4-2-2-3)
Biosynthèse des triterpènes à partir du
diphosphate de farnésyle (FPP)
4-2-2-4)
Biosynthèse des diterpènes à partir du
diphosphate de digéranyle (GGPP)
4-2-2-5)
Biosynthèse des tétraterpènes à partir du
diphosphate de digéranyle (GGPP)
4-2-2-6)
Biosynthèse de polymères isopréniques
4-2-3) Les stérols
4-2-4) Les caroténoïdes
1) Généralités :
1-1) sur les
polycétides
Il
s'agit d'une large classe de métabolites secondaires (voir annexe
1) de plantes, de bactéries, de champignons ou même d'animaux marins.
Les
molécules correspondantes peuvent avoir une succession de groupes carbonyle et
méthylène alternés (-CO-CH2-) ou bien elles dérivent de molécules
ainsi agencées.
Ces
métabolites ont des utilisations très variées dont voici quelques exemples :
- Antibiotique
Acide
6-méthylsalicylique
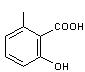
Molécule
produite par Penicillium griseofulvum (ou urticae).
Erythromycine A
Macrolide
produit par Saccharopolyspora erythraea
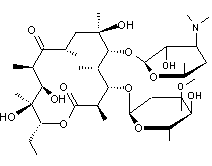
- Anticholestérol
Lovastatine
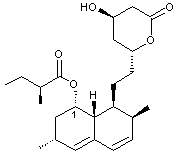
Molécule présente à
l’état naturel dans un champignon (le pleurote en huître) et dans la levure de
riz rouge.
Cette molécule inhibe le 3-hydroxy-3-méthylglutaryl
coenzyme A réductase (HMG - CoA réductase) qui est un enzyme-clé (voir annexe 4) de la synthèse endogène du cholestérol.
- Immunosuppresseur
Sirolimus ou rapamycine
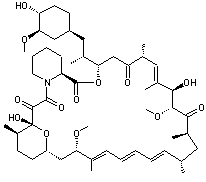
Médicament
immunosuppresseur utilisé surtout lors de transplantations rénales.
La
molécule a été isolée en 1975 d'une bactérie Streptomyces hygroscopicus.
1-2) Acides gras
et familles dérivées du mévalonate :
On
abordera aussi dans cet article la biosynthèse de grandes familles dont
l'origine des molécules est commune à celle des polycétides ; ce sera notamment
le cas des acides gras, mais aussi des terpènes, des stérols, des caroténoïdes
et qui correspondent pour la plupart à des métabolites primaires.
2) Principales molécules mises en œuvre
Avant
de passer à l'examen des biosynthèses, il faut préciser la structure et le rôle
de quelques molécules tout à fait classiques en Biochimie :
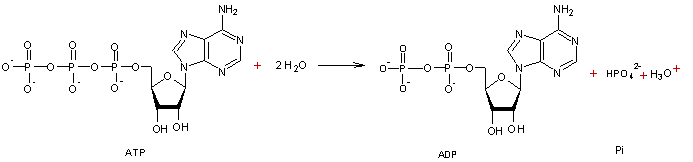
2-1) ATP
Adénosine
TriPhosphate :
Dans
les muscles, on trouve de l'acide 5-adénylique
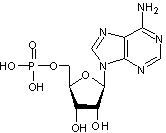
où une
molécule d'acide phosphorique estérifie la fonction alcool portée par le
carbone C5 de l'ose du nucléoside. Si au lieu d'une molécule d'acide
phosphorique, trois sont mises en jeu, on obtient :
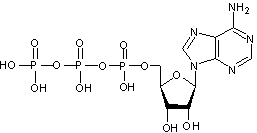
C'est
l'acide adénosine triphosphorique, en pratique l'adénosine triphosphate (ATP)
qui joue un rôle fondamental pour les échanges d'énergie dans les cellules.
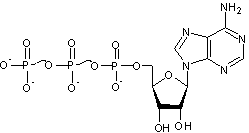
(Les
liaisons ~ correspondent aux liaisons riches en énergie dans la molécule).
2-2) Coenzyme A et
Acétylcoenzyme A :
Certains
enzymes réagissent avec
leur substrat seulement quand ils sont combinés avec une autre substance appelée
coenzyme. En général un coenzyme n’est pas de nature protéique ; c’est une
molécule organique beaucoup plus simple que l’enzyme ; le complexe
enzyme-coenzyme est réversible.
Un
coenzyme peut s’associer à plusieurs enzymes et de ce fait agit sur plusieurs
substrats.
Le
coenzyme A, a la structure suivante :
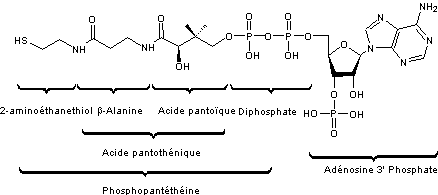
On le
désigne en abrégé par CoA ou HSCoA (ou CoASH) si l'on met en évidence le groupe
HS du 2-aminoéthanethiol dont l'hydrogène est facilement substitué par un
groupe acyle, par exemple le groupement acétyle
![]()
Il
devient alors l'acétylcoenzyme A (ou AcétylCoA)
![]()
Le CoA
active de nombreux radicaux acyle avec lesquels il donne des dérivés analogues
à l'acétylcoenzyme A. Activer veut dire qu'à travers les liaisons
thioesters fortement énergétiques qu'il
forme, il permet à ces radicaux de participer à des réactions auxquelles ils ne
participeraient pas autrement. On dit donc que l'acétylcoenzyme A est la forme
active de l'acide éthanoïque.
Le
coenzyme A est un coenzyme de transfert de groupements acyles qui interviennent
dans de nombreuses voies du métabolisme.
2-3) ACP
C'est
une protéine transporteur de radicaux acyle (Acyl carrier protein).
La
phosphopantéthéine déjà rencontrée avec le coenzyme A constitue un groupe
prosthétique de cette protéine
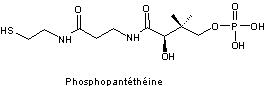
La
phosphopantéthéine est liée par un résidu de sérine à la protéine comme on le
voit sur le schéma suivant :
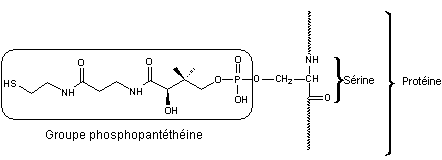
Le rôle
de l'ACP est comparable à celui de l'acétyl-CoA mais la protéine constitue un
édifice beaucoup plus volumineux.
2-4) Coenzyme
Nicotinamide – Adénine – Dinucléotide (NAD+ /NADH)
|
NAD+ |
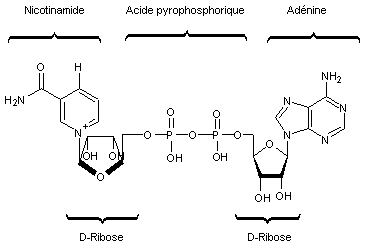
|
NADH |
Il
s'agit d'un couple d'oxydo-réduction NAD+/NADH
dont la forme oxydée est NAD+ et la forme réduite NADH.
NAD+
joue le rôle d'oxydant dans les réactions cataboliques avec la transformation

Ainsi
NAD+ couplée à l'enzyme alcool déshydrogénase (ADH) oxyde l'éthanol
en acétaldéhyde.
Les
demi-équations rédox et l'équation globale s'écrivent :
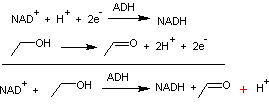
Le
mécanisme de cette réaction est donné en annexe 2
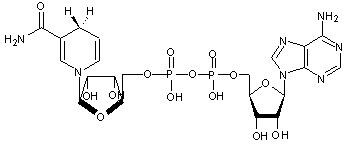
2-5) Coenzyme
Nicotinamide – Adénine – Dinucléotide Phosphate (NADP+/NADPH)
|
NADP+ |
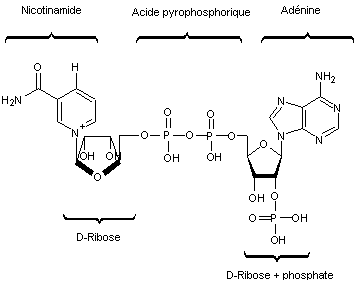
|
NADPH |
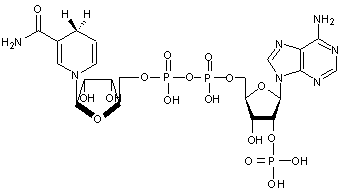
Il
s'agit d'un couple d'oxydo-réduction
NADP+/NADPH dont la forme oxydée est NADP+ et la forme réduite
NADPH.
NADPH
joue le rôle de réducteur dans les réactions anaboliques avec la transformation

L'action
de l'enzyme NADPH oxydase couplé à NADPH permet par exemple la synthèse d'un
dérivé réactif de l'oxygène (DRO), l'anion superoxyde qui peut endommager les
structures cellulaires

2-6) Acide malonique
–Malonylcoenzyme A
L'acide
malonique est un diacide carboxylique à 3 carbones (acide propanedioïque).
![]()
On
retrouve sa structure dans de nombreuses biosynthèses (acides gras, terpènes,
stéroïdes) sous forme d'un maillon essentiel, le malonylcoenzyme A :
![]()
Biosynthèse
du malonylcoA
L'acide
éthanoïque est activé par le coenzyme A sous forme d'un thioester
l'acétylcoenzyme A.

Par
carboxylation, l'acétylCoA est transformé en malonylCoA grâce à l'acétylCoA
carboxylase
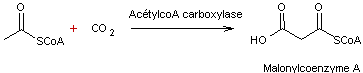
L'action
de l'acétylCoA carboxylase nécessite un coenzyme, la biotine ou coenzyme R qui
permet le transfert de CO2.
|
|
La
carboxylation a en fait lieu en deux étapes :
- 1ère étape
![]()
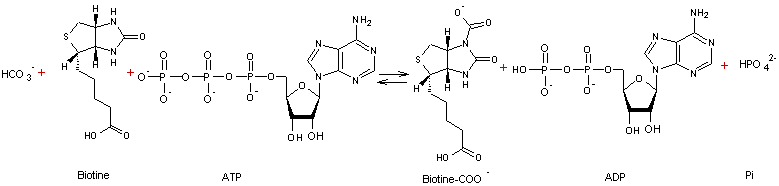
- 2ème étape
![]()
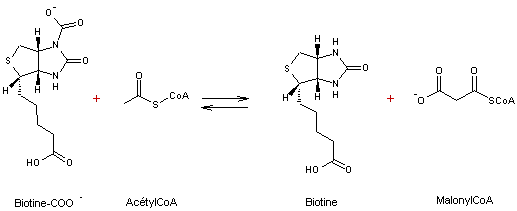
La
transformation ATP, ADP qui apporte de l'énergie :
2-7)
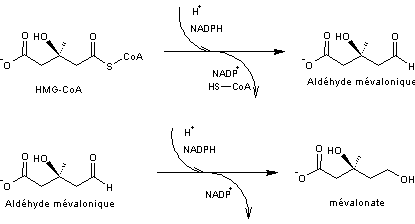
Acide mévalonique – HMG-CoA
La formule de l'acide mévalonique
![]()
C'est un composé important en
synthèse biochimique, un précurseur (sous la forme
mévalonate) des terpènes et des stéroïdes dans la voie métabolique dite de
l'HMG-CoA.
Le
mévalonate se forme ainsi
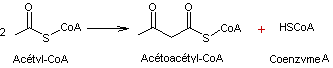
- 1 –
|
|
Réaction
catalysée par l'enzyme Acétyl-CoA C-acétyltransférase
- 2 –
|
|
Réaction
catalysée par l'HMG-CoA synthase
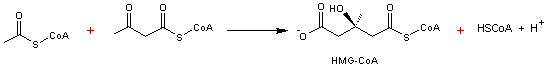
Il s'agit de
l'addition du radical acétyle de l'acétyl-CoA sur la fonction cétone de
l'acétoacétyl-CoA par une réaction de type cétolisation (voir annexe
3) suivie d'une hydrolyse qui permet le départ du coenzyme A.
- 3 –
|
|
Réaction
catalysée par l'HMG-CoA réductase un enzyme clé (voir annexe
4)
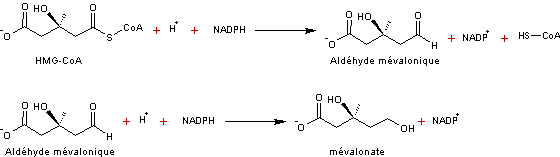
Remarque :
Afin de
simplifier l'écriture de ces réactions biochimiques, on adopte de nouveaux
symboles (flèches courbes) pour désigner les groupes ou molécules entrants et
les groupes ou molécules sortants.
Ainsi, les
équations chimiques de la troisième
étape, le passage de HMG-CoA au mévalonate s'écrivent :
3) Biosynthèse des polycétides
3-1) Equations
fondamentales de départ d'une chaîne polycétide
- 1 - Le
point de départ est la formation de l'acétylCoA et du malonylCoA comme cela vient
d'être décrit ci-dessus à partir de l'acide éthanoïque.
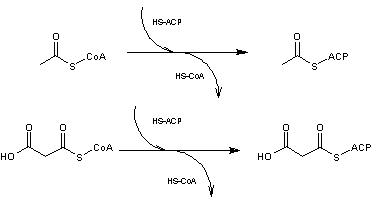
- 2 –
L'acétylCoA et le malonylCoA sont transformés chacun de leur côté en agent de
transfert du groupe acétyle sous l'action d'une protéine transporteur d'acyle
HS-ACP (ACP S-
acétyltransférase pour l'acétylCoA et ACP S- malonyl transférase pour le
malonylCoA) :
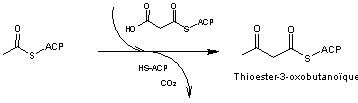
- 3 - Les
produits formés se condensent avec élimination de CO2
La séquence
ci-dessus peut se répéter, à partir du thioester -3- oxobutanoïque avec comme
unité d'extension le malonyl-CoA et on aboutit à un polycétide
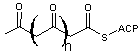
Ces réactions de condensation sont des condensations de Claisen (voir annexe 5)
3-2) Biosynthèse
de polycétides fondamentaux :
- 1 – Les
tétracétides :
Ils ont 4 groupements
C=O ; dans la formule générale donnée ci-dessus n = 2
A partir de
l'acétylCoA il faut 3 unités d'extension malonyl-CoA pour l'obtenir.
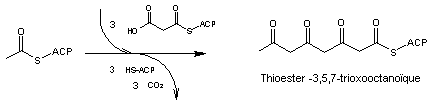
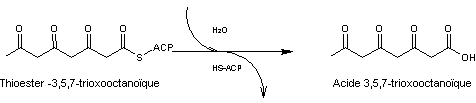
L'hydrolyse
de ce composé conduit à l'acide 3,5,7-trioxooctanoïque
- 2 – Les
octocétides
Ils ont 8
groupements C=O ; dans la formule générale donnée ci-dessus n = 6
A partir de l'acétylCoA
il faut 7 unités d'extension malonyl-CoA pour l'obtenir.
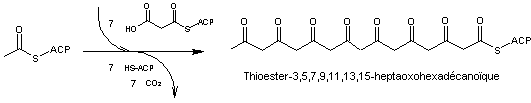
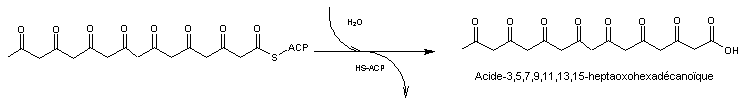
L'hydrolyse
de ce composé conduit à l'acide 3,5,7,9,11,13,15-heptaoxohexadécanoïque
L'ensemble de ces réactions qui conduisent aux polycétides sont catalysées
par des enzymes, les polycétides-synthases PKS.
3-3) Biosynthèses
de quelques molécules dérivées de polycétides
3-3-1) de tétracétides
|
Acide orsellinique et acide 6-méthylsalicylique |
L'acide 3,5,7-trioxooctanoïque un tétracétide,
![]()
est cyclisé
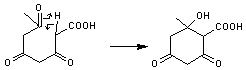
Ensuite par des réactions sans rapport avec la cyclisation on peut obtenir
diverses molécules
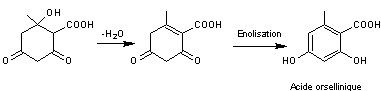
Ce polyphénol est un constituant commun des lichens des genres Aspergillus
et Penicillium.
S'il intervient une hydrogénation partielle dans la chaîne réactionnelle
de biosynthèse ci-dessus, il se forme de l'acide 6-méthylsalicylique
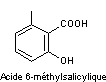
une molécule produite par Penicillium griseofulvum.
3-3-2) d'octocétides
Deux exemples de cyclisation d'octocétides :
|
Germichrysone |
La germichrysone est un dérivé tétrahydroanthracénique que l'on trouve
dans Cassia occidentalis, un arbuste d'Amérique tropicale d'environ 1,5m
de haut :
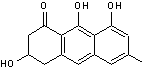
Sa biosynthèse à partir d'un octocétide est la suivante :
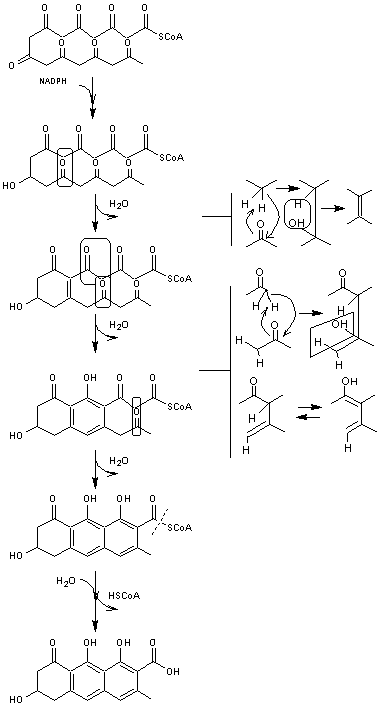
A ce stade se trouve réalisé un composé cyclique avec les 16 carbones de
l'octocétide de départ. Ces cyclisations multiples mettent en jeu aldolisations
et énolisations.
Ensuite, des réactions supplémentaires permettent d'aboutir à divers
composés que l'on trouve dans la nature.
Par décarboxylation par exemple on aboutit à la germichrysone :
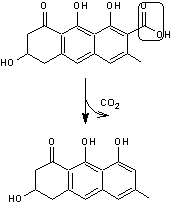
|
Emodine |
L'émodine est une molécule présente dans diverses plantes dont la rhubarbe
(Rheum officinale) et la bourdaine (Rhamnus frangula, petit arbre
qu'on trouve dans certaines régions de l'est du Canada et les provinces des
Prairies) et qui a des propriétés laxatives et purgatives.
La biosynthèse de cette molécule a lieu à partir de l'acide
3,5,7,9,11,13,15-heptaoxohexadécanoïque
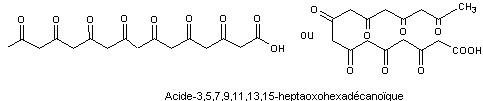
Par des mécanismes analogues à ceux décrits pour la germichrysone :
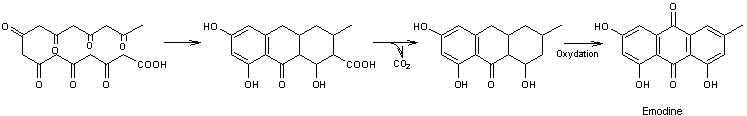
4) Biosynthèses d'autres familles :
Comme il a été dit au départ, les molécules qui donnent lieu à la
biosynthèse des polycétides sont aussi à l'origine de la biosynthèse de
certaines grandes familles de produits naturels.
A partir d'acétyl coenzyme A
- par une voie dite
"acétate-polymalonate" on obtient les acides gras
- par une voie dite
"mévalonate" on obtient les terpènes, les stérols et les
caroténoïdes.
4-1) Acides gras saturés
Les acides
carboxyliques saturés ou insaturés, à chaîne linéaire (donc non ramifiée)
dont les plus importants contiennent de 12 à 22 atomes de carbone sont appelés
acides gras.
Les acides gras naturels ont des chaînes à nombre de carbones pair (une
exception notable pour l'acide isovalérianique ou acide phocénique que l'on
rencontre sous forme d'ester du glycérol dans les huiles de dauphin et de
marsouin), qui peuvent comporter jusqu'à 6 doubles liaisons en position
malonique (toujours espacées de 3 carbones =CH-CH2-CH=) et de
configuration cis (Z).
Leur origine naturelle, les corps gras, a donné à cette classe de composés son
nom.
Les graisses d'origine animale ou végétale sont en effet des triesters du glycérol et d'acides gras.
On ne peut parler d'acides gras sans mentionner le nom de Michel-Eugène Chevreul et ses
travaux mémorables pour déterminer la composition des matières grasses.
On va
s'intéresser à la biosynthèse des acides gras saturés.
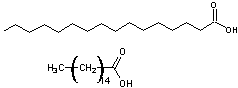
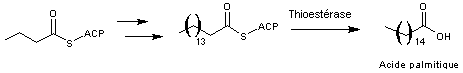
Prenons
comme exemple l'acide palmitique ou acide hexadécanoïque
- 1 - Le
point de départ est la formation de l'acétylCoA et du malonylCoA (voir synthèse du malonylCoA)
- 2 –
L'acétylCoA et le malonylCoA sont transformés chacun de leur côté en agent de
transfert du groupe acétyle sous l'action d'une protéine transporteur d'acyle
HS-ACP (ACP S-
acétyltransférase pour l'acétylCoA et ACP S- malonyl transférase pour le
malonylCoA) :

- 3 - Les
produits formés se condensent avec élimination de CO2 (l'enzyme étant le 3- cétoacétyl-ACP
synthase) :

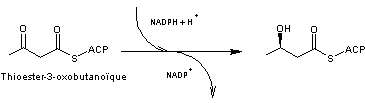
- 4 – Le
thioester formé subit une première réduction par le couple NADP+/NADPH
(l'enzyme
étant le 3- cétoacétyl-ACP réductase) ; le groupe cétone du carbone 3 est réduit en groupe
hydroxyle :
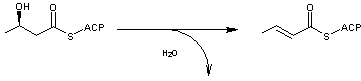
- 5 – Une
déshydratation conduit à une double liaison trans entre les carbones 2
et 3 ( l'enzyme
étant le 3-hydroxyacyl- ACP déshydratase ) :
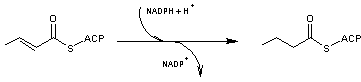
- 6 – Le
composé formé subit une réduction de la double liaison par le couple NADP+/NADPH
(l'enzyme
étant l'énoyl-ACP réductase)
Par
itération à partir du stade 3, en remplaçant chaque fois la protéine R-CO-S-ACP par celle obtenue à l'étape 6 et
avec le malonyl comme module d'extension, on obtient un ensemble à 16 carbones
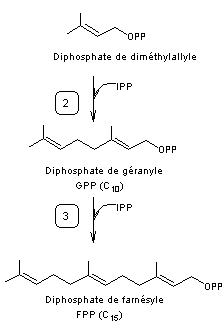
4-2) Terpènes –
Stéroïdes - Caroténoïdes
4-2-1) Schéma général de synthèse :
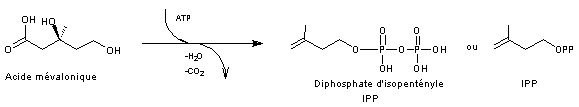
A partir de l'acide mévalonique on passe à une unité isoprène par
phosphorylation des 2 groupes alcool de l’acide mévalonique (grâce à l’ATP)
puis par élimination d’eau avec formation d’une double liaison C=C, puis par
décarboxylation (-CO2), l’ensemble conduisant au
3-méthylbut-3-ènylpyrophosphate appelé aussi diphosphate d'isopentényle et
abrégé en IPP
Il y a ensuite isomérisation de l'IPP grâce à
l'isopentényle diphosphate isomérase qui conduit au diphosphate de
diméthylallyle ou DMAPP :
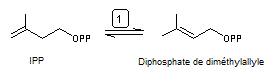
puis une succession de réactions conduisant aux différentes familles
auxquelles on s'intéresse :
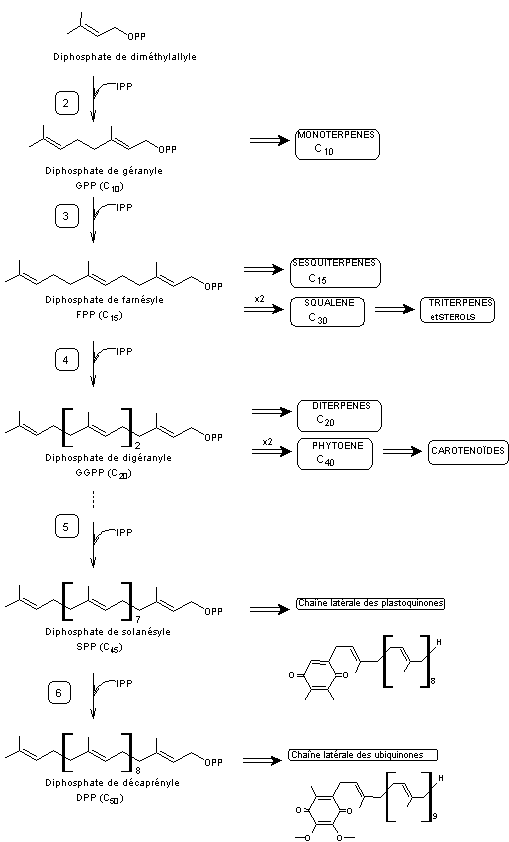
Les enzymes qui interviennent aux premières étapes :
- 2 – Géranyldiphosphate
synthétase
- 3 – Farnésyldiphosphate
synthétase
- 4 -
Géranylgéranyldiphosphate synthétase
4-2-2) Les terpènes :
Le nom vient du mot
allemand Terpen (1866) provenant de das Terpentin : la térébenthine. L'emprunt
francisé terpène date de la fin du XIXème siècle (1871).
Au sens strict, les terpènes sont des hydrocarbures mais de
nombreux dérivés (alcools,aldéhydes,cétones, acides), de structure apparentée,
sont considérés comme des composés terpéniques.
Ils sont présents, dans les végétaux, dont ils sont souvent les
constituants "de senteur" (térébenthine,camphre, menthol, citronelle)
; on les extrait sous forme d'huiles essentielles pour la parfumerie.
Certains d'entre eux ont un rôle biologique important (hormones,vitamines).
- Formule brute :
La formule brute générale est (C5H8)n
Avec n = 1 l'isoprène
n = 2 C10H16 monoterpènes
n = 3 C15H24 sesquiterpènes
n = 4 C20H32 diterpènes
N = 5 C25H40 sesterterpènes
n = 6 C30H48 triterpènes
n = 8 C40H64 tétraterpènes
- Structure :
Certains ont une structure acyclique; ils
comportent un nombre de doubles liaisons correspondant à leur formule brute 3
pour C10H16; 5 pour C20H32 ;7
pour C30H48
D'autres ont un ou plusieurs cycles soit un nombre plus réduit de doubles
liaisons; par exemple pour C10H16 un cycle et 2
doubles liaisons ou 2 cycles et une double liaison.
On peut structurellement
les considérer comme des polymères de l'isoprène
(2-méthylbuta-1,3-diène)
![]()
On peut en effet, toujours "découper" en "motifs isoprènes"
la formule d'un terpène: 2 motifs pour un monoterpène, 3 pour un sesquiterpène,
8 pour un tétraterpène;
exemple: Ocimène (présent dans le basilic)
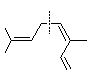
Il existe aussi des
composés terpéniques oxygénés
Leurs chaînes carbonées sont analogues à celles des hydrocarbures acycliques
correspondants mais avec souvent une insaturation moindre ; exemple: le menthol,
C10H19OH est monocyclique et saturé; il
possède le même squelette que le limonène C10H16 monocyclique et possédant 2
doubles liaisons.
4-2-2-1)
Biosynthèse des monoterpènes à partir du
diphosphate de géranyle (GPP)
- Monoterpènes acycliques
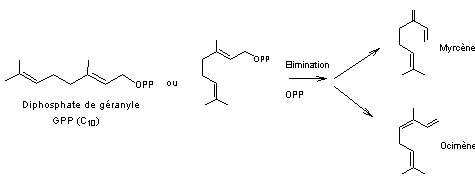
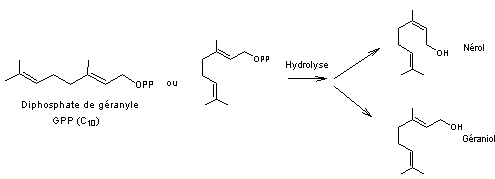
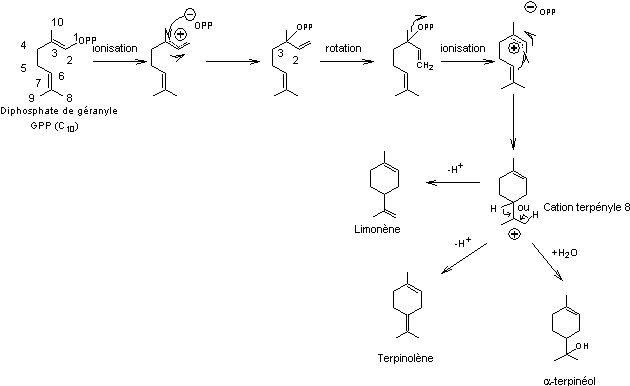
- Monoterpènes cycliques
Formation du limonène, du terpinolène, de l'α-terpinéol
Un exemple de synthèse d'un monoterpène bicyclique à partir du GPP : le
camphre

4-2-2-2)
Biosynthèse des sesquiterpènes à
partir du diphosphate de farnésyle (FPP)
- Sesquiterpènes acycliques
Exemple de la biosynthèse des farnesols.
Le farnesol est un alcool sesquiterpénique (2 isomères). C'est l'une des
substances les plus répandues dans le règne végétal à l'odeur de muguet.
Le 2-trans,6-trans-farnesol (E,E-farnesol) agit comme une hormone sur certains
insectes. Il intervient dans la métamorphose de la chenille au papillon.
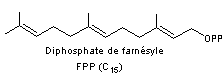
ou
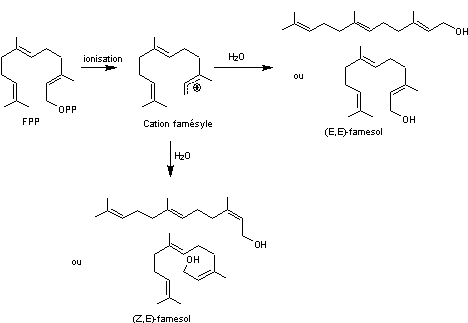
La formule moléculaire des farnesols est C15H26O.
- Sesquiterpènes cycliques
Exemple de la biosynthèse du bisabolol.
Le composé racémique se trouve à l'état naturel
dans l'huile de bergamote et est utilisé en cosmétique.
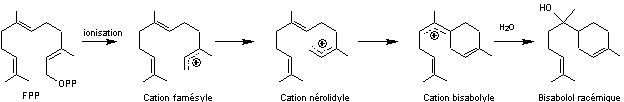
La formule moléculaire du bisabolol est C15H26O.
4-2-2-3)
Biosynthèse des triterpènes à partir
du diphosphate de farnésyle (FPP)
- Triterpènes acycliques
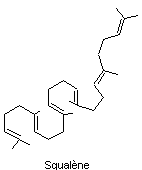
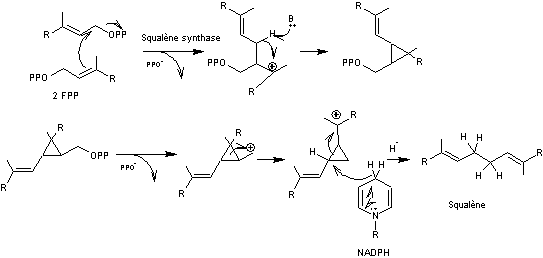
Exemple de la biosynthèse du squalène
Il contient comme tous les triterpènes 6 unités isoprène c'est un
hydrocarbure en C30. C'est un précurseur métabolique des stérols
Son nom vient de ce qu'on en trouve dans le foie de requin.
J.W.Cornforth le
synthétise la première fois à partir de l'acide mévalonique.
Deux molécules de pyrophosphate de farnésyl ou diphosphate de farnésyle
(FPP) peuvent s'unir lors d'un couplage tête à tête
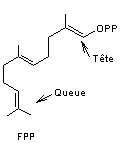
en milieu réducteur pour donner le squalène

Le mécanisme :
On peut présenter différemment le squalène dans l'espace par rotation
autour des simples liaisons C-C :
|
|
ou encore |
|
La formule moléculaire du squalène est C30H50.
- Triterpènes cycliques
On prendra l'exemple du lanostérol qui est un alcool terpénique.
Le lanostérol est un triterpène tétracyclique duquel tous les
stéroïdes sont dérivés.
C’est aussi un des constituants du
suint de mouton (Le suint est la graisse qui imprègne la toison des moutons dans
le poids de laquelle elle entre pour 25 à 60% selon les races).
Le nom lanostérol est donc dérivé du
latin lana (laine).
Le point de départ de cette
biosynthèse est le squalène
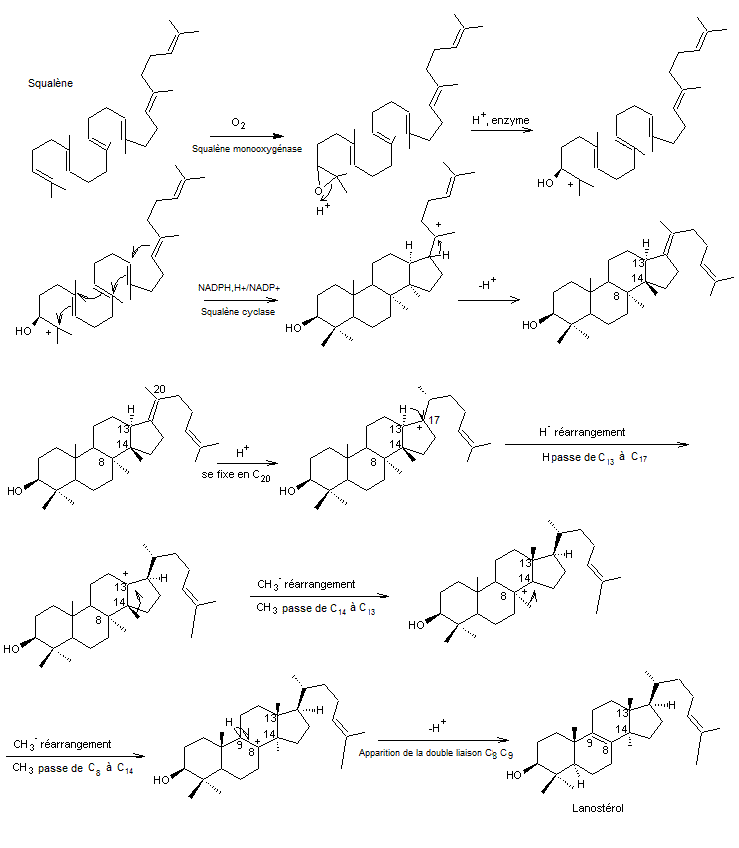
Le lanostérol ou Lanosta-8-24-dièn-3-ol,
(3β) a pour formule moléculaire C30H50O
4-2-2-4)
Biosynthèse des diterpènes à partir
du diphosphate de digéranyle (GGPP)
- Diterpènes
acycliques
On prendra l'exemple du phytol
Composé oxygéné que l'on trouve sous
forme estérifiée dans la structure de la chlorophylle, on le
retrouve donc comme produit de dégradation de celle-ci.
Sa synthèse fut menée pour la
première fois par Franz Gottwald Fischer, en 1928.
Sa biosynthèse a lieu à partir du
diphosphate de digéranyle (GGPP) qui subit trois réductions par le
couple NADP+/NADPH puis une hydrolyse :
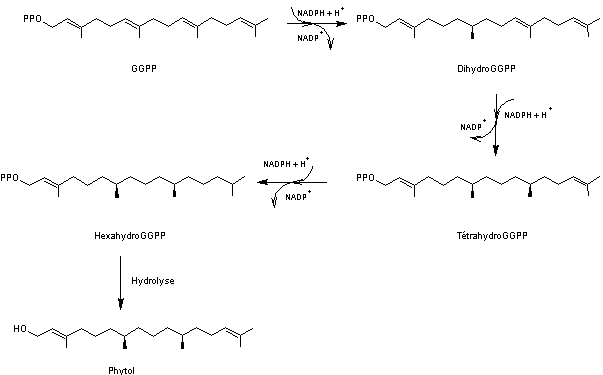
Le phytol ou 3,7,11,15,-tétraméthylhexadéc-2-èn-1-ol
a comme formule moléculaire C20H40O.
- Diterpènes
cycliques
On prendra l'exemple du labdane :
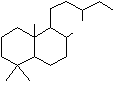
c'est un diterpène dont la structure
se retrouve dans de nombreux composés naturels.
Ainsi dans la résine sandaraque, une
résine commune exsudée d'un conifère Tetraclinis articulata qui a été
utilisée du XIIème au XVème siècle comme vernis alcoolique (dissoute dans de
l'huile de lin et de l'alcool) puis de nouveau au XVIIème siècle et au XVIIIème
comme vernis maigre dans la peinture d'art, on retrouve l'acide
agathique :
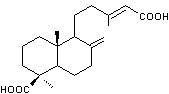
ayant une structure comportant un
noyau labdane.
La biosynthèse du labdane à partir
du diphosphate de digéranyle (GGPP) est la suivante :
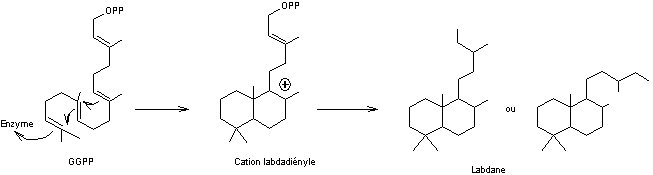
La formule moléculaire du labdane est C20H38.
4-2-2-5)
Biosynthèse des tétraterpènes à partir
du diphosphate de digéranyle (GGPP)
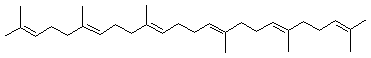
On prendra l'exemple du phytoène
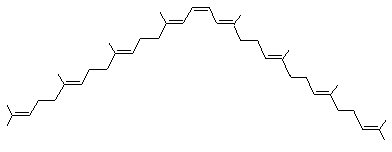
La biosynthèse s'effectue à partir de deux molécules de diphosphate de
digéranyle.
Les premières étapes du mécanisme sont celles rencontrées lors de la
biosynthèse du squalène :
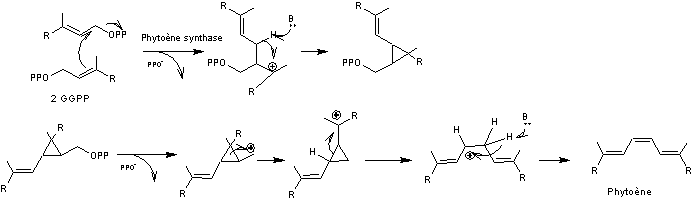
4-2-2-6)
Biosynthèse de polymères isopréniques
La biosynthèse du caoutchouc naturel (dérivé cis) et de la gutta-percha (dérivé
trans) avec comme point de départ l’acide éthanoïque et le coenzyme A (CoASH) est la même que
celle des terpènes.
- Gutta-percha
Au stade 3 (voir
schéma général de synthèse) on obtient le diphosphate de farnésyle (FPP)
Si l’on continue à ajouter des unités à cinq carbones au diphosphate de
farnésyle selon le même processus on aboutit à la gutta-percha ou
trans-polyisoprène-1-4,
![]()
de formule brute (C5H8)n avec n environ
égal à 1500.
Cette macromolécule provient du latex de certains arbres de Malaisie et
d'Amérique du sud (Pallaquium oblongifolia). C'est un matériau
blanchâtre, rigide, de densité 1,010 à 1,020 insoluble dans l'eau l'éthanol,
l'éther et qui devient plastique au chauffage. Il a été utilisé comme isolant
des câbles électriques plongés dans l'eau.
- Caoutchouc
naturel (NR Natural Rubber)
Au stade 2 (voir schéma général de synthèse) au lieu d'obtenir du
diphosphate de géranyle il peut se former (voir stade 2' ci-dessous) du diphosphate de
néryle, le composé formé étant cis au niveau de la première double liaison.
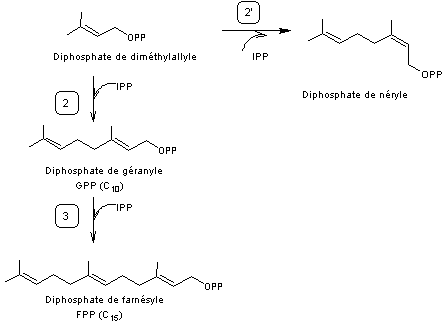
Si l’on continue à ajouter des unités à cinq carbones au diphosphate de
néryle selon le même processus on aboutit au caoutchouc naturel ou
cis-polyisoprène-1-4,
![]()
Le caoutchouc naturel
est obtenu à partir du latex de l'hévéa (Hevea brasiliensis) un arbre
originaire des régions tropicales. Lorsqu'il coule de l'arbre, le latex est un
liquide laiteux composé de 2/3 d'eau et d'1/3 de caoutchouc. En acidifiant ce
liquide, le latex coagule libérant le caoutchouc solide qu'il avait en
suspension.
Le caoutchouc ainsi récupéré est un solide blanc, un peu moins dense que l’eau,
soluble dans le benzène (C6H6), le tétrachlorométhane
(CCl4). Il se soude à lui-même, à froid, par simple pression. A
température inférieure à 5°C, il est cassant ; à température supérieure à 35°C,
il se ramollit. Il est laminé et les feuilles sont séchées par un courant d'air
chaud, puis fumées au feu de bois pour en assurer la conservation. On l'appelle
alors "crêpe".
Le caoutchouc appartient à la famille des élastomères. Ce sont des substances
qui sous l'effet de la traction subissent un allongement important qui cesse
quand l'action mécanique cesse.
4-2-3) Les stérols
On a déjà abordé la synthèse des stérols en décrivant la biosynthèse du lanostérol
qui est un alcool triterpénique tétracyclique mais aussi un stérol ; c'est de
lui que dérivent l'ensemble des stéroïdes.
On va examiner la synthèse du cholestérol
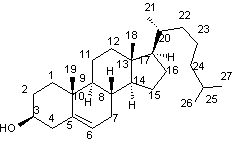
C’est un des stéroïdes
les plus répandus que l’on retrouve en assez grande quantité tant chez les
animaux que chez les humains (200 à 300 g chez un humain adulte).
Produit par le foie. Synthèse totale par Robinson .
Il est présent dans presque tous les tissus soit à l'état libre soit sous
forme d'ester (palmitate, oléate,...). L'organisme humain a besoin d'environ 1g de
cholestérol par jour. Dans la bile il est maintenu en
solution à la fois par la lécithine et les substances tensioactives présentes
dans les sels biliaires. La diminution du taux de ces substances entraîne sa
cristallisation (calculs biliaires).
C'est un constituant important des
membranes biologiques ; il participe à la régulation de leur viscosité et
augmente leur imperméabilité vis-à-vis des molécules hydrophiles. C'est aussi
un précurseur des hormones stéroidiennes, des acides biliaires et de certaines
vitamines (D par exemple).
Sa biosynthèse s'effectue à partir du lanostérol.
La conversion du lanostérol en cholestérol implique le départ de 3 groupes
méthyl en position 4,4,14 par oxydation en CO2, le glissement de la
double liaison C8-C9 vers C5-C6
ainsi que la réduction de la double liaison C24-C25, ce que nous allons résumer par le schéma
suivant :
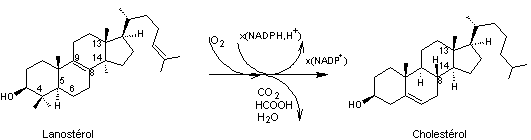
4-2-4) Les caroténoïdes
Les caroténoïdes sont des pigments qui absorbent la lumière entre 380 et 750
nm. Ils colorent en jaune, orange, exceptionnellement en rouge, la carotte, les
abricots, le maïs, la citrouille, le safran, les œufs, la crème de lait, les
crustacés cuits, les feuilles en automne, la tomate, etc…. Ils sont masqués par
la chlorophylle dans les feuilles vertes.
Ils regroupent les carotènes, qui sont des hydrocarbures et les
xanthophylles qui portent des fonctions alcool, cétone, époxy ….
Ce sont des métabolites secondaires principalement synthétisés par des
végétaux, mais aussi dans une moindre mesure par des levures des champignons,
des algues marines et certaines bactéries.
- Les carotènes
Exemple : le β-carotène
il possède 40 carbones et deux cycles identiques ; Il est le précurseur de
la vitamine A.
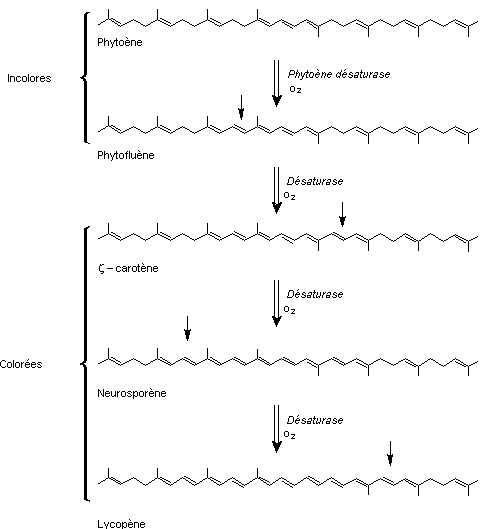
La biosynthèse du β-carotène a lieu à partir du phytoène
|
|
ou |
|
un tétraterpène (40 carbones) qui n'est pas un caroténoïde ; il absorbe à
287 nm et est donc incolore. Bien que possédant 9 liaisons doubles il ne
constitue pas un chromophore car seulement 3 d'entre elles sont conjuguées.
Le phytoène va subir plusieurs désaturations successives.
Pour les plantes supérieures, les algues et les cyanobactéries, deux
désaturations vont d'abord mener au ζ-carotène grâce au phytoène
désaturase. Ces réactions sont stimulées par le NAD, le NADP et l'oxygène
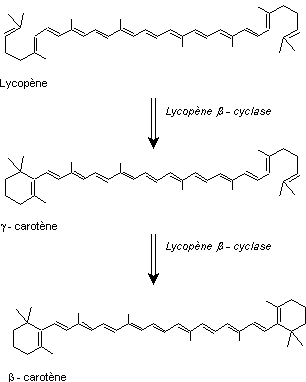
Le lycopène β-cyclase permet ensuite d'insérer deux cycles aux
extrémités de la molécule de lycopène
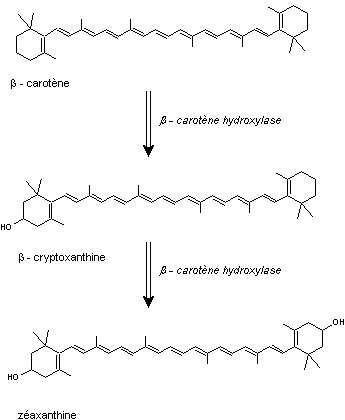
- Les xanthophylles (du grec xanthon = jaune et phullon
= feuille)
Ce sont des pigments jaunes, dérivés oxygénés des carotènes
Exemple : la zéaxanthine
Molécule dérivée du β-carotène
Elle est voisine et à action comparable à celle de la lutéine dans l'organisme
humain notamment au niveau de l'œil où elle est surtout localisée au centre de
la macula.
Elle
ne diffère de la lutéine que par la position de la double liaison dans le cycle
principal de la molécule.
De
ce fait, la lutéine a trois carbones asymétriques, alors que la zéaxanthine
n'en a que deux.
On
en trouve dans les algues vertes et rouges.
La biosynthèse a lieu à partir du β-carotène par double
hydroxylation sur les cycles terminaux :
Métabolites
secondaires
Ce sont des
composés organiques issus du métabolisme, essentiellement des plantes,
bactéries champignons et de quelques animaux.
Ils ne
participent pas directement à l'assimilation des nutriments ; ils ont plutôt
des fonctions de relation de l'organisme qui les produits avec l'extérieur
(défense, communication…).
Chimiquement
parlant on distingue trois types de métabolites secondaires :
- Phénol (tanins, flavonoïdes
..)
- Azotés (alcaloïdes, bétalaïnes
..)
- De type terpène
Mécanisme de
l'oxydation de l'éthanol en éthanal par NAD+

Cétolisation
Il s'agit de
l'addition d'une cétone en milieu basique sur une autre cétone
![]()
Mécanisme :

Enzyme-clé
Dans une
voie métabolique, on appelle enzyme-clé celui dont la vitesse de réaction est
la plus faible et qui contrôle donc la vitesse de cette voie.
Condensation de Claisen
Les esters dont l'atome de carbone en α du groupement
fonctionnel porte un ou des atomes d'hydrogène, peuvent subir une réaction
d'autocondensation qui conduit à un β-céto-ester :
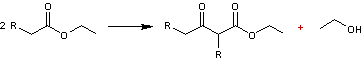
La réaction a lieu en milieu basique fort: éthanolate
de sodium
Mécanisme:

On peut aussi faire réagir une cétone et un ester en
milieu fortement basique (C2H5O-) et on
aboutit par le même mécanisme à une β-dicétone.