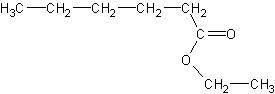CHEWING-GUM
Gérard GOMEZ
1) Généralités
:
Chewing-gum
est le nom le plus courant (d'origine anglaise) de la gomme à mâcher vendue
dans le commerce.
Les
premiers chewing-gums étaient constitués de la sève (latex appelé chiclé) de différents arbres (conifères
ou sapotillier) que les hommes préhistoriques déjà ou plus tard les Mayas au
Mexique  mastiquaient à longueur de journée.
mastiquaient à longueur de journée.
 Le mastic (ce mot vient
probablement du verbe µασσω : mâcher) de l'île grecque de
Chio est aussi une résine qui suinte du tronc et des branches principales du
lentisque ou arbre à mastic (Pistacia
lentiscus) lorsqu'on pratique une entaille avec un objet pointu ; il
continue à être exploité de nos jours et sert à fabriquer des chewing-gums
(marque Elma®) des dentifrices, des parfums, des liqueurs et des produits pour
aromatiser les pâtisseries.
Le mastic (ce mot vient
probablement du verbe µασσω : mâcher) de l'île grecque de
Chio est aussi une résine qui suinte du tronc et des branches principales du
lentisque ou arbre à mastic (Pistacia
lentiscus) lorsqu'on pratique une entaille avec un objet pointu ; il
continue à être exploité de nos jours et sert à fabriquer des chewing-gums
(marque Elma®) des dentifrices, des parfums, des liqueurs et des produits pour
aromatiser les pâtisseries.
De nos
jours cependant, la plupart des gommes à mâcher sont fabriquées à partir de
polymères synthétiques.
2) Composition
chimique des gommes à mâcher :

On
trouve dans tous les chewing-gums au moins quatre constituants :
- La gomme de base
- Un agent de consistance
- Un édulcorant au sens large
(composé donnant à la gomme un goût sucré)
- Un composé servant d'arôme.
2-1)
La gomme de base :
Elle
n'est pas soluble dans l'eau, ni dans la salive.
-
Pour les chewing-gums dits "naturels" il s'agit de la résine issue
des arbres (chiclé, obtenu par ébullition du latex extrait, ou bien mastic).
Elle est essentiellement formée de chaînes, constituées d'environ une centaine
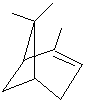
de motifs isoprène assemblés, mélangées à des terpènes (α-pinène et
β-myrcène en forte concentration par exemple pour le mastic) (voir illustration 1).
-
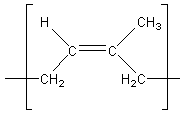
Pour les gommes dites "artificielles" il s'agit la plupart du temps d'un
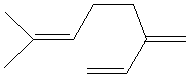
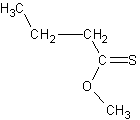
caoutchouc synthétique (caoutchouc butyle) obtenu par copolymérisation de
l'isobutène avec le butadiène ou l'isoprène (voir illustration
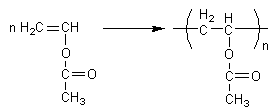
2). C'est parfois un autre polymère : le poly(acétate de vinyle) (voir illustration 3).
2-2)
L'agent de consistance :
On
incorpore souvent à la gomme de base de la cire pour "ramollir" le
polymère et le rendre moins difficile à mastiquer. C'est la plupart du temps de
la cire de carnauba qui est un mélange d'esters gras (80% environ), d'alcools
gras (13% environ), d'acides gras (5% environ), d'hydrocarbures (2% environ).
Rappelons
que les acides gras sont des acides carboxyliques saturés ou insaturés dont les
plus importants contiennent de 12 à 22 atomes de carbone, que les principaux
alcools gras sont les alcools myristilique, cétylique et myricique (voir illustration 4), et que les esters gras sont des
molécules formées à partir d'alcools gras et d'acides gras.
Cette
cire, dont le code alimentaire est E903, dont la densité est 0,97 et qui est
pratiquement insoluble dans l'eau et dans l'éthanol, provient de Copernicia cerifera (nom commun Copernicia prunifera) un palmier à
tronc unique droit, haut de 10 à 12m ; ses larges feuilles vertes en éventail
sont enduites de cette cire que l'on appelle aussi cire du Brésil car ces
arbres poussent bien dans le nord-est de ce pays. On en tire environ 7 kg par
palmier. La cire de carnauba résiste un peu mieux à la chaleur que la cire
d'abeille ; elle fond vers 85°C.
2-3) Les édulcorants au sens
large (Composés donnant un goût sucré) :
Suivant
les cas cela peut être (la liste n'est pas exhaustive) :
- du Saccharose (sucre commun, solide à température ambiante et très
soluble dans l'eau) qui est considéré comme un dissaccharide c'est-à-dire un
composé formé de deux glucides simples, le glucose et le fructose. La structure
de sa molécule est :
:
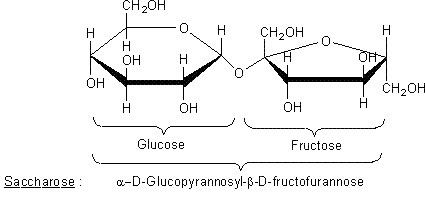
- du D-Glucose (solide à
température ordinaire) ; plusieurs représentations sont possibles pour la
molécule de ce composé parmi lesquelles la forme ouverte ou la forme dite
α-D-Glucopyrannose :
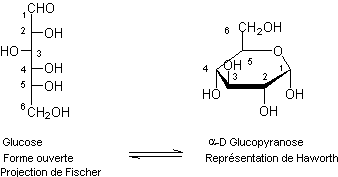
La
douceur relative du glucose se situe environ entre 50 et 80% de celle du sucre
ordinaire, tandis que son apport calorique est le même ; il est très soluble
dans l'eau.
Mais
les fabricants incorporent souvent à la place des glucides qui ont le défaut de
favoriser les caries dentaires, des polyols (polyalcools) tels que :
- du D-Glucitol (ou D-Sorbitol) édulcorant E420 dont la
représentation en forme ouverte selon la représentation de Fischer est :
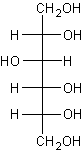
Il peut
être obtenu par réduction de la fonction aldéhyde du D-Glucose par le
borohydrure de sodium, mais il existe aussi naturellement dans les algues
rouges, certaines baies, dans les poires,
les pommes, les cerises, les prunes…Son pouvoir sucrant correspond à 60% de
celui du saccharose mais il présente l'avantage par rapport à celui-ci de ne
pas favoriser les caries dentaires. Son apport énergétique est inférieur de 30%
à celui du saccharose. C'est un solide à température habituelle. Il est très
soluble dans l'eau.
- du Xylitol :
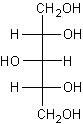 C'est un solide à température ordinaire ; il est soluble
dans l'eau.
C'est un solide à température ordinaire ; il est soluble
dans l'eau.
Sa
structure à cinq carbones ne permet pas son métabolisme par les bactéries
buccales mais aussi il n'abaisse pas le pH de la salive au dessous du seuil
critique qui déclenche la dégradation de l'émail et provoque les caries. Il possède un pouvoir sucrant correspondant à
50% de celui du saccharose, mais avec un apport énergétique de 30% moindre.
La production
industrielle de xylitol se fait à partir de polysaccharides (xylanes) fréquents
dans la biomasse et en particulier dans certains arbres, l'hydrolyse des
xylanes conduisant au xylose, le passage du xylose au xylitol se faisant
ensuite par réduction par l'hydrogène en présence de nickel Raney ; le bois de
bouleau (Betula pendula et betula lenta) contient par exemple 25% de
xylanes. On utilise aussi les épis de maïs.
Le code
du xylitol comme édulcorant est E967.
-
du
D-Mannitol (ou
acide Cordycépique) :
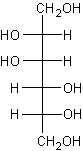 C'est un solide à température ordinaire ; il est très
soluble dans l'eau.
C'est un solide à température ordinaire ; il est très
soluble dans l'eau.
Son
pouvoir sucrant correspond à environ 70% de celui du saccharose avec un apport
énergétique de 55% moindre. Son caractère acide en solution, plus marqué que
celui des autres polyols fait qu'on lui adjoint souvent de l'hydrogénocarbonate
de sodium pour ajuster le pH. On le désigne comme édulcorant par le code E421.
Absorbé en quantité importante (plusieurs grammes) il a un effet laxatif.
On peut
l'obtenir par hydrogénation catalytique du mannose.
Le
mannitol est aussi souvent incorporé comme agent anti-collant.
-
du
Maltitol (ou
4-O-α-glucopyranosyl-D-sorbitol)
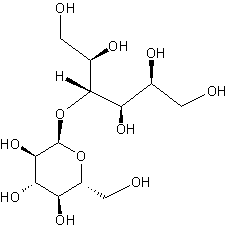
C'est un
édulcorant dont le pouvoir sucrant correspond à environ 80% de celui du
saccharose avec un apport énergétique de 30% moindre.
On peut
l'obtenir par hydrogénation catalytique du maltose.
Son code
comme édulcorant est E965.
C'est
un solide à température ambiante ; il est soluble dans l'eau.
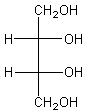
Polyol existant dans le soja, dans
certains fruits (raisin, melon…) dans certains champignons ainsi que dans le vin. Il a un pouvoir sucrant qui
correspond à 70% de celui du saccharose, ne provoque pas de caries et son
caractère énergétique correspond seulement à 5% de celui du sucre.
C'est un solide à température
ambiante ; il est soluble dans l'eau.
Ces édulcorants sont introduits lors
de la préparation du chewing-gum, soit à l'état solide (poudre de granulométrie
appropriée, ce paramètre ayant une grande importance dans la persistance du
goût, problème qui sera évoqué plus loin) soit en solution dans de l'eau ou un
autre solvant, parfois du glycérol (appelé aussi glycérine).
La plupart des polyols donnent, lors
de leur dissolution dans l'eau de la salive, une sensation de fraîcheur qui
contribue à "l'haleine fraîche" vantée par les publicités pour ces
gommes à mâcher. Ils sont en outre non cariogènes comme nous l'avons déjà
indiqué et pour certains d'entre eux (Erythritol par exemple) pratiquement sans
apport énergétique.
Sur le plan strict de l'énergie
apportée, avons-nous intérêt à choisir les chewing-gums aux édulcorants polyols
plutôt que ceux ayant du saccharose ou du glucose ? Oui si comme dans le cas de
l'érythritol l'apport énergétique est pratiquement nul ; la réponse est moins
évidente pour les autres polyols que nous avons cités. En effet, bien que leur
apport énergétique soit inférieur à celui du saccharose, il faut tenir compte
du fait que bien souvent leur pouvoir sucrant est dans le même temps inférieur
aussi à celui du sucre ce qui conduit à en augmenter la quantité pour ressentir
le même goût sucré et donc à perdre en partie le bénéfice énergétique que nous
recherchions.
D'autres édulcorants dits
"acaloriques" sont employés pour les personnes diabétiques. On trouve
notamment :
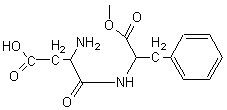 C'est
l'ester méthylique de l'aspartyl
C'est
l'ester méthylique de l'aspartyl
phénylalanine (Asp-Phé-OCH3). Ester dipeptidique, édulcorant artificiel hypocalorique, codé E951
dans le code des additifs. Son pouvoir sucrant est environ 200 fois supérieur à
celui du saccharose, son goût étant cependant reconnu comme légèrement moins
agréable. L'hydrolyse de l'aspartame dans l'organisme après absorption conduit
à sa dissociation en acide aspartique et phénylalanine. Les personnes ne devant
pas absorber de phénylalanine ne doivent donc pas en consommer.
C'est un solide soluble
dans l'eau.

Son pouvoir sucrant est
entre 130 et 200 fois supérieur à celui du sucre ordinaire (saccharose). Il est
aussi utilisé comme additif alimentaire (E950) à la place du sucre dans
d'autres confiseries.
Il a été découvert en
1967.
Découvert en 1937 son
pouvoir sucrant est entre 30 et 50 fois supérieur à celui du sucre. Son code
comme additif alimentaire est E952.
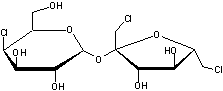 Le sucralose (E955) est autorisé en France depuis 2004. Il a été obtenu pour
la première fois en Grande-Bretagne en 1976 par synthèse en partant du
sucre ; on remplace dans la molécule de saccharose trois groupements
hydroxyle (-OH) par trois atomes de chlore. Son pouvoir sucrant est 600 fois
supérieur à celui du saccharose ; le goût sucré se conserve après
cuisson ; la DJA est de 15mg par kg de poids et par jour. Il n’est pas
cariogène et bien que considéré comme très peu énergétique, il semble être
retenu en partie (30%) par les graisses de l’organisme.
Le sucralose (E955) est autorisé en France depuis 2004. Il a été obtenu pour
la première fois en Grande-Bretagne en 1976 par synthèse en partant du
sucre ; on remplace dans la molécule de saccharose trois groupements
hydroxyle (-OH) par trois atomes de chlore. Son pouvoir sucrant est 600 fois
supérieur à celui du saccharose ; le goût sucré se conserve après
cuisson ; la DJA est de 15mg par kg de poids et par jour. Il n’est pas
cariogène et bien que considéré comme très peu énergétique, il semble être
retenu en partie (30%) par les graisses de l’organisme.
C'est un
solide très soluble dans l'eau.
2-4)
Les arômes :
L'arôme d'un aliment est dû aux
nombreux composés volatils (parfois plus de cent) qu'il contient, ces composés
se manifestant de deux manières : par leur odeur que le nez perçoit avant de mettre
l'aliment à la bouche, puis par voie rétro nasale lorsque cet aliment est placé
dans la bouche.
Les arômes naturels correspondent
aux composés extraits d'un produit naturel qui contribuent à lui donner son
arôme. L'extraction ne conduit pas forcément à l'obtention de tous les
constituants mais, si elle a été judicieusement choisie, aux molécules
principales participant à l'arôme. Dans certains cas, il ne s'agit que de
quelques molécules "dominantes".
Les arômes artificiels sont des
molécules synthétiques préparées parfois à partir d'autres molécules extraites
de produits naturels moins coûteux.
Les chewing-gums ont un arôme de
type "menthe" pour 75% d'entre eux, mais on trouve aussi de nombreux
autres "parfums" (fraise, citron….).
|
|
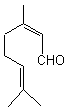
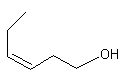
- L'arôme de type menthe est donné essentiellement par 3 molécules :
|
|
C'est en fait le lévomenthol ou D-(-)-menthol ou (1R,2S,5R)-menthol qui a
un point de fusion de 43°C. On le trouve en grande quantité dans la mentha piperita (menthe poivrée ou
peppermint (appellation anglo-saxonne)). Le menthol déclenche chimiquement les récepteurs
sensibles au froid et provoque une sensation de froid lorsqu'on l'absorbe ou
lorsqu'on mâche un chewing-gum qui en contient (cet effet est tout à fait
comparable à celui de la capsaïcine présente dans le poivre, sur les
récepteurs sensibles à la chaleur). |
|
La menthone : |
Accompagne le menthol dans les
plantes qui en contiennent. On peut aussi l'obtenir par oxydation en milieu
acide du menthol. |
|
|
On en trouve en quantité
appréciable dans la mentha spicata
(menthe verte) qui par ailleurs contient aussi du menthol et de la menthone |
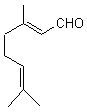
- L'arôme de type citron est lui aussi donné principalement par trois
molécules :
|
Le limonène :
|
C'est un
terpène que l'on trouve donc dans l'écorce du citron, mais aussi dans les
aiguilles de pin et sur les feuilles de menthe (mentha piperita). |
|
Le néral (ou citral a) :
|
C'est l'isomère Z du citral. On en
trouve outre le citron, dans les huiles essentielles d'orange, de verveine,
de citronnelle… |
|
Le géranial (ou citral b) :
|
C'est l'isomère E du citral. On en
trouve également dans les huiles essentielles d'orange, de verveine, de
citronnelle… L'odeur de citron du géranial est
beaucoup plus forte que celle du néral. |
- L'arôme de type fraise contrairement
aux deux précédents n'est pas dû à la présence de quelques molécules
dominantes. Si on veut le reconstituer il faudra mélanger au minimum une vingtaine
de molécules (par exemple : acide 2-méthylbutanoïque, acide éthanoïque, acide
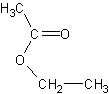
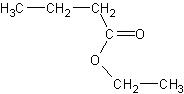
caproïque, acide propanoïque, éthanoate d'éthyle, butanoate d'éthyle, caproate
d'éthyle, cinnamate de méthyle, 2-méthylbutanoate d'éthyle, thiobutanoate de
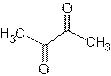
méthyle, sulfure de diméthyle, gamma décalactone, hexanal, (trans) hex-2-ènal,
hexan-1-ol, (cis) hex-3-èn-1-ol, linalol, maltol, citral, 2,3 butanedione,
furanéol, vanilline (voir illustration 5)) dans
des proportions parfaitement définies.
2-5)
Autres ingrédients :
Outre les quatre constituants de
base d'un chewing-gum il intervient souvent dans sa composition d'autres
ingrédients nécessaires par exemple à sa conservation ou introduits pour susciter
l'envie du consommateur ou aller dans le sens de ses attentes.
a) Comment faire
durer le "goût" d'un chewing-gum ?
On estime le temps moyen de mastication d'un
chewing-gum entre dix et trente minutes et on remarque souvent qu'après une
nette perception de l'arôme au départ, celui-ci disparaît et au bout de
quelques minutes le chewing-gum "n'a plus de goût".
Un problème rencontré par les
fabricants et difficile à résoudre est de permettre à la fois aux chewing-gums
de présenter un bon impact d'arôme au moment de la première mastication mais
également une bonne perception de cet arôme dans le temps. Ce problème, surtout
sensible pour les chewing-gums sans sucre vient du fait que les arômes sont
soit trop peu solubles dans l'eau et dans ce cas trop fortement retenus par la
gomme de base du chewing-gum, soit au contraire trop fortement solubles dans
l'eau et alors insuffisamment retenus par le polymère constituant la gomme.
Dans le premier cas l'arôme peu soluble dans l'eau donc dans la salive est peu
perçu lors de la première mastication, ce qui est décevant pour le
consommateur, dans le second cas l'impact de l'arôme est fort mais peu durable.
Différentes méthodes ont été mises
au point ayant pour but l'amélioration du partage de l'arôme entre la gomme de
base et l'eau (de la salive). Divers composants ont été introduits comme par
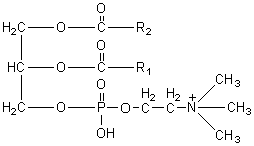
exemple des émulsifiants (lécithines (voir illustration
n°6)) ou des matrices hydrophiles assurant un meilleur relargage de l'arôme
(gélatine ou gomme arabique (voir illustration
n°7)). Une autre méthode consiste à incorporer des exhausteurs d'arôme (poudre
de cacao, glutamate de sodium, salicylate de méthyle, dérivés
du limonène… (voir illustration n°8). Une
autre méthode encore a été d'adapter la granulométrie des agents sucrants
hydrosolubles employés dans la formulation d'un chewing-gum ; un brevet
préconise par exemple l'utilisation d'au moins 60% de grains de saccharose d'un
diamètre inférieur à 45µm.
b) Les colorants :
Avant
le goût et l’arôme, de façon plus ou moins consciente, c’est bien souvent à
l’aspect et donc en partie à la couleur que nous nous référons dans le choix de
nos aliments.
Les colorants ne sont donc là que
pour susciter l'envie des consommateurs ; ils sont utilisés comme des codes
suggérant la nature de l'arôme du produit :
- Le vert par exemple est lié à l'arôme de type menthe verte ; bien
que les extraits naturels de menthe soient incolores on rappelle ainsi que les
plantes qui en contiennent possèdent des
feuilles d'un beau vert.
·
Le
colorant vert naturel le plus utilisé est la chlorophylle (code d'additif E140) ; grâce à ce pigment, les plantes captent l’énergie lumineuse nécessaire à
l’élaboration des tissus végétaux.
Il existe trois molécules de
chlorophylle : a ou α (C55H72MgN4O5),
b ou β (C55H70MgN4O6), d ou d (C54H70MgN4O6).
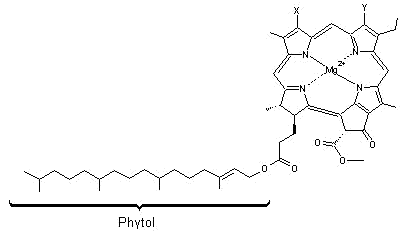
A : X = CH=CH2 Y =
CH3
B : X = CH=CH2 Y =
CHO
D
: X = CHO Y = CH3
Les chlorophylles sont obtenues par
extraction par solvant (souvent l'acétone) à partir de souches naturelles
d’herbes, de luzerne, d’orties et d’autres matières végétales comestibles.
L’élimination subséquente du solvant peut conduire à une séparation partielle
ou totale du magnésium naturel lié par coordination aux chlorophylles et à la
formation des phéophytines correspondantes. Les
principales matières colorantes sont les phéophytines (vert olive brun) et les
chlorophylles au magnésium. Après élimination du solvant, le produit extrait
contient d’autres pigments tels que des caroténoïdes, ainsi que des huiles,
graisses et cires provenant du matériel d’origine. C'est un solide cireux dont
la couleur varie du vert olive au vert foncé selon la teneur en magnésium
coordiné ; les chlorophylles sont liposolubles et peu stables.
Il existe souvent une confusion dans
l'esprit du public ; beaucoup de personnes pensent que le goût des chewing-gums
dits "à la chlorophylle" provient de ce composé ; en réalité la chlorophylle
n'a pas de goût, elle n'intervient que pour donner sa couleur au produit.
·
Un
colorant vert obtenu à partir de la chlorophylle :
Le complexe cuivrique de la
chlorophylle obtenu à partir de celle-ci en remplaçant l'ion magnésium par un
ion cuivre(II) est désigné dans le code des additifs par E141.
Les chlorophylles cuivriques sont
obtenues par addition d’un sel de cuivre à la substance extraite par solvant de
souches naturelles de matières végétales comestibles, d’herbes, de luzerne et
d’orties. Le solide obtenu est liposoluble, il est plus stable et sa couleur
est plus vive que celle de la chlorophylle.
·
Il
existe des colorants alimentaires verts non issus de produits naturels utilisés aussi pour des boissons.
Citons par exemple le
vert acide brillant (ou vert S) colorant alimentaire E 142
-
Le rose est lié à l'arôme de fraise
; Le plus souvent les chewing-gums dits "à la fraise" sont colorés
avec des anthocyanes extraites de produits naturels,
Deux molécules essentiellement, qui
existent d'ailleurs dans la fraise :
La cyanidine-3-glucoside
La pélargonidine-3-glucoside
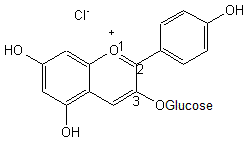
La couleur des anthocyanes varie en
fonction du pH ; les deux précédentes sont roses en milieu acide.
- D'autres
colorants sont utilisés pour suggérer d'autres types d'arômes :
Citons parmi ceux extraits de produits naturels :
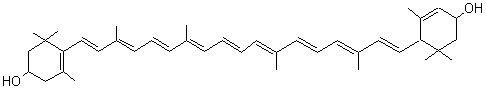
La lutéine ou xanthophylle (E161b) de
couleur jaune à rouge orangé suivant la concentration :
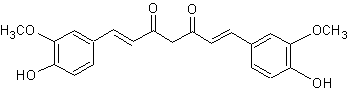
La
curcumine (E100) de couleur jaune orangé :
Parmi ceux de synthèse, essentiellement
des colorants azoïques :
Le
ponceau 4R (E124), rouge
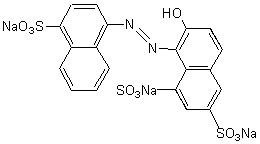
Le
rouge allura AC (E129)
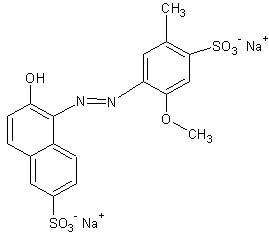
La
tartrazine (E102) de couleur jaune
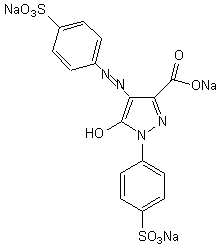
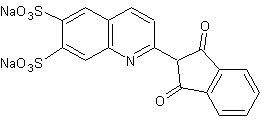
et d'autres ne faisant pas partie de cette
catégorie :
Le
jaune de quinoléine (E104)
c)
Des humectants :
Un humectant est une substance, en général
hygroscopique, chargée de maintenir un taux d'humidité convenable dans un
aliment et évite ainsi sa dessication.
Dans les chewing-gums, c'est souvent le
glycérol (ou glycérine) ; son code comme additif alimentaire est E422 :
![]()
d)
Des anti-oxygène :
Ils permettent de protéger les
constituants du chewing-gum d'une oxydation par le dioxygène de l'air afin de
conserver le plus longtemps les propriétés qu'il avait au moment de sa
fabrication.
On trouve notamment :
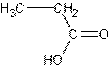
- L'acide citrique (E330) :
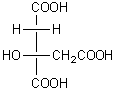
- Le BHA : c'est un mélange de deux isomères, le
2-tertiobutyl-4-hydroxyanisole et le
3-tertiobutyl-4-hydroxyanisole. Additif alimentaire E320, antioxydant
séquestrant les radicaux, interdit dans de nombreux pays car fortement
soupçonné d’être cancérigène :
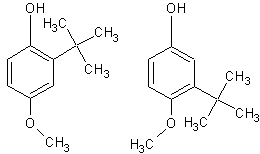
- Le BHT
: Hydroxytoluène butylé E321
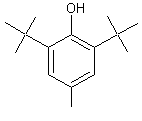
e)
Des agents d'enrobage : Les chewing-gums sont présentés en général sous
trois formes, des rubans, des chewing-gums à "bulles" (bubble-gum) ou
des dragées. Sous cette dernière forme, ils nécessitent un traitement de
surface qui leur donne un aspect lisse. C'est le rôle des agents d'enrobage qui
sont souvent des cires comme par exemple la cire de carnauba dont il a déjà été
question.
|
Molécule d'isoprène
(2-méthylbuta-1,3-diène)
|
Motif de l'enchaînement Z (1,4) de l'isoprène dans le
caoutchouc naturel :
|
|
α-pinène
|
β-myrcène
|
|
Isobutène
|
Isoprène
|
Butadiène
|
|
Formation du poly(acétate de vinyle)
|
|
Alcool myristilique
|
|
Alcool cétylique
|
|
Alcool myricique
|
|
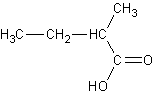
Acide 2-méthylbutanoïque
|
Cinnamate de méthyle
|
Hexan-1-ol
Vanilline
|
|
Acide éthanoïque
|
2-méthylbutanoate d'éthyle
|
(cis) hex-3-èn-1-ol
|
|
Acide caproïque CH3-(CH2)4
–COOH |
Thiobutanoate de méthyle
|
Linalol
|
|
Acide propanoïque
|
Sulfure de diméthyle
|
Maltol
|
|
Ethanoate d'éthyle
|
g-décalactone
|
Citral
|
|
Butanoate d'éthyle
|
Hexanal
|
2,3-butanedione
|
|
Caproate d'éthyle
|
(trans) hex-2-ènal
|
Furanéol
|
Lécithines : R1 et R2 sont des chaînes d'acides
gras.
La gomme arabique, est un exsudat solidifié de la sève de
l’Acacia senegal une variété de mimosa que l'on trouve au Soudan, au
Tchad, au Niger, au Sénégal, au Mali et en Mauritanie.
La gomme arabique, poudre jaune clair ou légèrement
ambrée, sans odeur, soluble dans l’eau et très peu soluble dans l’éthanol est
utilisée comme émulsifiant et comme support d’arômes dans l’industrie
agro-alimentaire sous le code E414 ; c’est un polysaccharide ; les
principaux éléments le constituant sont l’acide arabique, le D-galactose, le L-arabinose, le L-Rhamnose et l’acide D-glucuronique. Sa masse molaire
est comprise entre 3.105 et
106 g.mol-1.
Acide arabique
:
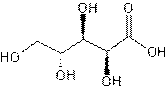
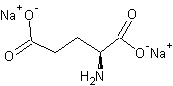
|
Glutamate de sodium
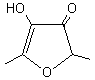
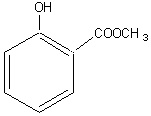
|
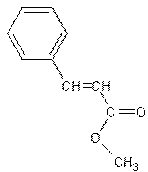
Salicylate de méthyle
|
Limonène
|