DES
MOLECULES ORGANIQUES SOUFREES
Document réalisé à partir du texte de l’exercice de chimie du
concours général STL 2005
Découvert
en 1951, le gisement de LACQ contient un gaz naturel riche en hydrocarbures
gazeux dont le principal est le méthane, une quantité non négligeable de
sulfure de dihydrogène H2S et du dioxyde de carbone. Sa mise en
exploitation intervient en 1956 et les premières usines de fabrication des
composés soufrés démarrent en 1958. Parallèlement, un effort important de
recherche, de développement et de mise au point de synthèses et de procédés est
engagé. Pendant plus de 25 ans, ELF Aquitaine reste leader mondial de la thiochimie (thio provient du grec
theion, soufre natif).
De
l’acide sulfurique, très utilisé dans l’industrie des engrais, jusqu’aux
molécules organiques les plus complexes de l’industrie pharmaceutique comme les
céphalosporines, antibiotiques
apparentés aux pénicillines ou encore la coenzyme A intervenant dans de nombreuses synthèses biochimiques, en passant par des
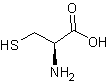
des aminoacides comme la méthionine, la cystine,
la cystéine, le glutathion, les composés
soufrés sont essentiels pour la vie et sont
omniprésents dans notre environnement quotidien : organismes vivants,
aliments, cosmétiques, médicaments arômes, polymères, résines, lubrifiants, détergents, produits phytosanitaires….
1) Du sulfure de dihydrogène aux mercaptans :
Les mercaptans, appelés aussi thiols, sont les analogues
soufrés des alcools. La plupart ont des odeurs très nauséabondes (chou, légumes
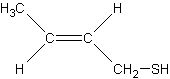
en décomposition…Par exemple, pour se
défendre le sconse projette des composés volatils comme le
3-méthylbutan-1-thiol et le E-but-2-èn-1-thiol ; voir
annexe 1), néanmoins ils jouent un rôle important dans les organismes
et sans exagération, on peut dire qu’aucun organisme vivant ne pourrait vivre
sans thiols. Deux exemples de thiols :
¾
Le méthylmercaptan ou
méthanethiol (CH3SH)
est principalement utilisé comme
intermédiaire de synthèse de la méthionine (acide aminé utilisé dans
l'alimentation animale). Il est obtenu
industriellement par réaction entre le sulfure de dihydrogène et le
méthanol :
![]()
¾
L’éthylmercaptan (C2H5SH)
ou éthanethiol est un
intermédiaire de synthèse d'insecticides et d'herbicides et peut être utilisé
comme odorisant de gaz naturel.
D’une façon générale, la liaison S-H est moins
polarisée que la liaison O-H ; en effet, l’atome de soufre est plus
gros que l’atome d’oxygène et l’électronégativité du soufre (2,58 dans
l’échelle de Pauling) est plus faible que celle de l’oxygène (3,44 dans cette
même échelle) ; cela a pour conséquence que les molécules de thiols donnent des liaisons
hydrogène beaucoup moins fortes que les molécules correspondantes
d’alcool ; c’est ce qu’on constate dans le tableau ci-dessous donnant les
points d’ébullition de deux thiols et des alcools correspondants :
|
Composés |
méthanethiol |
éthanethiol |
||
|
Températures d’ ébullition (en
°C) |
6,2 |
37 |
65 |
78,5 |
On remarque que la différence des températures d’ébullition
entre thiols et alcools s’estompe quand la longueur de la chaîne carbonée
augmente.
Nous avons vu comment on obtenait industriellement le
méthanethiol ; une autre voie de synthèse des thiols aliphatiques est
l’action de l’hydrogénosulfure de sodium en excès sur des dérivés halogénés
(bromés par exemple).
Ainsi pour
obtenir le butane-1-thiol, on peut faire réagir l’hydrogénosulfure
de sodium sur le 1-bromobutane :
![]()
2)
Du méthylmercaptan à la méthionine :
La méthionine est un acide
α-aminé essentiel, non synthétisé par l'homme et les animaux ; il
faut donc qu’il puisse être puisé dans la nourriture. Cet acide α-aminé
étant présent en faible quantité dans les céréales, il faut apporter un
complément alimentaire à de nombreux animaux. Le principal débouché de la
méthionine (environ 90 % de la production) est l’alimentation animale
notamment celle de la volaille (2 à 3 g/kg d'aliment, soit au total 4 à
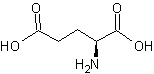
La formule topologique de la
méthionine est :
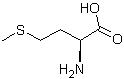
Selon le procédé Rhône Poulenc, la
synthèse de la méthionine (acide 2-amino-4-(méthylthio) butanoïque) s'effectue
en 3 étapes :
-
Etape 1 : Synthèse du
3-méthylthiopropanal (aussi nommé aldéhyde méthylthiopropionique ou AMTP) par
réaction entre le méthylmercaptan (ou méthanethiol) et l’acroléïne (ou
prop-2-ènal).
L’équation de cette réaction est :
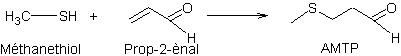
Cette réaction d’addition est régiosélective,
le groupement méthylthio se mettant à l’extrémité de la chaîne ; cela est
conforme à la polarisation du méthanethiol (CH3S--H+)
et à la polarisation du prop-2-ènal 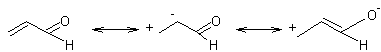
-
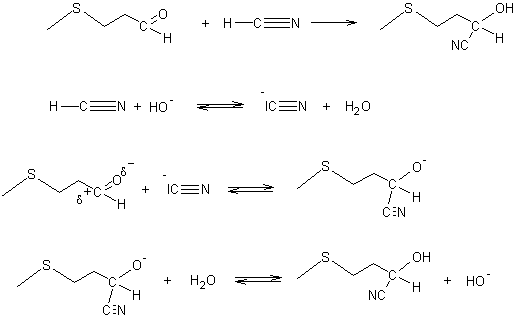
Etape 2 : Synthèse de
l’hydantoïne par action, sur l’AMTP, du cyanure de sodium en présence d'ammoniac et de dioxyde de carbone ; au cours
de cette réaction, il y a passage par une cyanhydrine, intermédiaire résultant
de l’addition de cyanure d’hydrogène HCN sur la fonction aldéhyde :
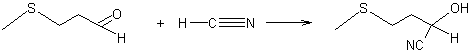
Le mécanisme de cette réaction est rappelé à l’annexe 2
La cyanhydrine se transforme ensuite en
(méthylthio)éthylhydantoïne :
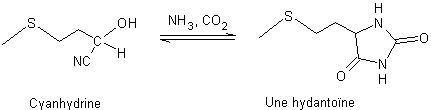
-
Etape 3 : Hydrolyse de
la (méthylthio)éthylhydantoïne en solution par de l’hydroxyde de sodium pour
obtenir un mélange racémique de D et L méthioninate de sodium, puis formation
du mélange racémique de méthionine par neutralisation du méthioninate de sodium
à l'aide d'acide sulfurique
:
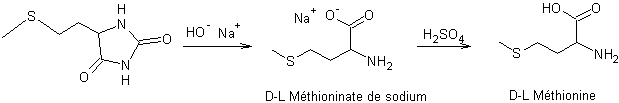
3) De la méthionine aux protéines
Le soufre, constituant
important de la matière vivante, est notamment présent dans de nombreux
polypeptides biologiques comme le glutathion et dans des protéines comme
l’insuline, par exemple.
Un peptide est un ensemble
constitué de plusieurs acides α-aminés enchaînés par réaction de la
fonction acide de l’un avec la fonction amine d’un autre pour donner un amide
dont la liaison est dite peptidique. Les oligopeptides correspondent à un
enchaînement de quelques unités (dipeptides, tripeptides….); quand le
nombre d’unités augmente on parle de polypeptide, et quand ce nombre est très grand,
de protéine. Les acides aminés (pris individuellement) qui composent le peptide
sont appelés « restes » ou « résidus ».
Une nomenclature simplifiée
des peptides consiste à écrire la suite des radicaux correspondant aux acides
aminés (met pour méthionine, cys pour cystéine, gly pour glycine, glu
pour acide glutamique…voir annexe 3) en mettant à gauche
l’acide aminé ayant mis en jeu sa fonction acide dans la formation de la
liaison peptidique.
Par exemple à partir de la
méthionine et de la cystéine on peut obtenir deux dipeptides :
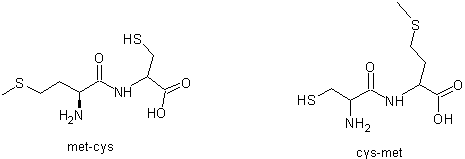
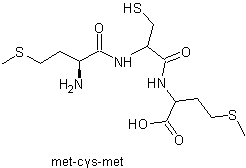
Le tripeptide met-cys-met a
comme formule topologique :
Le glutathion est le
tripeptide g-glu-cys-gly (le
sigle g-devant glu indique
que c’est, dans le cas de l’acide glutamique, l’acide à l’extrémité de la
chaîne qui est engagé dans la liaison peptidique) ; il est présent dans les cellules
vivantes et joue le rôle d’agent de réduction des processus biochimiques en se
laissant facilement oxyder, par voie enzymatique, au niveau du groupe mercapto
(-SH) en un dimère avec pont disulfure (-S-S-).
Ainsi sa forme réduite
s’écrit :
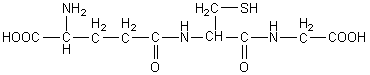
Et sa forme oxydée :
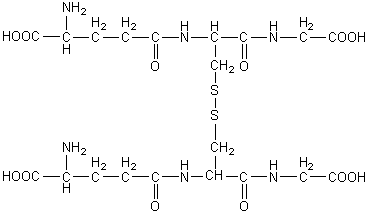
Remarque :
Les acides aminés chiraux
qui composent un polypeptide sont de configuration S.
La méthionine obtenue par le
procédé Rhône poulenc est le racémique c'est-à-dire un mélange équimoléculaire
des deux inverses optiques R et S.
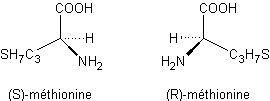
En représentation de Fischer cela devient :
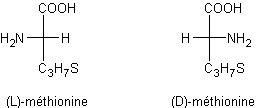
4) Des molécules soufrées au quotidien
4-1) Dans nos assiettes
Les dérivés
thioorganiques ont, en général, une activité biologique marquée. L’odeur de l’ail et les propriétés lacrymogènes de
l’oignon sont dues à plusieurs
composés soufrés, également responsables des vertus thérapeutiques (fluidité du
sang et diminution du taux du cholestérol sanguin) attribuées à ces deux
légumes.
Les composés soufrés extraits de l’ail diffèrent selon les méthodes d’extraction. La
méthode la plus radicale est l’entraînement à la vapeur d’eau : la vapeur
entraîne différents composés que l’on sépare ensuite, parmi lesquels le disulfure de diallyle :
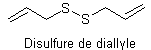
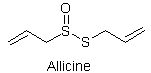
L’extraction par solvant est une méthode plus
douce : avec de l’éthanol à température ambiante, on obtient un autre
composé soufré, l’allicine, responsable de l’odeur de l’ail ; l’allicine
ne diffère du précédent composé que par la présence d’un atome d’oxygène sur
l’un des deux atomes de soufre, formant un groupe S=O :
Les composés soufrés extraits de l’oignon diffèrent aussi
selon les méthodes d’extraction. Par entraînement à la vapeur d’eau, on
obtient du propanal et du dithia-4,5-octane ou disulfure de
dipropyle :
![]()
Par extraction au fréon à
![]()
L’acide sulfurique et le propanal dont les propriétés
irritantes sont connues sont solubles dans l’eau. On comprend alors pourquoi
les oignons sont moins lacrymogènes quand on les épluche sous l’eau froide.
4-2) Dans la
cuisine
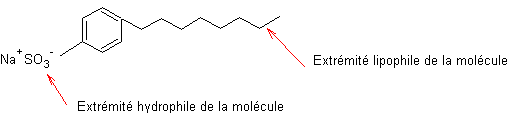
Les détergents comportent
une partie polaire hydrophile et un enchaînement peu polaire lipophile.
Certains d’entre eux comportent des groupes sulfonates ; c’est le cas, par
exemple, du p.octylbenzènesulfonate de sodium dont la synthèse qui peut se
faire en huit étapes est donnée à l’annexe 4.
D’une
façon générale, les détergents font partie d’une famille, les tensioactifs, substances solubles dans l'eau et
ayant la propriété de se concentrer, de s'agréger aux interfaces entre l'eau et
d'autres substances peu solubles dans l'eau, les corps gras notamment.
Ces molécules
présentent au moins deux parties d'affinité différente, l'une est hydrophile
(affinité pour l'eau) et l'autre lipophile (affinité pour les graisses) ; de
telles substances sont dites amphiphiles (du grec amphi, “des deux
cotés” et philos, “ami”).
La partie
hydrophile
est une extrémité généralement ionique de la molécule ; elle peut être :
- anionique : c'est le cas des ions carboxylates -COO- mais aussi
des ions sulfonates -SO3-.
- cationique : c'est le cas des amines protonées
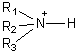 , ou des ammoniums
quaternaires
, ou des ammoniums
quaternaires 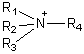 .
.
- zwittérionique : bétaïnes, phospholipides (lécithines par exemple)
: en milieu basique, ces molécules se comportent comme des anions et en milieu
acide comme des cations.
Parfois la
partie hydrophile n'est pas ionique mais elle possède alors des groupes
polaires susceptibles de donner avec l'eau des liaisons hydrogène (des
fonctions alcool par exemple).
La partie
lipophile
est généralement constituée d'une chaîne carbonée assez longue et qui doit être
linéaire (non ramifiée) pour être biodégradable.
Leur mode d'action :
Aux
interfaces eau-matière grasse, les tensioactifs se concentrent, leur partie
lipophile s'immergeant dans le corps gras et leur partie hydrophile dans l'eau.
Ces agrégats de molécules de tensioactifs ainsi formés s'appellent des
micelles.
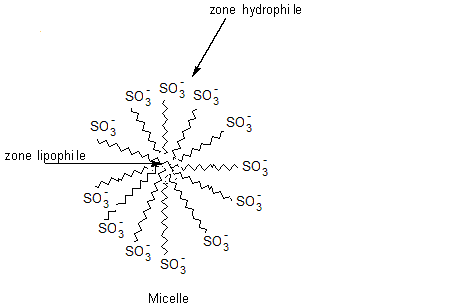
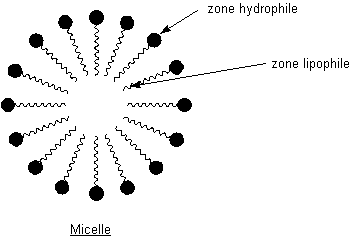
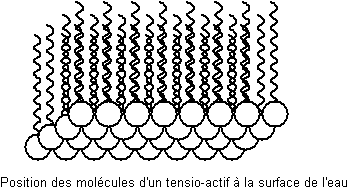
Leur
utilisation en tant que détergent peut par exemple s'expliquer ainsi :
Par
frottement (lavage manuel ou en machine d'un tissu) les globules de graisse
entourés de tensioactif se fractionnent donnant des globules plus petits qui
s'entourent aussitôt de tensioactif et ceci plusieurs fois, jusqu'à se détacher
de l'étoffe et se répartir dans l'eau de lavage sous forme d'une émulsion qui
est éliminée lors de la vidange. Ce processus est facilité par le fait que le
tensioactif se positionne aussi à l'interface eau-air, sa partie hydrophile
dans l'eau, et diminue ainsi la tension superficielle de l'eau (formation de la
mousse des savons) favorisant le mouillage du tissu.
4-3)
Dans la salle de bain
L’acide
thioglycolique et ses dérivés sont à la base de nombreuses préparations
cosmétologiques ; avec le glycérol, il conduit au dimercaptoacétate de glycérol,
composé présent dans certaines permanentes à froid.
L’acide thioglycolique est
synthétisé à partir de sulfure de
dihydrogène et d’acide monochloracétique suivant l’équation :
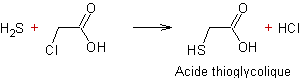
La synthèse du
dimercaptoacétate de glycérol s’écrivant, elle :
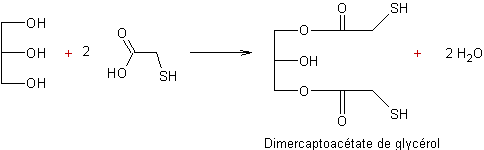
Remarque : le terme mercapto désigne le
groupement –SH
4-4) Dans la
trousse à pharmacie
De nombreux médicaments contiennent du soufre dans leur squelette
moléculaire. Les sulfonamides ou sulfamides sont les plus connus (voir l’annexe 5)
; découverts en 1935, ils permirent le traitement d’infections bactériennes
graves (méningites à méningocoques et nombreuses septicémies).
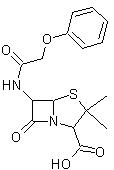
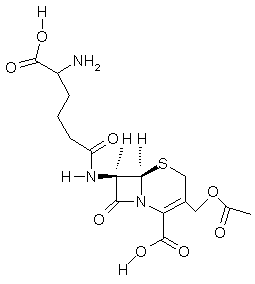
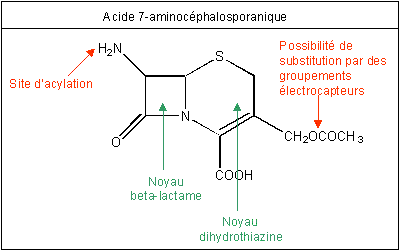
Les céphalosporines,
antibiotiques très puissants, pouvant remplacer la penicilline (voir annexe 6), ont été synthétisées récemment ; elles
ont pour « noyau » commun l'acide 7-aminocéphalosporanique,
représenté ci-dessous. Un élément important est la possibilité de substitution
en C3 (carbone auquel est fixé le groupe -CH2OCOCH3)
par des groupements électrocapteurs (ou électroattracteurs). Ceux-ci
permettront une meilleure délocalisation des électrons au niveau du cycle
β-lactame, rendant en principe les céphalosporines plus actives vis-à-vis
des transpeptidases en comparaison avec les pénicillines.
Citons par exemple la céphalosporine C :
L’activité des céphalosporines et des pénicillines s’explique
par la présence d’un cycle β-lactame qui est tendu (quatre carbones) et ne
demande qu’à s’ouvrir ; il se révèle beaucoup plus réactif qu’un simple
amide.
Les céphalosporines contrairement aux pénicillines résistent
aux pénicillinases, enzymes secrétés
par des bactéries, qui permettent l’hydrolyse du β-lactame avant que la
molécule n’ait eu le temps de « s’accrocher » au transpeptidase et qu’elle n’ait eu donc le temps de le neutraliser.
Rappelons que le transpeptidase est
nécessaire à la biosynthèse de la membrane cellulaire des bactéries.
|
3-méthylbutan-1-thiol |
|
|
E-but-2-èn-1-thiol |
|
|
Méthionine (met) |
|
|
Cystéine (cys) |
|
|
Glycine (gly) |
|
|
Acide glutamique (glu) |
|
Les
huit étapes de la synthèse du p.octylbenzènesulfonate
de sodium :
Etape 1 :
une addition radicalaire sur un alcène (anti-Markovnikov)
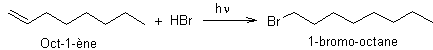
Etape 2 :
une substitution nucléophile
![]()
Etape 3 :
Une oxydation d’un alcool primaire en acide carboxylique
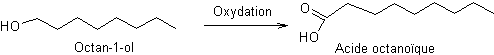
Etape 4 :
Passage de l’acide au chlorure d’acyle
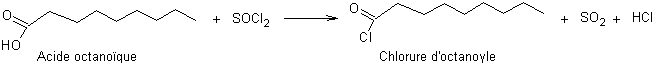
Etape 5 : Acylation de Friedel et Crafts
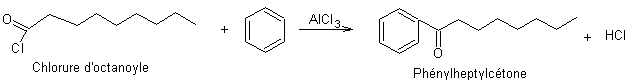
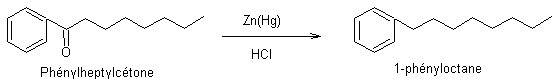
Etape 6 : Réduction de la cétone par la
méthode de Clemmensen
Etape 7 : Sulfonation du noyau
benzénique (substitution électrophile)
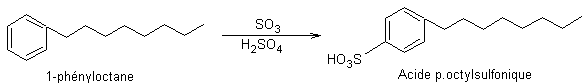
Du fait de l’encombrement stérique des
groupements –SO3H et octyle, la substitution électrophile a lieu
préférentiellement en para.
Etape 8 : Formation du sel de sodium de
l’acide sulfonique
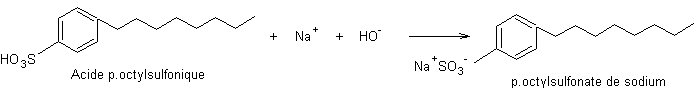
Le sulfanilamide ou 4-aminobenzènesulfonamide a
été l’un des premiers sulfamides antibactérien.
C6H8N2SO2
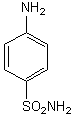
Citons aussi la sulfadiazine, un puissant agent
bactériostatique :
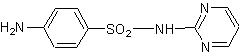
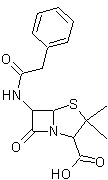
Les pénicillines :
- Pénicilline G :
Antibiotique
en général administré en piqûre intraveineuse ou intramusculaire. Utilisé dans
des cas sévères où la
voie orale n’est pas indiquée.
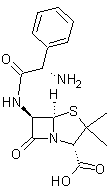
- Pénicilline A :
ou Ampicilline ; c’est une
aminopénicilline à spectre large ; elle couvre tout le spectre des
pénicillines conventionnelles (comme l’amoxicilline) plus beaucoup d’autres
souches comme les entérocoques. Peut être administrée par voie orale ou
intraveineuse.
- Pénicilline V :
Cette
molécule est l’équivalent de la pénicilline G mais par voie orale.