LES TENSIOACTIFS
Plan de l'étude :
3) Les principales familles de tensioactifs et
quelques exemples
4) Tensioactifs obtenus à partir de matières
renouvelables
5)
Biodégradabilité des tensioactifs
1) Définition -
Constitution :
Les tensioactifs (que l'on appelle aussi
agents de surface, le terme anglais étant surfactants) sont des substances
solubles dans l'eau et ayant la propriété de se concentrer, de s'agréger aux
interfaces entre l'eau et d'autres substances peu solubles dans l'eau, les
corps gras notamment.
Ces molécules présentent
au moins deux parties d'affinité différente, l'une est hydrophile (affinité
pour l'eau) et l'autre lipophile (affinité pour les graisses) ; de telles
substances sont dites amphiphiles (du grec amphi, “des deux cotés” et philos,
“ami”).
La partie hydrophile est une extrémité généralement ionique de la
molécule ; elle peut être :
-
anionique :
![]()
c'est le cas des ions
carboxylates -COO- mais aussi des ions sulfonates R( ou Ar)-SO3-.
-
cationique :
![]()
c'est le cas des amines
protonées,
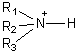
ou des ammoniums
quaternaires
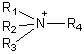 .
.
-
zwittérionique :
![]()
bétaïnes, phospholipides (lécithines par
exemple) : en milieu basique, ces molécules se comportent comme des anions et
en milieu acide comme des cations.
Parfois la partie
hydrophile n'est pas ionique
![]()
mais elle possède alors
des groupes polaires susceptibles de donner avec l'eau des liaisons hydrogène
(des fonctions alcool ou éther-oxyde par exemple) : R-O-(CH2CH2O)n-H.
La partie lipophile est généralement constituée d'une chaîne
carbonée assez longue et qui doit être linéaire (non ramifiée) pour être
biodégradable.
2) Mode d'action :
Aux
interfaces eau-matière grasse, les tensioactifs se concentrent, leur partie
lipophile s'immergeant dans le corps gras et leur partie hydrophile dans l'eau.
Ces agrégats de molécules de tensioactifs ainsi formés s'appellent des
micelles.

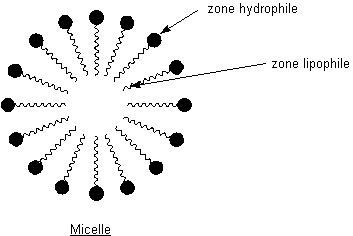
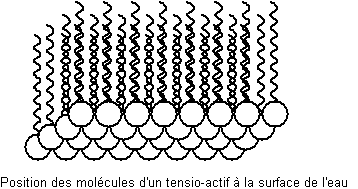
Leur utilisation
en tant que détergent peut s'expliquer ainsi :
Par
frottement (lavage manuel ou en machine d'un tissu) les globules de graisse
entourés de tensioactif se fractionnent donnant des globules plus petits qui
s'entourent aussitôt de tensioactif et ceci plusieurs fois, jusqu'à se détacher
de l'étoffe et se répartir dans l'eau de lavage sous forme d'une émulsion qui
est éliminée lors de la vidange. Ce processus est facilité par le fait que le
tensioactif se positionne aussi à l'interface eau-air, sa partie hydrophile
dans l'eau, et diminue ainsi la tension superficielle de l'eau (formation de la
mousse des savons) favorisant le mouillage du tissu.
Suivant
leur nature et leur concentration les tensioactifs peuvent avoir plusieurs
rôles :
- celui de détergent : ils enlèvent les taches, notamment de graisse.
- celui de mouillant : l'eau posée à la surface d'un solide a tendance à former
des gouttelettes. En diminuant la tension superficielle un agent mouillant permet
un étalement de cette eau augmentant ainsi sa surface de contact avec le
solide.
- d'émulsifiant : un émulsifiant disperse sous forme de gouttelettes très fines
un liquide au sein d'un autre liquide dans lequel il n'est pas soluble.
On
attribue à chaque tensioactif un nombre compris entre 1 et 20, l'ensemble
constituant l'échelle de Griffin. Ce nombre est appelé indice HLB (Hydrophilic/Lipophilic
Balance) l'indice 1 est donné à l'acide oléique et l'indice 20 à
l'oléate de potassium.
Cette
échelle permet d'apprécier le caractère plutôt lipophile ou au contraire plutôt
hydrophile d'un amphiphile et de savoir pour quelle application il est le mieux
adapté. Un indice HLB inférieur à 9 fera dire de l'amphiphile qu'il est lipophile
(on l'utilisera alors comme agent antimousse (si HLB<3), comme émulsifiant
de l'eau dans l'huile (si 3<HLB<6) et comme agent mouillant au delà) et
un indice supérieur à 11 qu'il est hydrophile (on l'utilisera
comme émulsifiant de l'huile dans l'eau (si 9<HLB<13), comme détergent
(si 13<HLB<15) et comme solubilisant au delà).
On place parfois des
groupes organosiliconés sur des molécules de tensioactifs pour augmenter leur
caractère hydrophobe. On s'en sert alors comme antiflatulents.
Une substitution des
hydrogènes de la chaîne hydrocarbonée par des atomes de fluor renforce
également le caractère hydrophobe de la molécule.
3) Les principales familles de tensioactifs et quelques
exemples :
3-1) Les
savons :
Historiquement la première
application des tensioactifs a été le lavage, après la découverte du savon ;
depuis l'antiquité on savait le fabriquer à partir des graisses animales ou
végétales que l'on chauffait avec de la cendre (Le plus ancien mode opératoire
de fabrication du savon a été trouvé dans les ruines de Sumer, sur une tablette
d'argile, datée de 2500 avant Jésus-Christ). On procédait ainsi empiriquement à
la saponification des triesters du glycérol
par les bases contenues dans la cendre et on obtenait d'une façon rudimentaire
des savons qui sont des sels de sodium ou de potassium des acides gras
constituant les graisses.
Un
savon est un tensioactif anionique dont la partie hydrophile est l'ion
carboxylate -COO- et la partie lipophile la longue chaîne carbonée
linéaire de l'acide gras.
Un
exemple :
l'octadécanoate
de sodium encore appelé stéarate de
sodium :
CH3-(CH2)16-COO- Na+
3-2) Les détergents :
L'avènement
de la pétrochimie au milieu du XXème siècle voit le développement des
tensioactifs de synthèse, les arylsulfonates
avec chaîne latérale (alkylbenzène sulfonates) ; le premier détergent
complètement synthétique, le "Nekal a" dérivé du
naphtalène, du propan-2-ol et de l'acide sulfurique fut fabriqué en Allemagne
en 1916.
Ce sont
aussi des tensioactifs anioniques dont la partie hydrophile est l'ion -SO3-.
Les premiers fabriqués avaient des chaînes latérales ramifiées et n'étaient pas
biodégradables.
Les
détergents liquides ou en poudre issus de la pétrochimie représentent encore
aujourd'hui la majeure partie des tensioactifs utilisés comme produits de
nettoyage ou de lavage.
Un
exemple :
les
dodécylbenzène sulfonates de sodium :
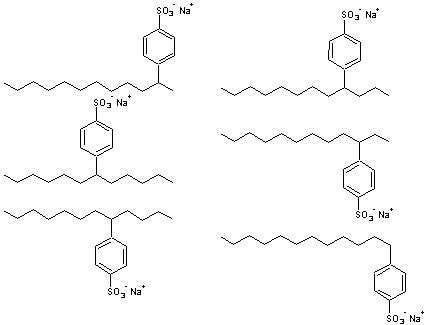
Remarques :
·
Le premier isomère représenté appartient
à la famille des dodécylbenzène sulfonates de sodium mais son nom systématique
est le para-(1-méthylundécyl)benzènesulfonate de sodium
·
Le dernier isomère représenté (celui
où le groupement alkyle se fixe sur le noyau benzénique par son extrémité) est
très minoritaire lorsque l'on synthétise les dodécylbenzènes par réaction de
Friedel et Crafts ou par action du dodéc-1-ène sur le benzène ; son nom
systématique est bien le dodécylbenzène sulfonate de sodium.
·
3-3) Autres utilisations :
Les tensioactifs
sont également utilisés à d'autres fins que le nettoyage ou le lavage ; on met
par exemple à profit leurs propriétés émulsifiantes ou mouillantes en
cosmétologie mais aussi dans des industries variées : forage et raffinage du
pétrole, traitement des bitumes, industries métallurgiques, agriculture...
Les
plus utilisés des tensioactifs ont une partie hydrophile non ionique ou
anionique.
Voici
deux exemples de tensioactifs très utilisés dans l'industrie :
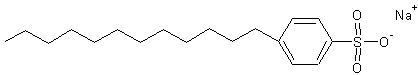
- le SDS ou SLS : Le dodécylsulfate de sodium (désigné par l'abréviation
SDS dérivée de son nom anglais) encore appelé Laurylsulfate de sodium (ou SLS)
est un tensio-actif anionique très utilisé comme agent moussant dans les shampooings,
mousses à raser, dentifrices, bains moussants...
Sa
molécule dérive du dodécanol (ou alcool dodécylique : CH3(CH2)11OH)
par sulfonation puis action du carbonate de sodium :
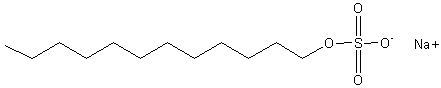
Il est aussi
utilisé pour la séparation des protéines et des lipides par électrophorèse.
- Le SLES : qu'il ne
faut pas confondre avec la molécule précédente, est le Lauryl éther sulfate de
sodium ou laureth sulfate de sodium. C'est aussi un agent moussant efficace et
très utilisé en cosmétologie. Sa molécule à comme formule :
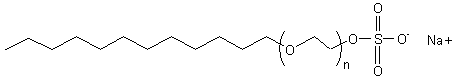
avec n
fréquemment égal à 3.
3-4) Un exemple de tensioactif cationique :
le chlorure
de triméthyldécylammonium :
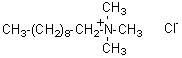
Il est utilisé dans
les après-shampooings, les antipelliculaires, certaines teintures et des
déodorants.
3-5) Un exemple de tensioactif non
ionique et calcul d'un HLB :
La condensation de
l'alcool laurique CH3(CH2)11OH avec dix
molécules d'oxyde d'éthylène (ou oxirane), conduit à un tensioactif non ionique
de formule :
CH3-(CH2)11-O(-CH2-CH2-O)9-CH2-CH2-OH
La partie lipophile de
cette molécule est constituée par la chaîne hydrocarbonée CH3-(CH2)11-
(de masse molaire 169 g.mol-1) et la partie hydrophile par le reste de la
molécule (de masse molaire 457 g.mol-1). La masse molaire de
l'ensemble de la molécule de tensioactif étant 626 g.mol-1.
L'indice HLB
s'obtient par la formule :
HLB = 20x(masse
molaire de la partie hydrophile)/(masse molaire de l'ensemble de la molécule).
Soit numériquement :
HLB = 20x457/626 =
14,6.
Ce tensioactif a
surtout des propriétés détergentes.
3-6) Les tensioactifs dans l'organisme :
Dans le règne
animal ou végétal, les tensioactifs synthétisés par un organisme vivant ont un
rôle considérable ; Les acides biliaires (acide glycocholique et
acide taurocholique)
forment avec les ions des métaux alcalins, des sels solubles dans l'eau
fortement tensioactifs. Les acides biliaires sont éliminés dans le duodénum par
le cholédoque. Ils rencontrent les graisses non digérées et les émulsifient
(les fractionnent en très fines gouttelettes) facilitant ainsi leur
métabolisation. Les lécithines
favorisent la perméabilité des membranes, améliorant le passage des produits de
la digestion dans le sang au niveau des muqueuses intestinales.
Un autre
phospholipide (le dipalmitoylphosphatidylcholine ou DPPC) permet en jouant son rôle
de tensioactif la formation d'un film superficiel revêtant toute la surface
alvéolaire des poumons ; il facilite ainsi l'expansion des alvéoles à
l'inspiration et les maintient ouvertes pendant l'expiration. Cet agent de
surface joue aussi un rôle dans la perméabilité alvéolaire et dans le mécanisme
de défense contre les microorganismes.
Les tensioactifs
utilisés par l'organisme proviennent pour la plupart, du foie. Un adulte en
synthétise plus de 5 kg par an en moyenne.
4) Tensioactifs obtenus à partir de matières renouvelables :
Ce
sont pour la plupart des molécules obtenues en connectant une partie lipophile,
essentiellement des triglycérides d'origine végétale à une partie hydrophile
issue de sucres ou de polyols.
- La partie lipophile : Les acides gras les plus utilisés sont les
acides laurique, myristique, palmitique ou stéarique pour les saturés, les
acides oléique et linoléique pour les non
saturés. On les transforme en esters méthyliques en alcools ou en amines.
- La partie hydrophile : Elle est essentiellement issue de l'industrie
des sucres et notamment des sucres de faible masse moléculaire (saccharose, D-glucose), mais peut aussi provenir du
glycérol ou de peptides et d'acides aminés (glycine bétaïne) obtenus par
hydrolyse des protéines.
Les
sucres et les polyols constituent des groupes polaires non ioniques, tandis que
la glycine bétaïne est un groupe polaire zwittérionique.
4-1) Les alkylpolyglucosides (APG) :
Ce
sont des tensioactifs (agents moussants ou émulsifiants) dont la partie
lipophile est dérivée d'alcools gras (alcools à longue chaîne carbonée obtenus par
réduction d'esters méthyliques d'acides gras d'huile de palme) et la partie
hydrophile du glucose provenant de l'hydrolyse de l'amidon de maïs ou de blé.
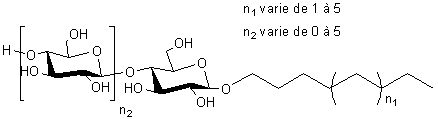
4-2) Les sucroesters :
Par
réaction d'esters méthyliques d'acides gras et de saccharose
(transestérification) on obtient des mélanges de mono, di ou polyesters du
saccharose, appelés sucroesters, qui ont des propriétés tensioactives dépendant
des fonctions alcool du saccharose qui ont été estérifiées.
Ils
servent en agroalimentaire (émulsifiants de produits lactés, mais aussi des
margarines, agents de texture ou bien pellicule protectrice pour la
conservation des fruits) et dans les industries des cosmétiques (propriétés
émulsifiantes mais aussi antimicrobiennes).
4-3)
Les esters du diglycérol et plus généralement les esters de
(poly)glycérol :
Les
(poly)glycérols sont des éthers obtenus par déshydratation du glycérol.
En l'état ou estérifiés ils ont de bonnes propriétés en tant qu'émulsifiants ou
même en tant que lubrifiants. On peut en effet suivant leur structure obtenir
une très large gamme d'indices HLB (de 1 à 15 environ). Ils tendent à remplacer
les alkylphénols éthoxylés dans l'industrie agroalimentaire et des cosmétiques.
4-4) Les phospholipides
(essentiellement les lécithines)
Directement utilisables
après leur extraction du soja, du colza ou des oeufs, ces tensioactifs sont
complètement biocompatibles.
On
parlera pour mémoire des propriétés tensioactives des saponines telles que l'hédérine ou l'escine.
5) Biodégradabilité
des tensioactifs :
1) Définition : La
dégradation d'une substance dite biodégradable doit avoir lieu naturellement à
l'aide de microorganismes présents dans l'eau ou dans le sol et conduire au
terme d'un processus enzymatique à plusieurs étapes, à du dioxyde de carbone,
de l'eau ou des sels, c'est ce qu'on appelle la biodégradabilité ultime en aérobiose. Un taux de biodégradabilité
de 90% veut dire qu'à terme, 90% de la quantité de substance initiale doit
s'être transformée ; la réglementation impose souvent une biodégradabilité
supérieure à 60% en 28 jours.
En dehors de cette
biodégradabilité ultime il existe une biodégradabilité
primaire qui est la propriété que doit posséder un corps de se dégrader
sous l'effet de microorganismes et de se transformer en un produit ayant perdu
ses propriétés initiales (pour un tensioactif par exemple, il ne doit plus
mousser ni abaisser la tension superficielle).La réglementation impose pour les
tensioactifs une biodégradabilité primaire supérieure à 80% en 21 jours.
2) Processus de biodégradation
:
Considérons un détergent anionique ; nous avons dit plus
haut qu'un arylsulfonate doit avoir une chaîne
latérale non ramifiée pour être facilement biodégradable.
Envisageons les étapes de dégradation du dodécylsulfonate de
sodium avec groupement alkyle fixé sur le noyau benzénique par son extrémité:
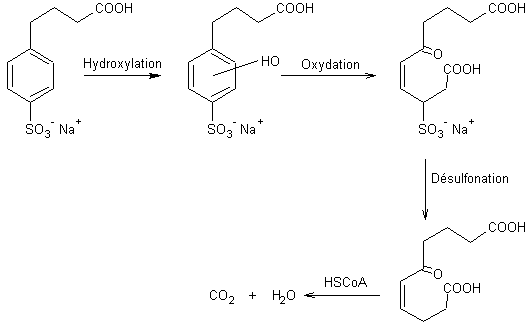
La première étape est une ω-oxydation enzymatique,
suivie d'une β-oxydation à quatre étapes chacune d'elles intervenant sous
l'action d'un enzyme différent. On raccourcit ainsi la chaîne de deux carbones.

Le processus (β-oxydation) recommence jusqu'à ce qu'on
obtienne l'acide butanoïque-4- benzène sulfonate de sodium ; Celui-ci est alors
hydroxylé, subit une coupure oxydante du cycle, est désulfoné, puis minéralisé
sous l'action du coenzyme A.