CHAMPIGNONS
Couleurs – Toxicité – Quelques molécules précieuses.
Gérard
GOMEZ
avec
la collaboration de
Jacques
BARON
Plan de l'étude :
1) Généralités
2-1)
Les bétalaïnes
2-1-1)
Les bétacyanines
2-1-2)
Les bétaxanthines
2-1-3)
Quelques pigments d'Amanites et d'Hygrocybes
2-1-4)
Biosynthèse des pigments bétalaïne par coupure oxydante
de la dopa
2-2)
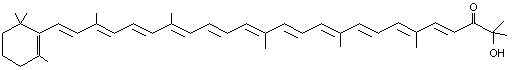
Les caroténoïdes
2-3)
Quinones
2-3-1) Des terphénylquinones
2-3-2)
Des boviquinones
2-3-3)
Des anthraquinones
2-3-4) Un pigment non quinonique mais
dérivé de polycétide
2-4)
Des dérivés de l'acide pulvinique
2-5)
Un dérivé de cyclopentène dione
2-7)
Dérivés de la phénoxazone
2-9)
Dérivés de l'azulène
2-10)
Les allomélanines
3) Des molécules
toxiques des champignons
3-1)
La muscarine
3-2)
L'acide iboténique
3-3)
Le muscimole
3-4)
La muscazone
3-5)
La coprine
3-6)
Les acides stizolobique et stizolobinique
3-7)
La Psilocyne et la
Psilocybine
3-8)
L' Orellanine
3-9)
La Muscaridine
3-10)
La Gyromitrine
3-11)
L'acide vulpinique
3-12)
Les acides acroméliques
3-13)
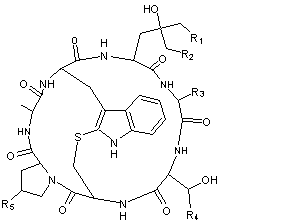
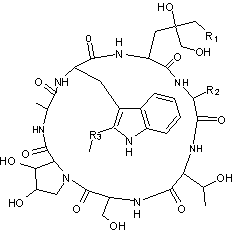
Les amatoxines, les phallotoxines et les virotoxines
3-14)
La patuline
3-15)
Les dérivés de l'acide lysergique
3-16)
Les aflatoxines
4) Quelques
molécules précieuses
4-1)
Les pénicillines
4-2)
La ciclosporine A
4-3)
Les Céphalosporines
Annexe 1 Les polycétides
Un
chapeau uniformément rouge ou rouge à pois blancs, ou encore rose, jaune, gris,
violacé, brun ou simplement blanc, les champignons par leur couleur égayent nos
sous-bois en automne.
Leur
cueillette est un passe-temps très prisé par certains, en solitaire ou en
famille, tradition très ancienne dont les archéologues ont trouvé des traces il
y a plusieurs milliers d'années.
La plus
grande prudence est recommandée dans cette activité qui peut se révéler très
dangereuse comme l'attestent les nombreux cas d'intoxication, plusieurs
centaines chaque année en France.
L'objet
de cette étude est de recenser quelques molécules organiques qui contribuent à
donner leur couleur aux champignons ainsi que quelques autres responsables de
leur toxicité ; pour terminer on mentionnera quelques molécules précieuses que
l'on trouve dans certains champignons microscopiques.
|
|
|
|
|
Marasmius
oreades
ou Faux mousseron Banque
nationale de photos en SVT (Jacques
Janin) |
Amanita
muscaria ou
Amanite tue-mouche. Banque
nationale de photos en SVT.(J.P. Esteban) |
Morchella
rotunda
ou Morille blonde Banque
nationale de photos en SVT (Vincent
Guili) |
2) La couleur des champignons :
Les
basidiomycètes davantage que les ascomycètes ont une diversité de couleurs
remarquable due sans doute au hasard de l'évolution, sans que l'on puisse la
relier à une quelconque fonction comme cela peut être le cas pour certains
animaux (papillons) ou végétaux supérieurs.
Elle
est rarement le fait d'une seule molécule ; elle résulte souvent de la
superposition de plusieurs couleurs.
Les
chlorophylles et les anthocyanes, pigments qui prédominent dans les végétaux ne
sont pas présents du tout dans les champignons.
Bétalaïnes,
caroténoïdes et autres terpénoïdes sont répandus dans quelques espèces de
champignons supérieurs ; mais la plupart des pigments présents sont des
quinones ou des structures conjuguées similaires.
2-1) Les
bétalaïnes :
Ce sont
des pigments végétaux que l'on trouve dans certains champignons, les amanites
et les hygrophores, mais aussi dans les betteraves (c'est d'ailleurs du nom
latin de celles-ci Beta vulgaris que dérive ce nom), les figues de
barbarie, les pourpiers, les pétales des
fleurs de certains arbustes comme le bougainvillier par exemple ….
Deux
catégories de bétalaïnes, les bétacyanines et les bétaxanthines.
A noter
que la couleur des bétalaïnes ne varie pratiquement pas en fonction du pH.
2-1-1) Les
bétacyanines
La
couleur de ces pigments : rouge foncé ou violet très soutenu.
La
plupart sont des hétérosides ; une
partie seulement de la molécule contribue à la couleur (chromophore) c'est la
partie aglycone ; l'autre partie est un ose attaché au chromophore.
Des exemples
de chromophore des bétacyanines :
|
|
|
|
|
|
La bétanidine |
L'isobétanidine |
La néobétanidine |
la muscapurpurine |
2-1-2) Les bétaxanthines
La couleur
de ces pigments : jaune à orangé.
Des
exemples :
-
L'indicaxanthine
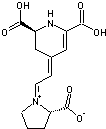
- Les
vulgaxanthines
|
|
|
|
Vulgaxanthine I |
Vulgaxanthine II |
- Les
miraxanthines
|
|
|
|
|
|
Miraxanthine I |
Miraxanthine II |
Miraxanthine III |
Miraxanthine V |
- La
portulaxanthine
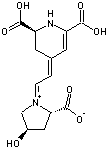
-
La musca-aurine
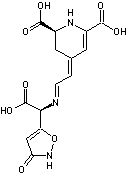
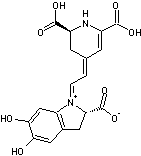
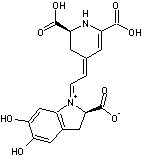
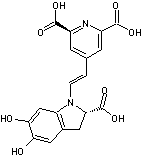
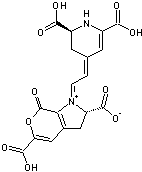
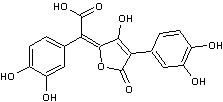
2-1-3) Quelques pigments d'Amanites et d'Hygrocybes
|
Amanita muscaria |
La
couleur vive du chapeau de l'Amanite tue-mouche (Amanita muscaria) par
exemple est due au mélange d'un pigment orangé (bétaxanthine musca-aurine),
d'un pigment jaune (muscaflavine) et d'un pigment violet (bétacyanine
muscapurpurine) : |
|
|
|
|
|
musca-aurine (orangé) |
Muscaflavine (jaune) |
Muscapurpurine (violet) |
La
muscaflavine est un isomère de l’acide bétalamique qui est à la base des
bétalaïnes.
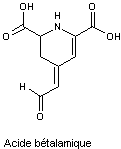
|
Hygrocybe vitellina |
La
plupart des Hygrocybes sont colorées par des bétalaïnes, mélanges de
bétacyanines et bétaxanthines, mais dans des proportions variables ce qui
explique leurs différences de couleurs qui vont du violet au rouge en passant
par les orangés et les jaunes. Ainsi
L'Hygrocybe vitellina jaune vif contient essentiellement des
bétaxanthines alors que l'Hygrocybe cochenille (Hygrocybe coccinea),
elle, essentiellement des bétacyanines. |
Hygrocybe coccinea |
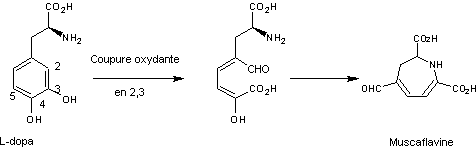
2-1-4) Biosynthèse des pigments bétalaïne par coupure oxydante de
la dopa
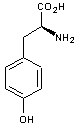
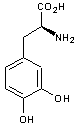
La dopa
ou lévodopa est la (S) 3,4-dihydroxyphénylalanine. Elle dérive dans l'organisme
de la phénylalanine via la L-tyrosine :
|
|
|
|
|
Phénylalanine |
L-Tyrosine |
L-Dopa |
Les
voies de biosynthèse de l'indicaxanthine et de la muscaflavine à partir de la
L-dopa par action de la dopadioxygénase sont les suivantes :
- Indicaxanthine
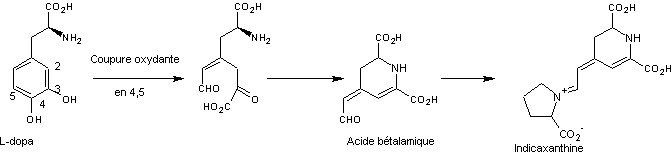
- Muscaflavine
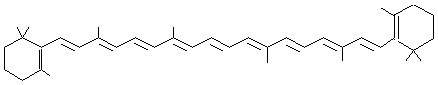
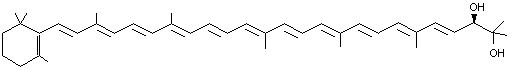
2-2)
Les caroténoïdes :
|
|
Plectania
coccinea
est un ascomycète qui se développe sur les bois morts. Sa fructification
forme une petite coupe colorée en rouge par des pigments caroténoïdes. L'analyse de ces pigments a révélé
la présence de β-carotène, de plectaniaxanthine et de
2'-déhydroplectaniaxanthine pour ne citer que les caroténoïdes majeurs. |
|
|
|
β-Carotène pigment jaune orangé |
|
|
|
Plectaniaxanthine pigment orangé |
|
|
|
2'-déhydroplectaniaxanthine pigment pourpre |
D'autres
ascomycètes sont colorés par des caroténoïdes comme par exemple la Pézize
orangée (Aleuria aurantia) ou la Léotie visqueuse (Leotia lubrica).
|
|
|
|
Pézize orangée (Aleuria aurantia) |
Léotie visqueuse (Leotia lubrica) Gilles Carcassès - Boisemont |
Des
basidiomycètes aussi doivent leur coloration à ces pigments ; c'est notamment
le cas des clavaires, des gastéromycètes (ancienne classification) et des chanterelles.
|
|
|
|
|
Une Clavaire (Champignons passion) |
Scléroderme vulgaire (Scleroderma
citrinum) un gastéromycète |
Chanterelle (Cantharellus cibarius) |
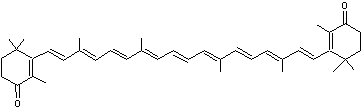
C'est
dans la Girolle (Cantharellus cibarius) qu'on a
découvert pour la première fois la canthaxanthine, un colorant orangé :
2-3) Des
quinones :
Ces
pigments sont orangés, rouges ou bruns.
2-3-1) Des terphénylquinones
C'est
le cas de l'acide polyporique ou de l'atromentine :
|
|
On
trouve de l'acide polyporique dans le cèpe de Bordeaux (Boletus edulis),
mais aussi dans Suillus piperatus, Xerocomus badius,
Paxillus et Chrysenteron |
|
Acide polyporique |
|
|
|
L'atromentine
a été découverte en 1878 par Thörner chez Paxillus atrotomentosus. Bien
que la teneur en atromentine de ce champignon soit importante (elle peut
atteindre 3,6% du poids sec) sa chair apparaît presque incolore ; on explique
cela par le fait que l'atromentine est
essentiellement sous forme de leuco-dérivé. On en
trouve aussi dans le Bolet à chair jaune (Xerocomus chrysenteron). |
|
Atromentine |
|
2-3-2) Des boviquinones :
- Boviquinone 4 (ou bovinone)
|
|
ou |
|
Cette
molécule est présente dans Suillus bovinus le bolet des bouviers.
- (E,E)-Boviquinone 3 (ou Helveticone)
|
|
ou |
|
molécule
présente dans Chroogomphus rutilus ou Gomphide rutilant.
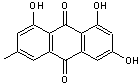
2-3-3) Des anthraquinones :
Les
pigments anthraquinoniques sont rouge orangé, fauves et bruns ; en voici
quelques exemples :
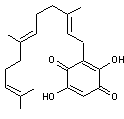
|
L'émodine
est le colorant rouge orangé de Cortinarius cinnabarinus entre autres. |
|
L'anhydrophlegmacine-9,10-quinone
est présente par exemple dans Cortinarius aureofulvus, Cortinarius
auroturbinatus, Cortinarius odorifer, Cortinarius prasinus …. |
|
Emodine |
Anhydrophlegmacine-9,10-quinone |
|
|
|
|
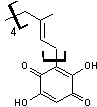
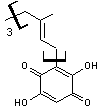
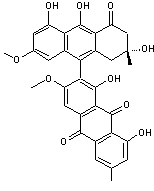
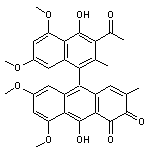
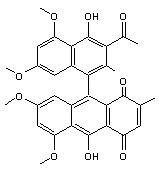
Rufoolivacine A et B sont présentes
en particulier dans Cortinarius rufoolivaceus. |
|
Rufoolivacine A |
Rufoolivacine B |
|
Certains
de ces pigments sont dérivés de polycétides (voir annexe 1),
c'est par exemple le cas des Rufoolivacines A et B ; un petit groupe de
cortinaires, les Dermocybes ont des pigments anthraquinoniques dérivés
d'octocétides (Gill
et Steglich 1987).
2-3-4) Un pigment non quinonique mais dérivé de polycétide
:
Mycena
aurantiomarginata est
un agaricale dont le bord libre des lames est orangé. Pour cette raison on
l'appelle "mycène à arêtes orangées". Cette couleur est due à un pigment
la mycena aurine A qui a un pouvoir antimicrobien.
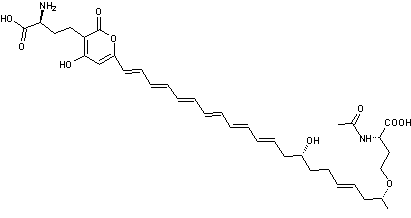
On voit
qu'il s'agit d'une longue chaîne polyène, avec un groupe α-pyrone et un
groupement acide aminé à chaque extrémité.
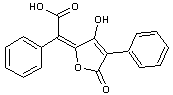
2-4) Des
dérivés de l'acide pulvinique
|
|
|
Acide pulvinique |
- Acide variégatique et ses
composés obtenus par oxydation
|
|
|
Acide variégatique |
Pigment
jaune ocre que l'on trouve dans le bolet moucheté (Suillus variegatus)
et le bolet à pied rouge (Boletus erythropus) notamment.
Il possède
4 fonctions phénol de plus que l'acide pulvinique.
|
|
|
|
Suillus variegatus |
Boletus erythropus (B. Cazeneuve) |
Par
oxydation à l'air il se forme la variégatorubine :
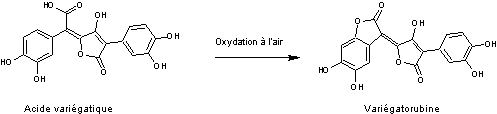
On
remarque la formation d'un 2ème cycle lactone ; c'est un pigment
rouge que l'on trouve dans les Boletales.
Remarque : Certains bolets
coupés ou âbimés se colorent en bleu ; cette teinte provient de l'oxydation à
l'air, mais sous l'effet d'une enzyme oxydase, de l'acide variégatique ; Il se
forme une quinone bleue :
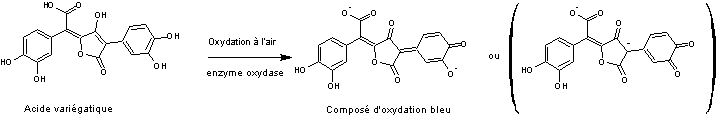
- L'acide xérocomique :
Molécule
possédant 3 fonctions phénol de plus que l'acide pulvinique ; c'est un
précurseur de l'acide variégatique.
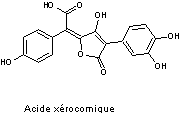
C'est
un pigment rouge que l'on trouve notamment dans Gomphidius glutinosus et
Gomphidius maculatus.
A l'air
il se forme un pigment xérocomorubine tout à fait semblable à la variégatorubine
:
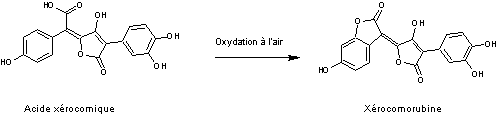
Il
existe une forme quinone bleue tout à fait comparable à celle de l'acide
variégatique :
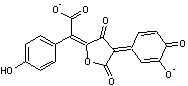
- L'acide gomphidique :
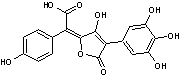
On le
trouve dans le gomphide glutineux (Gomphidius glutinosus) ; il ne bleuit
pas à la coupure.
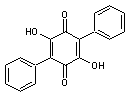
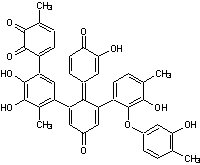
- La Norbadione A
Pigment
donnant une coloration rouge ; Il a été isolé en 1984 par Steglich à partir du
bolet bai (Xerocomus badius ou Boletus badius) ; il provient de
la dimérisation de l'acide xérocomique.
C'est
le pigment dominant de Pisolithus arrhizus.
|
|
|
|
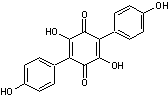
Norbadione A |
Badione A |
On
trouve aussi souvent accompagnant la norbadione A, la badione A qui a la même couleur :
La
norbadione possède, outre sa qualité de pigment, une capacité à complexer les
ions césium et une activité antioxydante.
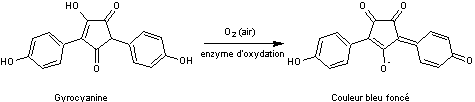
2-5) Un dérivé
de cyclopentène dione : La gyrocyanine
On
trouve ce pigment dans Gyroporus cyanescens ou Bolet indigo.
Les
pores blanc crème bleuissent intensément au toucher :
2-6) Dérivés de
pyrane dione : Les grevillines
|
|
|
Noyau
pyrane dione |
Dans
tous ces cycles qui se ressemblent au premier coup d'œil, veiller à ne pas
confondre
![]() et
et ![]()
Des
pigments jaunes ou rouges de nombreux Suillus ont ce noyau pyrane dione
dans leur molécule.
Exemple :
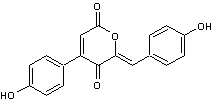
Ces
composés sont des grevillines.
2-7) Les dérivés
de la phénoxazone
La
phénoxazone est :
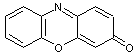
On
trouve dans Pycnoporus cinnabarinus (Pycnopore cinabre) des pigments
rouge vif (Le cinabre correspond au sulfure de mercure (II) HgS qui est de
couleur rouge vermillon) :
|
|
|
Pycnoporus cinnabarinus |
deux de
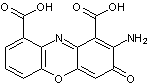
ces pigments sont la cinnabarine et l'acide cinnabarique :
|
|
|
|
Cinnabarine |
Acide cinnabarique |
2-8) Les dérivés
du purpurogallol
Le
purpurogallol a pour molécule :
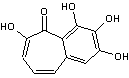
C'est
un composé cristallisé rouge, dérivant de la tropolone
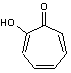
On
trouve dans l'amadouvier (un basidiomycète, Fomes fomentarius),
|
|
|
Fomes fomentarius (Photo Kriss de Niort) |
un
pigment rouge brun, le fomentariol, qui dérive du purpurogallol :
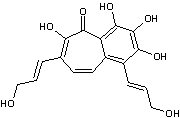
L'amadouvier
a servi à la fabrication de l'amadou, substance inflammable qu'on utilisait il
y a longtemps pour faire des mèches à briquets.
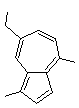
L'azulène
est un composé cristallisé bleu foncé dont la molécule est
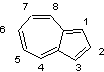
Le
Lactaire indigo est un champignon de la famille des Russulaceae qui pousse en
Amérique du nord, dans l'est de l'Asie et en Amérique centrale (on en trouve
quelques uns dans le midi de la France).

Sa
couleur est due à un composé dérivé de l'azulène : l'ester stéarique du 7-isopropényl-4-méthylazulèn-1-méthanol

un
analogue de l'azulène qui est biosynthétisé à partir d'une lactone
sesquiterpènique très similaire à la matricine
|
|
|
Matricine |
Celle-ci
étant le précurseur du chamazulène
:
|
|
|
Chamazulène |
2-10) Les
allomélanines :
La
truffe noire (Tuber melanosporum) est un champignon de couleur noire
comme son nom l'indique.
|
|
|
Tuber melanosporum |
Il est
admis que le pigment qui lui donne cette couleur est une mélanine : une
allomélanine.
Contrairement
à l'eumélanine un polymère indolique, donnant la couleur noire aux poils, aux
cheveux, à la peau chez les animaux et la couleur noire aux végétaux
supérieurs, l'allomélanine des champignons apparaît comme un polymère de
phénols simples comme le catéchol et la quinone correspondante
|
|
|
Catéchol |
Un
exemple de structure
|
|
|
Allomélanine |
Dans
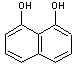
certains autres champignons tels Aspergillus niger et Daldinia
concentrica on trouve des unités pérylène dérivées du
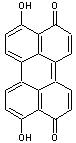
1,8-dihydroxynaphtalène
|
|
|
|
1,8-Dihydroxynaphtalène |
Unité pérylène |
Le
passage de la 1,8-dihydronaphtalène (1,8-DHN) à la mélanine s'effectue grâce à
une oxydo-réductase, la Laccase abr2 qui
utilise le cuivre comme cofacteur.
Les
mélanines produites dans les champignons assurent la rigidité de la paroi des
cellules fongiques, fixent les métaux, stockent de l'eau et des ions afin de
les prévenir de la dessication.
3) Des molécules toxiques des champignons
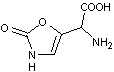
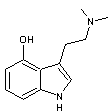
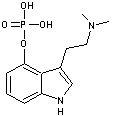
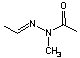
3-1) La muscarine
|
|
Alcaloïde toxique, présent dans des champignons du type Clitocybe et
Inocybe ; il provoque une importante sudation pour celui qui l'ingère ; l'intoxication
par cet alcaloïde peut-être grave, voire mortelle (enfants, personnes âgées). La muscarine a été découverte la première fois en 1869 dans l'amanite
tue-mouches (Amanita muscaria) où
elle existe en petites quantités dans le chapeau. |
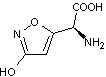
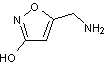
3-2) L'acide
iboténique
|
|
C'est
un isoxazole, puissant neurotoxique, présent notamment dans Amanita
muscaria et Amanita pantherina (Photo ci-contre). |
|
3-3) Le
muscimole
|
|
Alcaloïde
présent dans les champignons de type amanite. Possède des propriétés
hallucinogènes. L'acide
iboténique se transforme en muscimole par décarboxylation spontanée et progressive
lorsqu'il est ingéré. |
3-4) La
muscazone
|
|
C'est
un toxique présent dans les champignons de type Agaric. On le trouve aussi
dans Amanita muscaria. |
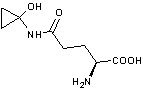
3-5) La coprine
|
|
C'est
une molécule présente dans des champignons tels que le Coprin noir d'encre (Coprinopsis
atramentaria) un basidiomycète (Photo ci-contre). Ce
champignon est parfaitement comestible sauf si l'on consomme de l'alcool
pendant les 3 jours qui suivent son ingestion. La coprine associée à
l'éthanol bloque l'enzyme acétaldéhyde déshydrogénase nécessaire à la
transformation de l'éthanal (produite in vivo par la transformation de
l'éthanol) en acide éthanoïque. L'éthanal, produit toxique pour l'organisme,
s'accumule. |
|
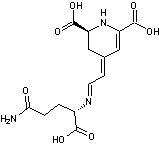
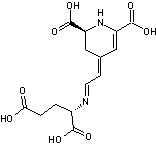
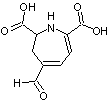
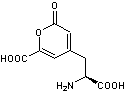
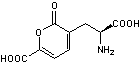
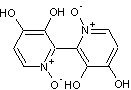
3-6) Les acides
stizolobique et stizolobinique
|
|
|
Toxines résultant de l'oxydation de
la L-Dopa et responsables d'effets anticholinergiques.On les trouve dans Clitocybe
acromelalga. |
|
Acide stizolobique |
Acide stizolobinique |
|
3-7) La
psilocyne et la psilocybine
|
|
|
|
Psilocyne |
Psilocybine |
|
Alcaloïde indolique hallucinogène
extrait de champignons (psilocybe, Stropharia..). Se présente sous
forme de poudre blanche. Cette
molécule est moins stable que la psilocybine. |
Molécule
que l’on trouve aussi dans les psilocybes
et qui correspond à l’hydrogénophosphate de psilocyne. La psilocybine se
transforme en psilocyne après ingestion. |
Psilocyne
et psilocybines sont des agonistes sérotoninergiques 5-HT2 et 5-HT1.
Cette
propriété n'est pas étonnante lorsque l'on compare la formule de la molécule de
psilocyne à celle de la sérotonine :
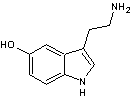
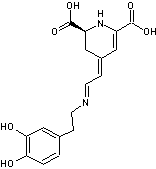
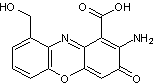
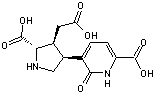
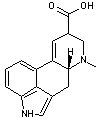
3-8) L'Orellanine
|
|
L'orellanine
est une mycotoxine présente dans un groupe de champignons, les Orellani de la
famille des Cortiniariacées. |
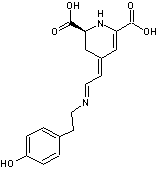
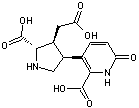
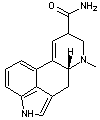
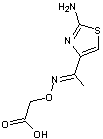
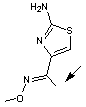
3-9) La
muscaridine
|
|
Une
mycotoxine présente dans Entoloma sinuatum "Entolome livide"
un champignon toxique que l'on trouve en Europe et en Asie. |
3-10) La
gyromitrine
|
|
Toxine
présente dans plusieurs champignons du genre Gyromitra comme par
exemple Gyromitra esculenta un ascomycète présent en Europe et en
Amérique du nord. C'est
une molécule instable et qui se transforme en méthylhydrazine agissant sur le
système nerveux central et qui est une substance carcinogène. |
3-11) L' acide vulpinique
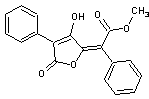
Bien qu'appelé
acide c'est un ester méthylique de l'acide
pulvinique.Il possède une fonction énol qui lui donne un caractère acide.
C'est
un des colorants jaune des lichens.
Il est
extrêmement toxique. Il est présent dans de nombreux champignons notamment les
Boletacées comme par exemple Pulveroboletus ravenelii.
C'est
un inhibiteur de croissance naturel chez les plantes comme l'acide abscissique.
3-12) Les
acides acroméliques
|
|
|
Existent
dans Clitocybe amoenolens, le champignon à bonne odeur, ainsi que dans
Clitocybe acromelalga. Ils dérivent de la proline et sont de puissants
neurotoxiques. |
|
Acide acromélique A |
Acide acromélique B |
|
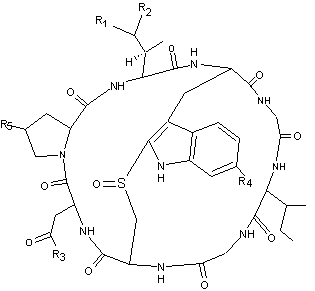
3-13) Les
amatoxines, les phallotoxines et les virotoxines
Les
amatoxines, les phallotoxines et les virotoxines sont les principales toxines
de certaines amanites, en particulier l'Oronge verte (Amanita phalloides), l'Oronge
cigüe blanche ou Amanite printanière (Amanita verna) et l'Ange de la
mort ou Amanite vireuse (Amanita virosa). Manger ces champignons peut
s'avérer mortel ; on estime que l'ingestion de 40 g environ (frais) peut
entraîner la mort d'un adulte.
Elles
ne sont pas également réparties dans le champignon, le chapeau étant la partie
la plus dangereuse.
Ces
toxines sont des octapeptides bicycliques pour les amatoxines, des
heptapeptides bicycliques pour les phallotoxines et des heptapeptides
monocycliques pour les virotoxines, ayant dans les trois cas, en position
centrale, un noyau indole lié à un atome de soufre :
Les
principales amatoxines sont au nombre de 9 avec par ordre d'importance,
l'α ou β ou γ ou ϵ amanitine, l'amanine, l'amaninamide
(que l'on ne trouve que dans Amanita virosa), l'amanulline, l'acide
amanullique et la proamanulline.
Il y a
7 phallotoxines : la phalloïdine, la phalloïne, la prophalloïne, la phallisine,
la phallacine, la phallacidine et la phallisacine
Il y a
6 virotoxines : l'alaviroïdine, l'aladéoxoviroïdine, la viroïsine, la
déoxoviroïsine, la viroïdine et la déoxoviroïdine.
Toutes
ces molécules sont très stables et elles résistent à la chaleur, aux sucs
digestifs et à la dessication.
La
structure générale de ces toxines est la suivante :
|
|
|
|
|
Ces toxines sont des octapeptides
bicycliques |
Ces
toxines sont des heptapeptides bicycliques |
Ces
toxines sont des heptapeptides monocycliques |
Mode
d'action de ces toxines :
Les
Phallotoxines et les amatoxines agissent sur le foie mais d'une façon différente
et en synergie.
Les
phallotoxines ont une action sur le reticulum endoplasmique des cellules du
foie, qu'elles détruisent ; tandis qu'en inhibant l'ARN polymérase (II)
extranucléaire et donc en bloquant la synthèse d'ARN messager, les amatoxines
empêchent la synthèse des protéines.
La
synergie entre ces deux types de toxines se manifeste de la manière suivante :
Les
amatoxines endommagent les cellules de l'estomac et de l'intestin, permettant
le passage des phallotoxines dans le sang puis dans le foie ; sans les
amatoxines, les phallotoxines seraient éliminées et donc sans action sur
l'organisme ; d'ailleurs la phalloïdine existe dans certaines espèces de
champignons comestibles.
L'action
des virotoxines est moins bien connue ; seules elles n'entraînent pas non plus
d'intoxication.
Comme
les phallotoxines elles agissent sur l'actine, une protéine contractile
impliquée dans le mécanisme de la contraction musculaire mais qui joue aussi un
rôle dans la motilité des cellules non musculaires.
L'actine
existe sous deux formes, la G-actine ou actine globulaire (une actine
monomérique) et la F-actine ou actine filamenteuse (une actine polymérisée).
Les
phallotoxines et les virotoxines favorisent la polymérisation irréversible de
l'actine G en actine F et stabilisent celle-ci, entraînant ainsi une
augmentation de la perméabilité membranaire, un œdème et la mort cellulaire ;
cependant leur mode d'action est différent.
- Voir
l'article entier sur les toxines des
amanites dans l'abécédaire
-
3-14) La
patuline
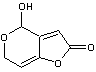
La patuline
est une mycotoxine c'est-à-dire une molécule toxique produite par des
moisissures (champignons microscopiques) tels que Aspergillus sp.et Penicillium
sp.
Elle
est très difficilement décelable car elle n'altère pas les propriétés
organoleptiques des fruits (pommes, poires, coings, abricots, bananes, pêches,
raisin….) dans lesquelles elle est présente, ni des jus qui en découlent (jus
de pomme, jus de raisin..). Elle est détruite en milieu alcool fort, mais la
pasteurisation l'épargne.
On en
trouve aussi dans le blé, le maïs, le riz, le soja, l'avoine, la luzerne ….).
Elle
présente de sérieux risques pour l'homme même à faible dose (lésions aux
poumons, reins, rate…)
3-15) Les
dérivés de l'acide lysergique :
Ce sont
des alcaloïdes produits par
l'ergot de seigle, un champignon parasite de l'épi du seigle : Claviceps
purpurea Tul.
Fondamentalement
c'est l'amide primaire de l'acide
lysergique qui est à la base de ce groupe de substances
|
|
|
|
Acide lysergique |
Amide de l'acide lysergique |
Plus de
40 toxines ont été isolées des sclérotes de Claviceps ; ce sont principalement
des produits de substitution de l'amide primaire de l'acide lysergique.
- soit des substituants aliphatiques
très simples comme par exemple l'ergométrine
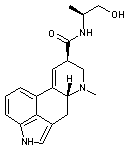
L'amide
elle-même, non substituée, a reçu le nom de "ergine". Elle provoque
des contractions musculaires.
- soit des substituants
polycycliques à structure assez compliquée, appelées ergopeptides (ou ergopeptines)
:
|
|
|
3-16) Les
aflatoxines
Ce sont
des mycotoxines produites dans certaines conditions de température et d'humidité
par des champignons se développant sur différentes graines (maïs, blé,
arachides...) mais aussi sur les noisettes, pistaches, figues, dattes, cacao,
café, soja....
On en trouve également dans le lait si le bétail a absorbé des aliments
contaminés. Il existe 18 aflatoxines différentes, de structure voisine, dont la
plus toxique est la B1 (AFB1).
Toxiques pour l'homme et les animaux elles présentent des propriétés
cancérigènes et tératogènes.
|
|
|
|
|
Aflatoxine B1 |
Aflatoxine B2 |
Aflatoxine G1 |
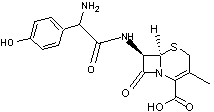
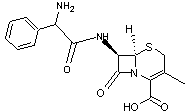
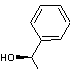
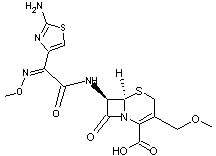
4) Quelques molécules précieuses
Leur
nom est indissolublement lié à l'histoire des antibiotiques.
Le
Docteur Ernest Duchesne (1874-1913) médecin des armées françaises fut le premier
biologiste à mentionner les effets de Penicillium,
une moisissure capable de neutraliser la prolifération des bactéries ; en 1928
Alexander Fleming, un bactériologiste britannique, découvre incidemment les
propriétés antibiotiques d'une substance qu'il nomme pénicilline. En
1941 des chercheurs d'Oxford le Docteur Florey et son équipe poursuivant les
travaux de Fleming concentrent des extraits de Penicillium notatum et testent cette pénicilline sur des souris
avec succès. En 1943 la préparation industrielle démarre. En 1945 A. Fleming,
Howard Florey et Ernest Chair reçoivent le Prix Nobel de médecine pour avoir
révolutionné le traitement des maladies infectieuses par l'usage des
antibiotiques.
On les
utilise contre les streptocoques, les pneumocoques, les méningocoques, les
tréponèmes....
·
Structure générale des pénicillines :
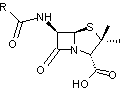
NB : Une flèche
indiquera le point d'ancrage du groupe R si nécessaire.
|
R = |
Nom |
R = |
Nom |
|
|
Pénicilline
G |
|
Pénicillines
M |
|
|
Pénicilline
V |
|
Pénicillines
A |
·
Pénicilline G (ou
benzylpénicilline)
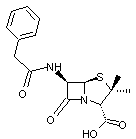
C'est
la molécule que l'on retrouve dans Penicillium notatum.
La
lettre G correspond à l'appellation "Gold standard" qu'on lui donne
et qui veut dire qu'elle constitue la référence dans l'étude des pénicillines.
Elle
est très active sur la plupart des streptocoques, les bacilles Gram positif,
les spirochètes et certaines neisseria.
Son
spectre d'action est assez étroit.
Elle
est administrée uniquement par voie parentérale (injections) car elle est
détruite dans l'estomac.
Elle
est sensible aux pénicillinases.
·
Pénicilline V (ou
Phénoxyméthylpénicilline)
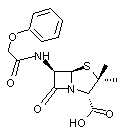
Son
spectre d'action est très proche de celui de la pénicilline G ; elle
acidorésistante et peut donc être administrée per os (c'est-à-dire par
voie orale) mais son absorption est incomplète. Elle est sensible aussi aux
pénicillinases.
On la
réserve pour des affections moins sévères.
·
Pénicillines M
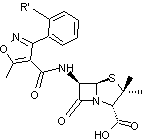
|
R' = |
Nom |
|
H |
|
|
Cl |
Leur
spectre d'action est plus large que celui des pénicillines G et V. Elles
permettent de combattre en plus, les bactéries
protégées par des pénicillinases comme certains Staphylococcus aureus.
On peut les qualifier d'antistaphylococciques.
·
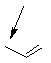
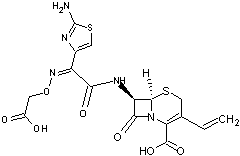
Pénicillines A
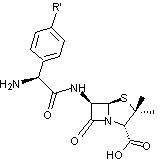
|
R' = |
Nom |
|
H |
Ampicilline |
|
OH |
Amoxicilline |
Le
spectre est plus large que celui des précédentes, car ces pénicillines
permettent de lutter également contre des bacilles à Gram négatif. Par contre
elles sont inactivées par les pénicillinases.
Remarque :
L'amoxicilline
est parfois associée à l'acide clavulanique (noms commerciaux, Augmentin ®,
Ciblor ® )
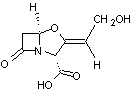
L’acide
clavulanique, bêta lactamine très peu active d’un point de vue antibiotique, va
inhiber les bêta lactamases produites par la bactérie en se fixant de façon
irréversible dessus et conserver à l’antibiotique tout son potentiel.
Ampicilline
et amoxicilline peuvent être administrées par voie orale ou par injection.
Ce sont
des pénicillines bactéricides ; elles inactivent des inhibiteurs endogènes des
autolysines bactériennes.
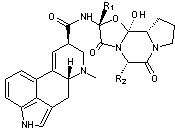
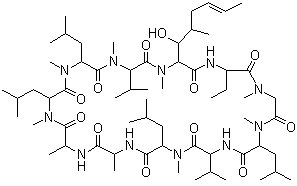
4-2) La
ciclosporine A
Hans Peter Frey des
laboratoires Sandoz (Bâle) ramène en 1972 de la terre de Hardanger en Norvège
contenant un champignon capable de synthétiser une molécule, la ciclosporine
qui s'est révélée être un agent immunosuppresseur.
Cette molécule découverte
fortuitement a permis dès 1983 un essor des transplantations d'organes
(médicament "anti-rejet"). Elle est aussi utilisée en dermatologie
(psoriasis et dermatite atopique) ; La ciclosporine a également montré un effet
anti-inflammatoire.
C'est un
peptide cyclique à 11 acides aminés synthétisé par un champignon microscopique
(Tolypocladium inflatum Gams).
Un de ses
noms commerciaux :
Neoral ® et
comme générique : Cicloral ®.
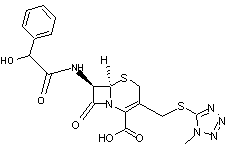
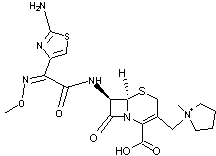
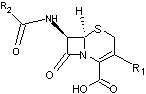
4-3) Les
Céphalosporines
Ces
molécules ont été retrouvées dans des champignons du genre Acremonium
autrefois appelés Cephalosporium d'où l'origine de leur nom.
·
Structure générale des céphalosporines
On les
classe en 4 générations qui se différencient par un ordre d'antériorité et par
leur spectre d'activité ; la première génération est active surtout pour les
Gram (+), la deuxième génération surtout pour les Gram (-), la troisième et la
quatrième ont un spectre qui s'étend des Gram (+) aux Gram (-).
Elles
résistent toutes les quatre aux pénicillinases mais diffèrent par leur
résistance aux céphalosporinases ; la première génération est détruite par les
céphalosporinases, la deuxième est relativement résistante vis-à-vis de ces
enzymes ; la troisième et la quatrième génération résistent encore mieux.
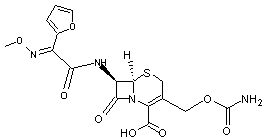
·
Exemples de céphalosporines de première génération
|
R1 = |
R2 = |
Nom |
Molécule |
|
|
|
1976 |
|
|
|
|
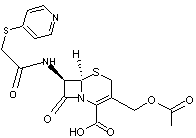
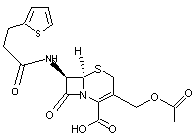
|
Ces
céphalosporines sont utilisées en ORL, en soins dentaires, en urologie.
Elles sont
administrées par voie orale.
Les deux
suivantes sont par contre, elles, administrées par voie parentérale.
|
R1 = |
R2 = |
Nom |
Molécule |
|
|
|
(Elle est réservée à l'usage hospitalier) 1974 |
|
|
|
|
1968 |
|
·
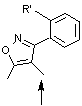
Exemples de céphalosporines de deuxième génération.
|
R1 = |
R2 = |
Nom |
Molécule |
|
|
|
Par voie
parentérale 1979 |
|
|
|
|
Par voie orale 1988 |
|
·
Exemples de céphalosporines de troisième et de
quatrième génération.
|
R1 = |
R2 = |
Nom |
Molécule |
|
|
|
3ème génération (1988) Par voie orale Bactéricide 1988 |
|
|
|
|
3ème génération (1991) Par voie orale Bactéricide 1991 |
|
|
|
|
4ème génération Par voie parentérale Réservé à un usage hospitalier. 1993 |
|
Les
polycétides
Les
polycétides correspondent à divers composés dont la structure contient une
succession de groupes carbonyle séparés par un groupe méthylène, donc …CH2-CO-CH2-CO……et
qui sont produits notamment par des bactéries et des champignons dont ils
constituent des métabolites secondaires.
Remarque : par extension on appelle aussi polycétides,
les produits qui dérivent des polycétides au sens strict.
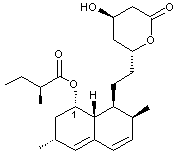
De
nombreuses substances ayant des propriétés biologiques et pharmacologiques très
diverses, dérivent de polycétides, comme par exemple la lovastatine :
|
|
présente à l’état naturel
dans un champignon (le pleurote en huître) et qui inhibe la
3-hydroxy-3-méthylglutaryl coenzyme A réductase qui est une enzyme-clé de la
synthèse endogène du cholestérol. |