HETEROSIDES
Jacques BARON
Gérard GOMEZ
Plan de l'étude :
1) Définitions
2) Classification
2-1) Les différents hétérosides abordés dans cette étude
2-2) O-hétérosides
2-3) S-hétérosides
2-4) C-hétérosides
2-5) N-hétérosides
2-6) Les glycoprotéines
1) Définitions :
On appelle hétérosides (anciennement glycosides) des
composés naturels, la plupart issus du monde végétal, formés d'un ou plusieurs
oses liés par leur fonction réductrice à une molécule, dite aglycone,
c'est-à-dire non glucidique.
La plupart de ces substances ont des effets sur
l'organisme (propriétés pharmacodynamiques) qui font qu'on les utilise en
thérapeutique.
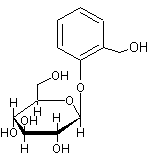
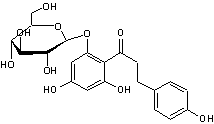
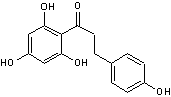
Exemple :
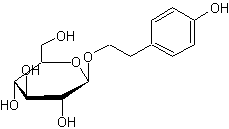
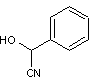
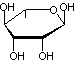
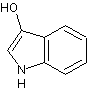
L'arbutoside tiré du fruit de l'arbousier :
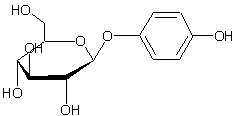
est un hétéroside dont
¾
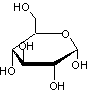
La partie glucidique est le
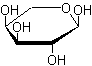
β-D-glucopyranose (l'ose étant le glucose on appellera cet hétéroside un
glucoside)
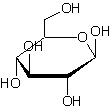
¾
La partie aglycone est l'hydroquinone
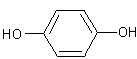
La liaison entre la partie glucidique et la partie
aglycone se faisant par un atome d'oxygène on dit que ces deux parties ont une
liaison O-glycosidique et qu'on est
en présence d'un O-hétéroside.
On connaît également des S-hétérosides, des N-hétérosides,
des C-hétérosides.
L'hydrolyse de ces hétérosides redonne l'ose et la partie
aglycone.
2) Classification :
2-1) Les différents hétérosides abordés dans cette étude :
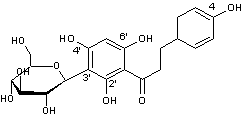
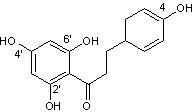
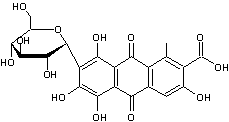
Acide carminique – Acide glycyrrhizique - Acide
rubérythrique – Aloïne - Amygdaline
– Anthocyanes - Arbutoside
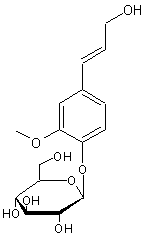
– Aspalathine – Cérasine - Coniférine – Convallatoxine
– Cycasine – Digitaline – Digitonine - Digoxine - Diosmine – Eriocitrine - Escine – Esculine – Gentiopicroside – Ginsénoside
– Gitoxine - Gluco-capparine
- Gluco-ibérine – Glycoprotéines
- Hédérine – Helléborine - Hespéridine - Indican – Isatan – Lanoxine - Linamarine - Naringine – Narirutine - Nothofagine – Nucléosides - Ouabaïne – Oléandrine – Phloridzine – Picéine - Quercitrine – Salicyline – Salidroside - Scilliroside – Scoparoside
- Sinigroside – Skimmine - Solanine – Sophoricoside - Stévioside – Syringine - Tanins – Tomatine -
On peut classer les hétérosides de plusieurs manières
(nature de la partie glucidique ou de l'aglycone ou encore effets sur
l'organisme…).
Nous ferons ici, un premier classement en considérant la
nature de la liaison glycosidique (O-glycoside
ou S-glycoside….) puis nous
séparerons à l'intérieur d'un même groupe les hétérosides en fonction de la
fonction chimique de l'aglycone qui a permis que se fasse la liaison avec l'ose
(par exemple fonction alcool ou phénol …pour les O-hétérosides….).
2-2) O-hétérosides
Fonction de l'aglycone qui permet la liaison avec la
partie glucidique de l'hétéroside :
Ø Phénol
|
Nom de l'hétéroside |
Formule de l'hétéroside |
Nom et formule de la partie glucidique |
Nom et formule de l'aglycone |
Sources et propriétés principales de l'hétéroside |
|
|
ou Arbutine ou ou 4-hydroxyphényl-β-D-glucopyranoside.
Cristaux en aiguilles (lorsque
recristallisé dans l'eau). Masse molaire : 272,251 g.mol-1 N° CAS : 497-76-7 |
|
β-D-Glucopyranose
|
|
Agent dépigmentant la peau. Il
fonctionne sur le même principe que l’hydroquinone c’est à dire, l’inhibition
de la mélanine. L’arbutoside inhibe l’activité de la
tyrosinase à des concentrations non cytotoxiques et donc diminue la
production de mélanine, Une particularité de cette substance est non
seulement d’éclaircir la peau, mais aussi de l’éclaircir uniformément.
L’arbutoside est également un antiseptique urinaire et intestinal
actif sur les colibacilles, principaux germes responsables des infections
urinaires. |
|
|
ou Salicine ou 2-(hydroxyméthyl)phényl-β-D-glucopyranoside C13H18O7
Aiguilles orthorhombiques ou feuilles
(lorsque recristallisé dans l'eau) Masse molaire : 286,278 g.mol-1 Densité : 1,434 (à 20°C) N° CAS : 138-52-3 Solubilité : Très soluble dans l'eau, l'éthanol,
l'acide acétique. |
|
β-D-Glucopyranose
|
Saligénol ou Alcool salicylique
C7H8O2
Aiguilles ou feuilles (lorsque
recristallisé dans l'eau ou l'éther) ; feuilles lorsque recristallisé dans le
benzène. Masse molaire : 124,138 g.mol-1 Densité : 1,1613 (à 25°C) N° CAS : 90-01-7 Solubilité : Très soluble dans le chloroforme ;
soluble dans l'eau, l'éthanol, l'éther, le benzène. |
Produit naturel existant dans les
feuilles et l'écorce du saule blanc. |
|
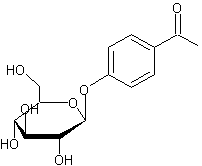
|
ou 1-[4-(β-D-glucopyranosyloxy) phényl]éthanone. C14H18O7
Aiguilles (lorsque recristallisé dans
l'eau ou le méthanol) Masse molaire : 298,289 g.mol-1 N° CAS : 530-14-13 Solubilité : Soluble dans l'éthanol, l'éther,
l'acide acétique ; légèrement soluble dans l'eau ; insoluble dans le
chloroforme. |
|
β-D-Glucopyranose
|
4-hydroxyacétophénone ou 1-(4-hydroxyphényl)éthanone
C8H8O2
Aiguilles (lorsque recristallisé dans
l'éther ou l'éthanol dilué). Masse molaire : 136,149 g.mol-1 Densité : 1,1090 (à 109°C) Indice de réfraction : 1,5577 (à 109°C) N° CAS : 99-93-4 Solubilité : Très soluble dans l'éthanol et l'éther
; légèrement soluble dans l'eau et le DMSO. |
Substance présente dans les aiguilles d'épicéas
; c'est un composé que l'épicéa ne produit qu'en période de stress. |
|
|
C16H22O8
Aiguilles (lorsque recristallisé dans
l'eau) Masse molaire : 342,341 g.mol-1 Densité : 1,432 N° CAS : 531-29-3 Solubilité : Soluble dans l'eau et la pyridine ;
légèrement soluble dans l'éthanol ; insoluble dans l'éther. |
|
β-D-Glucopyranose
|
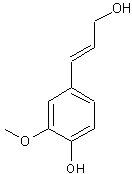
Alcool coniférylique ou 4-(3-hydroxyprop-1-ènyl)-2-méthoxyphénol
C'est un alcool phénol et c'est par sa
fonction phénol qu'il s'enchaîne au glucose. C10H12O3
Cristaux prismatiques (lorsque
recristallisé dans un mélange éther/ligroïne) Masse molaire : 180,200 g.mol-1 N° CAS : 458-35-5 Solubilité : Très soluble dans l'éther ; soluble
dans l'éthanol ; insoluble dans l'eau. |
Cet hétéroside est présent dans la
sève des conifères. Son hydrolyse conduit à l'alcool
coniférylique qui dérive tout comme l'acide férulique du métabolisme de la
phénylalanine et de la tyrosine ; il peut être obtenu à partir de l'acide férulique
par réduction. |
|
|
C17H24O9 Aiguilles blanches (lorsque
recristallisé dans l'éthanol) ; cristaux blancs (lorsque recristallisé dans
l'eau) Masse molaire : 372,368 g.mol-1 N° CAS : 118-34-3 Solubilité : Très soluble dans l'éthanol. |
|
β-D-Glucopyranose
|
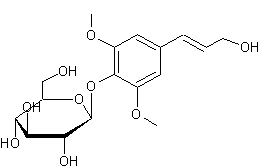
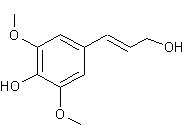
4-(3-hydroxyprop-1-ènyl)-2,
6-diméthoxyphénol C'est un alcool phénol et c'est par sa
fonction phénol qu'il s'enchaîne au glucose.
|
Substance que l'on trouve dans
l'écorce du lilas (Syringa), mais
aussi : - dans le péricarpe du citron (citrus limon). - dans la racine de Eleutherococcus senticosus ("ginseng
sibérien") - dans les feuilles de Forsythia suspensa. - dans les racines, les tiges et les
rameaux de Lonicera japonica
(chèvrefeuille du Japon). - dans le gui (viscum album). |
|
|
ou Phlorizine C21H24O10
Solide cristallisé de couleur crème Masse molaire : 436,41 g.mol-1 Densité : 1,555 N° CAS : 60-81-1 |
|
β-D-Glucopyranose
|
Phlorétine
C15H14O5
Cristaux en aiguilles (lorsque
recristallisé dans l'éthanol dilué). Masse molaire : 274,269 g.mol-1 N° CAS : 60-82-2 |
Substance à saveur sucrée intense,
présente dans l'écorce de plusieurs arbres fruitiers, pommiers, poiriers,
cerisiers. L'INRA a mis au point à partir de la phloridzine un
colorant jaune appelé jaune POP (pour Produit d'Oxydation de la Phloridzine)
destiné à remplacer la tartrazine (colorant alimentaire E 102). |
|
|
|
β-D-Xylopyranosyl-β-D-glucopyranose
|
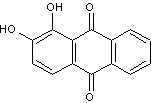
Alizarine ou 1,2-dihydroxy-9,10-anthracènedione
C14H8O4 Aiguilles tricliniques orangées ou
rouges ou cristaux prismatiques (lorsque recristallisé dans l'éthanol). Masse molaire : 240,212 g.mol-1 N° CAS : 72-48-0 Solubilité : Soluble dans l'éthanol, l'éther,
l'acétone, le benzène ; légèrement soluble dans l'eau ; insoluble dans le
chloroforme. |
Colorant rouge anthraquinonique ;
hétéroside tiré de la garance. La garance est une plante herbacée
dont la tige, à section carrée, peut dépasser 1m de long, rampante,
grimpante, munie d'aiguillons crochus. L'alizarine se voit dans les
racines. |
||
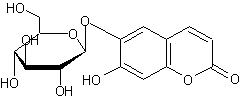
|
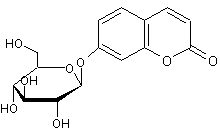
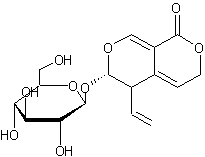
ou 6-(β-D-Glucopyranosyloxy)-7-hydroxy-2H-1benzopyran-2-one). C15H16O9 Cristaux prismatiques (lorsque
recristallisé dans l'eau) Masse molaire : 340,283 g.mol-1 N° CAS : 531-75-9 Solubilité : Soluble dans la pyridine, le
chloroforme, l'acide acétique ; légèrement soluble dans l'eau et l'éthanol. |
|
β-D-Glucopyranose
|
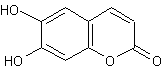
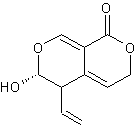
Esculétine ou 6,7-dihydroxy-2H-1-benzopyran-2-one
Molécule à noyau coumarine :
C9H6O4 Cristaux prismatiques (lorsque
recristallisé dans l'acide acétique) ; aiguilles (lorsque recristallisé dans
l'eau) ; feuilles (lorsque purifié par sublimation) Masse molaire : 178,142 g.mol-1 Ebullition : Se sublime N° CAS : 305-01-1 Solubilité : Soluble dans l'acétone, le
chloroforme, l'éthanol et l'éthanoate d'éthyle ; légèrement soluble dans
l'eau et l'éther. |
L'esculine est une molécule extraite
des marrons d'Inde (provenant du marronier d'Inde : Aesculus
hippocastanum) et ayant des propriétés anticoagulantes. |
|
|
Umbelliférone glucoside ou ou 7-(β-D-glucopyranosyloxy)-2H-1-benzopyran-2-one C15H16O8 Aspect : Cristaux (lorsque recristallisé dans
l'eau) Masse molaire : 324,283 g.mol-1 N° CAS : 93-39-0 Solubilité : Soluble dans l'eau et l'éthanol ;
insoluble dans l'éther et le chloroforme. |
|
β-D-Glucopyranose
|
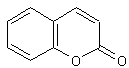
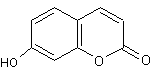
Umbelliférone ou 7-hydroxy-2H-1-benzopyran-2-one C9H6O3
Cristaux en aiguilles (lorsque
recristallisé dansl'eau) Masse molaire : 162,142 g.mol-1 Ebullition : Se sublime N° CAS : 93-35-6 Molécule à noyau coumarine :
|
Glucoside de l'umbelliférone qui se
trouve naturellement dans les carottes, la coriandre… C'est un indicateur de pH fluorescent
(Incolore à pH 6,5, bleu fluorescent à pH 7,6). |
|
|
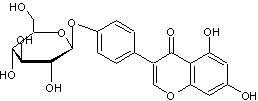
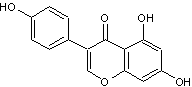
ou Génistéine-4-glucoside C21H20O10
Masse molaire : 432,378 g.mol-1 Fusion : 274°C N° CAS : 152-95-4 |
|
β-D-Glucopyranose
|
Génistéine
La génistéine, une isoflavone (isomère
des flavones), est un phyto-œstrogène c'est-à-dire un nutriment d'origine
végétale de structure non stéroïdienne capable de se fixer sur les récepteurs
des oestrogènes. |
Molécule que l'on trouve dans Sophora Japonica L. un arbre de 20m de
hauteur au port étalé ; sa cime est formée de nombreuses branches contorsionnées. L'action œstrogène de cette molécule
(sophoricoside) permet d'empêcher la perte de masse osseuse chez les
patientes ayant subi une ovarectomie. |
|
|
C27H32O14
Aiguilles (lorsque recristallisé dans
l'eau) Masse molaire : 580,535 g.mol-1 N° CAS : 10236-47-2 Solubilité : Soluble dans l'acide acétique ;
légèrement soluble dans l'eau et l'éthanol ; insoluble dans l'éther, le
benzène, le chloroforme. |
|
Enchaînement de α-L-rhamnose et
de β-D-glucose par liaison α-1,2-glycosidique. |
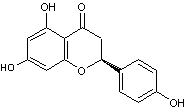
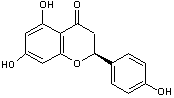
Naringénine
Extraite de l'écorce de pamplemousse
et autres citrus, elle sert à rendre amers, en particulier les
"toniques". C'est un flavonoïde. La naringénine est responsable
d'interactions avec certains médicaments. C15H12O5
Aiguilles (lorsque recristallisé dans
l'éthanol dilué) Masse molaire : 272,253 g.mol-1 N° CAS : 480-41-1 Solubilité : Très soluble dans le benzène, l'éther,
l'éthanol. |
Hétéroside contenu en particulier dans
le pamplemousse ; c'est ce qui donne au jus la saveur amère.
l'hydrogénation de la naringine donne un composé très sucré (700 fois plus
sucré que le saccharose) : la naringine dihydrochalcone :
|
|
|
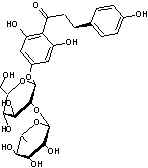
ou Isonaringine C27H32O14
Poudre blanc cassé Masse molaire : 580,535 g.mol-1 N° CAS : 14259-46-2 Densité : 1,66 Fusion : 163°C Ebullition : 924,3°C |
|
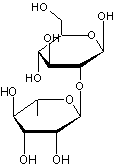
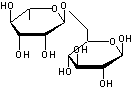
Rutinose
Enchaînement de α-L-rhamnose et
de β-D-glucose par liaison α-1,6-glycosidique. Remarque :
rappelons que la règle qui désigne les anomères α et β est inversée
pour les séries D et L. |
Naringénine
Extraite de l'écorce de pamplemousse
et autres citrus, elle sert à rendre amers, en particulier les
"toniques". C'est un flavonoïde. La naringénine est responsable
d'interactions avec certains médicaments. C15H12O5
Aiguilles (lorsque recristallisé dans
l'éthanol dilué) Masse molaire : 272,253 g.mol-1 N° CAS : 480-41-1 Solubilité : Très soluble dans le benzène, l'éther,
l'éthanol. |
Molécule présente dans les artichauts,
mais aussi dans les citrons, les
mandarines, ; on en trouve également dans Hamelia
patens (rubiacées) un arbuste d'Amérique tropicale. |
|
|
C28H34O15
Aiguilles blanches(lorsque
recristallisé dans l'éthanol ou l'acide acétique dilués) Masse molaire : 610,561 g.mol-1 Fusion : 262°C N° CAS : 520-26-3 Solubilité : Très soluble dans la pyridine,
l'éthanol, l'acide acétique. |
|
Rutinose
Enchaînement de α-L-rhamnose et
de β-D-glucose par liaison α-1,6-glycosidique. Remarque :
rappelons que la règle qui désigne les anomères α et β est inversée
pour les séries D et L. |
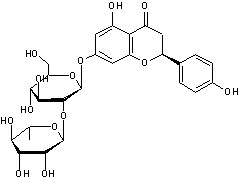
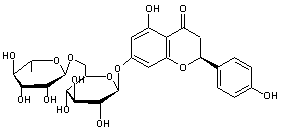
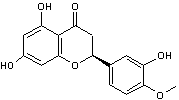
Hespérétine C16H14O6
Aspect : Plaques (lorsque recristallisé dans
l'éthanol dilué au demi dans l'eau) Masse molaire : 302,278 g.mol-1 Fusion : 227,5°C Ebullition : Se sublime à 205°C N° CAS : 520-33-2 Solubilité : Très soluble dans l'éther et
l'éthanol. |
C'est un flavonoïde que l'on trouve
principalement dans les écorces d'agrumes (oranges, citrons, pamplemousses…). Possède des propriétés
vasculoprotectrice, veinotonique et à ce titre entre dans la composition de
plusieurs médicaments (Daflon ®…). C'est aussi un anti-hémorroïdaire. |
|
|
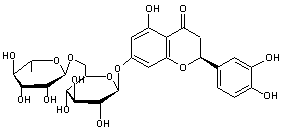
ou Eriodictyol-7-O-rutinoside C15H12O6 Masse
molaire : Ebullition : 956,9°C Densité : 1,77 N° CAS : 13463-28-0. |
|
Rutinose
Enchaînement
de α-L-rhamnose et de β-D-glucose par liaison
α-1,6-glycosidique. Remarque : rappelons que la règle qui désigne les anomères
α et β est inversée pour les séries D et L. |
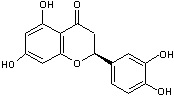
Eriodictyol ou (S)-3',4',5,7-tétrahydroxyflavanone C15H12O6
Aspect : Cristaux
en plaques ou en aiguilles (lorsque la recristallisation a eu lieu dans
l'éthanol). Masse
molaire : N° CAS : 552-58-9 Très
soluble dans l'éthanol et l'acide éthanoïque. Flavonoïde qui
réduit l'amertume des composés amers (caféine, quassine, …) ; on trouve cette molécule dans l'Herba Santa (Eriodictyon
californicum) plante d'Amérique du nord, mais aussi dans le citron (Citrus lemon) sous forme d'hétéroside. |
L'ériocitrine se trouve dans la peau
et le jus de citron (Citrus lemon)
; comme l'ériodictyol il réduit l'amertume des composés amers (caféine,
quassine, …). |
|
|
C28H32O15
Masse molaire : 608,54 g.mol-1 Fusion : 277,5°C Ebullition : 926,8°C Densité : 1,68 N° CAS : 520-27-4 Risques : |
|
Rutinose
Enchaînement de α-L-rhamnose et
de β-D-glucose par liaison α-1,6-glycosidique |
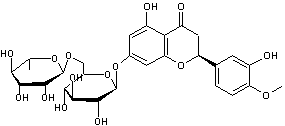
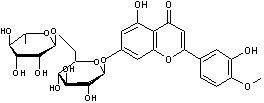
Diosmétine
|
C'est une flavone.O-méthylée présente
dans des plantes du genre Vicia
(Vesces). La diosmine de synthèse est un
complément alimentaire à propriétés phlébotoniques ; elle entre dans la
composition de certains médicaments ( Daflon ®). |
|
|
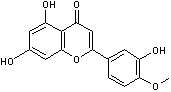
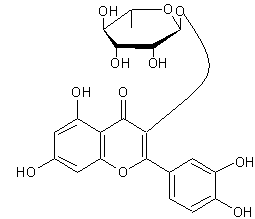
ou Quercétine-3-L-rhamnoside C21H20O11 Aspect : Aiguilles ou feuilles jaune clair
(lorsque recristallisé dans l'eau ou l'éthanol dilué). Masse molaire : 448,377 g.mol-1 N° CAS : 522-12-3 Solubilité : Soluble dans le méthanol, l'éthanol,
l'acide acétique, les bases alcalines ; insoluble dans l'eau et dans l'éther. |
|
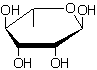
α-L-Rhamnose (ou 6-déoxy-α-L-mannopyranose) :
|
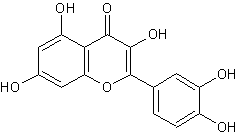
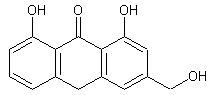
Quercétine
C'est un flavonoïde. C15H10O7 Aspect : Aiguilles jaunes (lorsque
recristallisé dans de l'éthanol dilué). Masse molaire : 302,236 g.mol-1 Ebullition : Se sublime N° CAS : 117-39-5 Solubilité : Soluble dans l'acétone, l'éthanol, la
pyridine ; légèrement soluble dans l'eau, l'éther, le méthanol. |
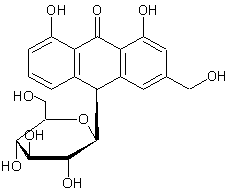
La quercitrine est un hétéroside que
l'on trouve dans l'écorce du quercitron, chêne d'Amérique du Nord. Elle a été
employée comme teinture ; C'est Chevreul qui a le premier extrait cette
matière colorante et lui a donné son nom. Elle se présente sous forme de
cristaux incolores, inodores ; sa solution dans l'éthanol est très amère. |
|
|
C16H20O9 Masse molaire : 356,33 g.mol-1 Fusion : 191°C N° CAS : 20831-76-9 |
|
β-D-Glucopyranose
|
|
Molécule présente dans les racines de gentiane
jaune (Gentiana lutea) appelée
aussi grande gentiane ou gentiane d'or que l'on trouve notamment en Auvergne
; elle a un goût amer et provoque des effets se rapprochant de ceux de la
quinine. |
|
|
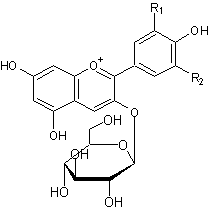
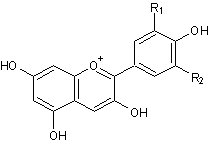
Anthocyanes du vin Avec : - Cyanidine R1 = OH et
R2 = H - Delphinidine R1 = OH
et R2 = OH -
Paeonidine R1 = OCH3 et R2
= H - Pétunidine R1 =OCH3 et R2
=OH - Malvidine R1 =OCH3 et R2
=OCH3 |
|
β-D-Glucopyranose
|
Anthocyanidines
|
La composition des anthocyanes dans
les vins rouges du type vinis vitifera
varie selon les cépages. Ce sont tous des hétérosides à base de
β-D-Glucopyranose et des cinq anthocyanidines citées avec une majorité
pour la malvidine. L'unité glucoside peut être estérifiée
en 3 par l'acide acétique ou l'acide p.coumarique, ce qui en fait correspond
à quinze anthocyanes dans ces vins rouges. |
Ø Alcool
|
Nom de l'hétéroside |
Formule de l'hétéroside |
Nom et formule de la partie glucidique |
Nom et formule de l'aglycone |
Sources et propriétés principales de l'hétéroside |
|
ou 2-(4-hydroxyphényl)-éthyl-β-D-glucopyranoside C14H20O7 Aspect : Poudre fine
brun-rouge Masse molaire : Densité : 1,46 10338-51-9 |
|
β-D-Glucopyranose
|
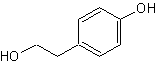
Tyrosol ou 2-(4-hydroxyphényl)-éthanol
C8H10O2 Aspect : Cristaux blanc cassé ou beiges Masse molaire : 91,8°C Ebullition : Densité : 1,46 501-94-0 Solubilité : Légèrement soluble dans l'eau. Composé phénolique que l'on trouve
notamment dans l'huile d'olive et qui a des propriétés anti-oxydantes. |
Hétéroside que l'on trouve dans l'orpin
rose (Rhodiola rosea ou Sedum roseum de la famille des
crassulacées ), plante à rhizome
épais et ramifié avec des petites feuilles charnues teintées quelquefois de
rouge. C'est une plante arctique dont les
feuilles constituent une nourriture pour les Inuits et les Lapons. |
|
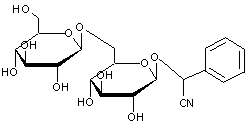
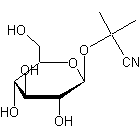
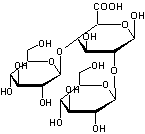
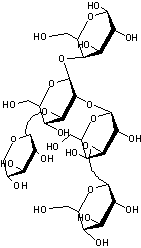
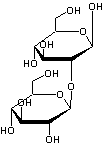
Amygdaline (du grec amugdalê: amande) ou Amygdaloside Mandelonitrile-b-gentiobioside |
|
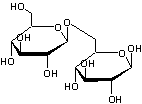
Gentiobiose
Il s'agit de deux molécules de
β-D-glucose liées par une liaison 1->6-O-glycosidique : β-D-glucopyranosyl-1->6-β-D-glucopyranose. |
2-hydroxy-2-phényléthanenitrile
C'est la cyanhydrine du benzaldéhyde. |
Hétéroside végétal présent dans les amandes
amères et les noyaux de certains fruits (les drupes: cerises, abricots,
prunes). Il a été mis en évidence en 1830 par Robiquet dans les amandes
amères (Fruits de Prunus amygdalus
amara). |
|
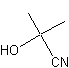
ou 2-(β-D-Glucopyranosyloxy)-2-méthylpropanenitrile. C10H17NO6 Aspect : Cristaux en
aiguilles (lorsque recristallisé dans l'éthanol ou l'eau). Masse molaire : Très soluble
dans l'acétone. N° CAS : 554-35-8 |
|
β-D-Glucopyranose
|
2-hydroxy-2-méthylepropanenitrile ou Cyanhydrine de la propanone
C4H7NO Masse molaire : Ebullition : 82 (sous 23 mm de Hg) Densité : 0,932 (à 19°C) Indice de réfraction : 1,3992 (à 20°C) Très soluble dans l'eau, l'éthanol,
l'éther ; soluble dans l'acétone, le benzène, le chloroforme. N° CAS : 75-86-5 |
Hétéroside ayant un groupement nitrile
dans sa partie aglycone. On en trouve notamment dans la racine
de manioc (Manihot osculenta),
un arbuste de la famille des euphorbiacées et originaire d'Amérique du sud. Par action de l'enzyme linamarase
présente dans les cellules du manioc et libérée lorsqu'on coupe les racines,
la linamarine se décompose et libère du cyanure d'hydrogène, composé toxique.
La consommation de la racine de manioc nécessite donc une préparation qui lui
enlève ce caractère dangereux (tapioca). |
|
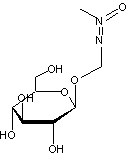
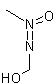
ou méthylazooxyméthanol-β-D-glucoside C8H16N2O7 Aspect : Se présente
sous forme d'aiguilles quand recristallisé dans l' acétone dilué. N° CAS : 14901-08-7 |
|
β-D-Glucopyranose
|
Méthylazoxyméthanol
|
On rencontre cette molécule dans les
feuilles de cycadales (par exemple Encephalartos
altensteinii), des plantes ayant le port d'un palmier et ressemblant à
des fougères, mais n'appartenant à aucune de ces familles. Son hydrolyse en milieu alcalin libère
du formaldéhyde, de l'azote, du méthanol entre autres. |
|
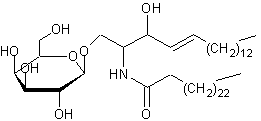
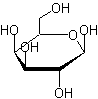
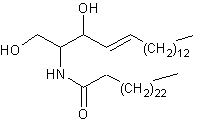
Galactocéramide ou Cérébrogalactoside |
|
β-D-Galactopyranose
|
Céramide :
correspondant à l'action de l'acide
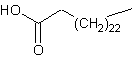
lignocérique :
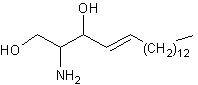
sur l'amine sphingosine :
|
C'est un cérébroside,
c'est-à-dire une substance que l'on rencontre dans les membranes des cellules
animales et particulièrement dans le tissu nerveux. Les cérébrosides d'une façon générale
sont formés par l'union d'une molécule de céramide, c'est-à-dire un amide issu de l'action d'un acide gras
(ici l'acide lignocérique) sur l'amine sphingosine, avec une molécule de
galactose ou une molécule de glucose par liaison osidique β. Le galactose se trouve plutôt dans le
tissu nerveux et le glucose dans les membranes. |
|
Hédérine |
|
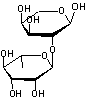
Enchaînement de α-L-rhamnose (ou
6-déoxy-α-L-mannopyranose) :
et de α-L-arabinopyranose :
par liaison 1->2-O-glycosidique. |
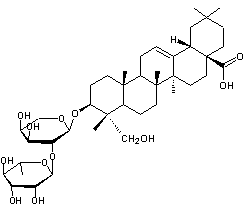
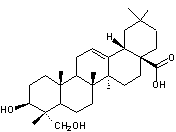
Hédéragénine
|
L'hédérine est présente dans le lierre
(Hedera helix). L'hédérine est une saponine ou
saponoside (nom générique d'hétérosides répandus dans le règne végétal, en
particulier dans la saponaire (Saponaria officinalis) ou herbe à foulon de la
famille des caryophyllacées) ; ce sont des corps à propriétés
tensio-actives solubles dans l'eau, qu'ils rendent moussante et capable
d'émulsionner les huiles et les résines. Les saponines entrent dans la
composition de lessives, shampooings...
Les
saponosides sont des métabolites secondaires hétérosidiques, présents dans de
nombreuses plantes et des organismes marins où ils auraient un rôle de
défense contre des agents pathogènes extérieurs (champignons, bactéries,
insectes) (Extrait
de la thèse de doctorat de Martin
Chwalek 2004 Université de Reims
Champagne- Ardenne). |
|
ou C42H62O16
Masse molaire :: |
|
2 molécules d'acide glucuronique enchaînées par liaison 1->2
O-glycosidique.
|
Génine de l'acide glycyrrhizique
|
Molécule présente dans la racine
de réglisse (dont le nom botanique est Glycyrrhiza glabra
; famille des légumineuses ou fabacées). Cette molécule fait partie de la
famille des saponines.
|
|
C55H86O24 Aspect : Poudre blanche. Masse molaire : 1108,38g.mol-1 Densité : 1,46 Risques : R 22-20/22 S 22-24/25 N° CAS : 6805-41-0 |
|
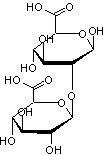
Enchaînement d'acide glucuronique avec 2 molécules de
β-D-glucopyranose en 2 et 4. |
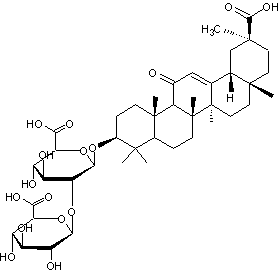
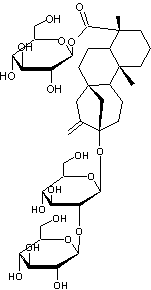
Desglucoescine
|
L'escine est présente dans le marron
d'inde (provenant du marronnier (ou marronier) d'inde : Aesculus
hippocastanum). L'escine est une saponine (nom générique
d'hétérosides répandus dans le règne végétal, en particulier dans la
saponaire (Saponaria officinalis ou herbe à foulon de la famille
des caryophyllacées) ; Ce sont des corps à propriétés tensio-actives,
solubles dans l'eau, qu'ils rendent moussante et capable d'émulsionner les
huiles et les résines. Les saponines entrent dans la composition de lessives,
shampooings. Les saponosides sont des métabolites
secondaires hétérosidiques, présents dans de nombreuses plantes et des
organismes marins où ils auraient un rôle de défense contre des agents
pathogènes extérieurs (champignons, bactéries, insectes) (Extrait
de la thèse de doctorat de Martin
Chwalek 2004 Université de Reims
Champagne- Ardenne). |
|
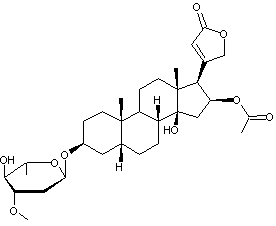
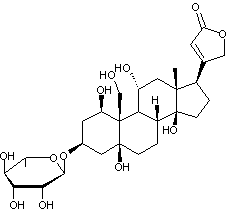
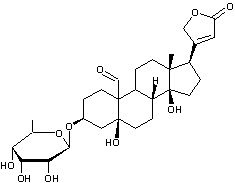
ou Digitoxine C41H64O13 Aspect : Poudre blanche Masse molaire : 764,9391 g.mol-1 Fusion : 255,5°C Solubilité : Dans l’eau : 3,9mg.L-1
à 25°C Très soluble dans l’éthanol ;
soluble dans l’éther, le chloroforme, le méthanol, la pyridine. N° CAS : 71-63-6 Risques : R 23/25, 33 S 1/2 , 45 |
|
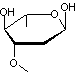
3 molécules de Digitoxose liées par liaisons 1->6
Remarque : La molécule de digitoxose peut également être dénommée : 2,6-didéoxy-D-altropyranose |
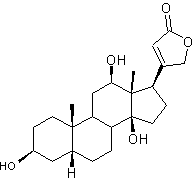
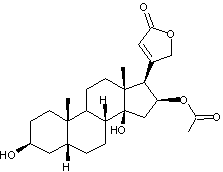
Digitoxigénine
|
Hétéroside extrait de
la digitale (Digitalis purpurea plante
toxique) et purifié pour la
première fois par Claude-Adolphe Nativelle après 25 ans d’efforts. La
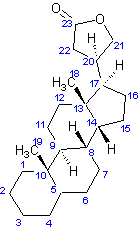
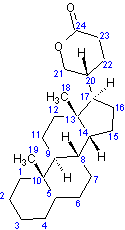
digitaline est un stéroïde cardénolide, formé d'un noyau stérane,
prolongé d'un cycle lactonique à 5 côtés comportant une double liaison, fixé
en C17 , ainsi que deux fonctions alcool en C3, C14
et deux groupements méthyle en C10 et C13. Elle traite les insuffisances
cardiaques. Structure du noyau cardanolide :
|
|
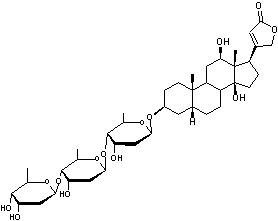
C41H64O14 Aspect : Cristaux prismatiques (lorsque
recristallisé dans un mélange chloroforme/méthanol). Masse molaire : 780,939 g.mol-1 Fusion : 285°C (se décompose) N° CAS : 4562-36-1 |
|
3 molécules de β-Digitoxose liées par liaisons 1->6
Remarque : La molécule de digitoxose peut également être dénommée : 2,6-didéoxy-D-altropyranose |
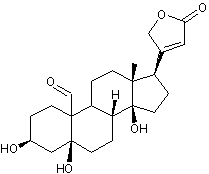
Gitoxigénine
C23H34O5 Aspect : Cristaux prismatiques (lorsque
recristallisé dans un mélange eau/éthanol ou l'éthanoate d'éthyle). Masse molaire : 390,513 g.mol-1 Fusion : 234°C N° CAS : 545-26-6 Solubilité : Soluble dans le chloroforme ;
légèrement soluble dans l'éther ; insoluble dans l'eau. Cette molécule ne diffère de
celle de la digitoxigénine que par la présence
d'une fonction alcool en C16. |
Hétéroside extrait de
la digitale pourpre (Digitalis purpurea
plante toxique). La gitoxine est un stéroïde cardénolide, formé
d'un noyau stérane, prolongé d' un
cycle lactonique à 5 côtés comportant une double liaison, fixé en C17
, ainsi que trois fonctions alcool en C3, C14, et C16
et deux groupements méthyle en C10 et C13. Cette molécule ne
diffère de celle de digitaline (ou digitoxine) que
par la présence d'une fonction alcool supplémentaire en C16. C'est un
cardiotonique. Structure du noyau
cardanolide :
|
|
ou Lanoxine C41H64O14 Aspect : Cristaux en plaques (lorsque recristallisé
dans de l'éthanol dilué ou de la pyridine). Masse molaire : 780,939 g.mol-1 Fusion : 249°C (se décompose) N° CAS : 20830-75-5 Solubilité : Très soluble dans l'éthanol |
|
3 molécules de β-Digitoxose liées par liaisons 1->6
Remarque : La molécule de digitoxose peut également être dénommée : 2,6-didéoxy-D-altropyranose |
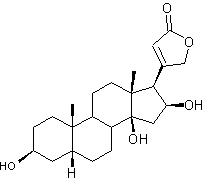
Digoxigénine
C23H34O5 Aspect : Cristaux prismatiques (lorsque
recristallisé dans l'éthanoate d'éthyle). Masse molaire : 390,513 g.mol-1 Fusion : 222°C N° CAS : 1672-46-4 Solubilité : Très soluble dans le méthanol et
l'éthanol ; légèrement soluble dans le chloroforme. |
Cardiotonique utilisé
dans les troubles du rythme cardiaque supraventriculaire. On en trouve dans la
digitale laineuse (digitalis lanata)
de la famille des plantaginacées, plante bi-annuelle ; ses fleurs ressemblent
à des doigts de gant et sont recouvertes de duvet laineux. C'est un stéroïde cardénolide. Structure du noyau
cardanolide :
|
|
C32H48O9 Aspect : Cristaux incolores, inodores, très amers, lorsque
recristallisés dans l'éthanol. Masse molaire : 576,718 g.mol-1 Fusion : 250°C (se décompose) N° CAS : 465-16-7 Solubilité : Soluble dans le
chloroforme, l'éthanol ; insoluble dans l'eau. |
|
2,6-didéoxy-3-O-méthyl-α-L-glucopyranose.
|
Oléandrigénine
Cette molécule ne diffère de celle de
la gitoxigénine que par le fait que la fonction alcool en C16 est
ici estérifiée par l'acide éthanoïque. |
C'est un membre de la famille des
stéroïdes cardénolides ; c'est un hétéroside vénéneux présent dans les
feuilles, la sève, l'écorce du "laurier" rose (Nerium oleander) un arbuste de la
famille des Apocynacées qui pousse dans le bassin méditérranéen, l'Asie
mineure, l'Inde et le Japon. C'est Wilhelm Neumann (né en 1898,
Professeur à Wurzbourg) qui a travaillé entre autres sur la chimie des
substances extraites du laurier rose (ou oléandre) et qui a établi que
l'oléandrine était un trait d'union entre les poisons cardiaques stéroïdiques
végétaux et animaux (venin de crapaud). Structure du noyau cardanolide :
|
|
ou Strophanthine G C29H44O12 Aspect : Plaques
hygroscopiques Masse molaire : 584,652 g.mol-1 Fusion : 200°C N° CAS : 630-60-4 Solubilité : Très soluble dans
l’éthanol ; légèrement soluble dans l’eau. Sécurité : R 23/25-33 S (1/2)-45 |
|
6-déoxy-α-L-mannopyranose
|
Ouabaïgénine
|
Molécule que l’on trouve dans les
lianes et les racines d’un arbre d’Abyssinie l’Acokanthera ouabaio (apocynacées) et dans les graines de Strophantus gratus (apocynacées). Cette molécule possède des propriétés
cardiotoniques par inhibition de la pompe à sodium Na+/K+-ATPase. L’ouabaïne servait à empoisonner les
flèches des guerriers somalis. C'est un stéroïde cardénolide. Structure du noyau cardanolide :
|
|
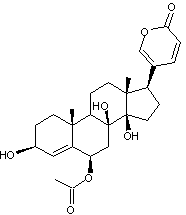
C29H42O10 Aspect : Cristaux prismatiques
(lorsque recristallisé dans un mélange éther/méthanol). Masse molaire : 550,637 g.mol-1 Fusion : 238°C N° CAS : 508-75-8 Solubilité : Soluble dans
l'éthanol et l'acétone ; légèrement soluble dans le chloroforme ; insoluble
dans l'éther. |
|
6-déoxy-β-D-Allopyranose
|
Génine de la convallatoxine
|
C'est une toxine contenue dans le
muguet (Convallaria majalis). C'est un hétéroside cardiotonique à
structure et propriétés voisines de l'ouabaïne. C'est un stéroïde cardénolide. Structure du noyau cardanolide :
|
|
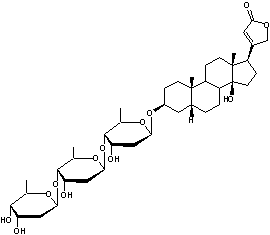
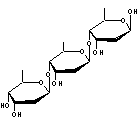
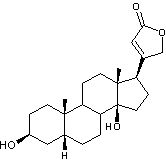
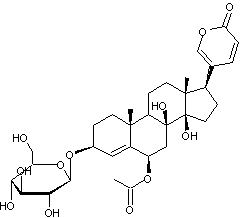
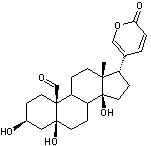
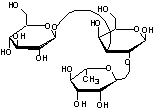
C32H44O12 Aspect : Longs prismes,
lorsque recristallisés dans le méthanol dilué. Masse molaire : 620,684 g.mol-1 Fusion : 169°C Ebullition : Se décompose. N° CAS : 507-60-8 Solubilité : Très soluble dans
l'éthanol, le dioxanne ; légèrement soluble dans l'eau, l'acétone, le
chloroforme. |
|
β-D-Glucopyranose
|
Scillirosidine
|
Cet hétéroside apparenté aux
digitaliques (digitaline) est contenu dans le bulbe de la scille rouge
; c'est un bufadiénolide c'est-à-dire un stéroïde possédant notamment
un cycle lactonique à 6 côtés, doublement insaturé, fixé en C17.
Le nom de cette famille (bufadiénolide) dérive de celui du crapaud buffle
(Bufo toad) qui a des glandes produisant certains de ces hétérosides. La scille (Scilla maritima ou Urginea
maritima) est une plante à bulbe de petite taille ; espèces ressemblant
aux jacinthes. Il existe deux variétés de scille, la
scille rouge (d'Espagne) et la scille blanche (d'Italie). Ce sont des plantes toxique du fait des
hétérosides qu'elles contiennent et qui agissent sur le rythme cardiaque.
Seule la scille rouge contient du scilliroside. Le scilliroside est diurétique à
petite dose ; c'est aussi un rodenticide. Structure du noyau bufanolide :
|
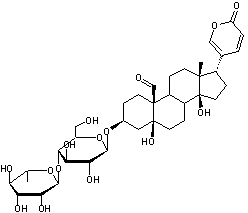
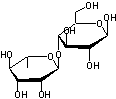
|
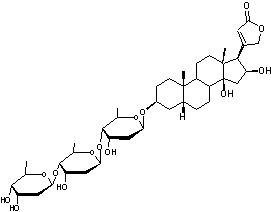
ou 3β-(O-4-β-D-glucopyranosyl-α-L-rhamnopyranosyloxy)-5,14-dihydroxy-19-oxo-5β,14-β-bufa-20,22-diènolide. C36H52O15 Aspect : Poudre cristalline
blanche Masse molaire : 724,789 g.mol-1 Ebullition : 931°C. N° CAS : 13289-18-4 |
|
Enchaînement de α-L-rhamnopyranose et de β-D-glucopyranose par
liaison 1-4-O-glycosidique. |
Hellébrigénine
C'est un stérol bufadiénolide
c'est-à-dire un stérol lié en C17 à un cycle lactonique à 6 côtés,
doublement insaturé. |
On trouve cet hétéroside dans l'hellébore
noir, qui est une renonculacée à fleurs blanches. Cette espèce fleurit de
décembre à mars ("rose de Noël"). Ele passait pour guérir la folie chez
les Anciens et cette célébrité est restée sous forme d'anecdote. Cette plante
est un poison violent, agissant sur le cœur, un purgatif très énergique et
elle peut provoquer des avortements. |
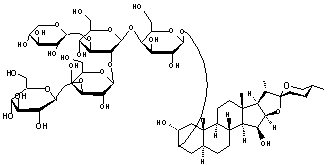
|
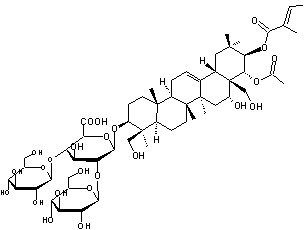
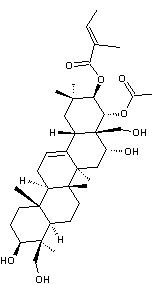
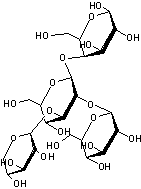
C56H92O29 Aspect : Solide cristallisé
blanc. Masse molaire : 1229,312 g.mol-1 Fusion : 237,5°C N° CAS : 11024-24-1 |
|
Pentaholoside formé par la réunion de β-D-galactose (2 molécules),
de β-D-glucose (2 molécules) et d'une molécule de β-D-xylose.
|
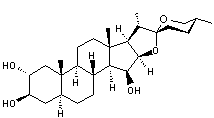
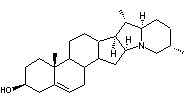
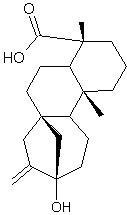
Digitogénine ou Spirostane-2,3,15-triol,(2α,3β,5α,15β,
25R) Elle a la remarquable propriété de
former un composé insoluble (qui précipite) avec les stérols ayant le groupement -OH en 3,
équatorial, mais pas avec ceux ayant ce groupement en axial.
C27H44O5 Aspect : Solide en aiguilles (lorsque
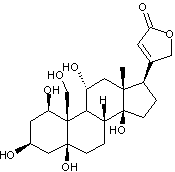
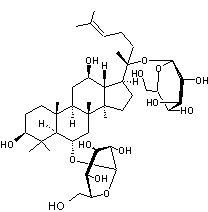
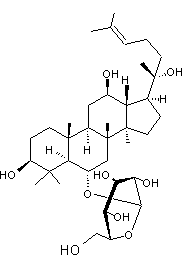
recristallisé dans l'éthanol). Masse molaire : 448,635 g.mol-1 Fusion : 281,5°C N° CAS : 511-34-2 Solubilité : Très soluble dans le chloroforme. |
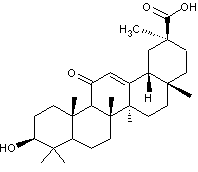
C'est une saponine, aux propriétés
détergentes qui permet la solubilisation des lipides. On s'en sert pour le
dosage du cholestérol. On la trouve dans la digitale
pourpre (Digitalis purpurea plante
toxique). Bien qu'ayant un nom voisin de la digitaline
(ou digitonine) cette molécule n'a pas de propriétés cardiotoniques. C'est un stéroïde de type spirostane. Structure du noyau spirostane :
|
|
C45H73NO15 Aspect : Aiguilles lorsque
recristallisé dans l’éthanol aqueux. |
|
Une molécule de β-D-galactopyranose enchaînée par liaisons
O-glycosiques en 2 à une molécule de α-L-mannopyranose et en 3 à une
molécule de β-D-glucose.
|
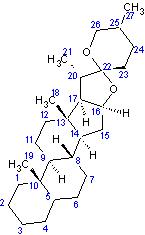
Génine de la solanine
|
Un des glycoalcaloïdes de la belladone
(Atropa belladonna). On en retrouve dans la pomme de terre (tige,
feuilles et même tubercule mais en très petite quantité). Composé toxique au
delà d'une certaine dose. |
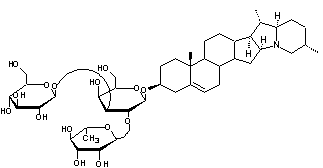
|
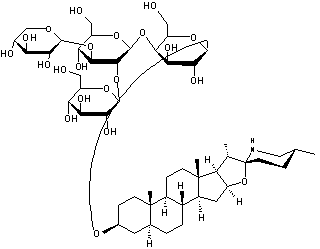
Tomatine Aspect : Se présente sous
forme d'aiguilles quand recristallisé dans le méthanol. Densité : 1,48 N° CAS : 17406-45-0 |
|
O-β-D-xylopyranosyl-(1->3)-[O-β-D-glucopyranosyl-(1->2)]O-β-D-glucopyranosyl-(1->4)-O- β-D-galactopyranose.
|
ou Spirosolan-3-ol,
(3β,5α,22β,25S) C27H45NO2 Aspect : Cristaux en plaques. Masse molaire : 415,652 g.mol-1 Fusion : 210,5°C Ebullition : 527,2°C Densité : 1,1 Indice de réfraction : 1,56 N° CAS : 77-59-8 Solubilité : Soluble dans l'éthanol et l'éther. La tomatidine est un alcaloïde de structure
semblable à celle de la cyclopamine, mais
qui n'est pas tératogène. |
Glycoalcaloïde qui existe dans
les extraits de racines des plants de tomate sauvage. |
|
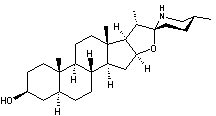
Ginsénoside A2 ou Rg1 C42H72O14 Masse molaire : 801,01 g.mol-1 Densité : 1,33 Ebullition : 898,5°C Risques : N° CAS : 22427-39-0 |
|
β-D-Glucopyranose
|
|
Hétéroside de type stéroïde,
principalement présent dans les racines du ginseng (Panax) plante originaire de Chine et
de Corée. |
|
C38H60O18 Masse molaire : 804,8722 g.mol-1 Fusion : 198°C N° CAS : 57817-89-7 Solubilité : Dans l’eau :
1,25 g.L-1 |
|
2-O-β-D-Glucopyranosyl-D-glucopyranose
|
Stéviol
|
Molécule extraite par la vapeur d’eau,
des feuilles de Stevia rebaudiana
(plante originaire d’Amérique du sud, de la famille des Asteracées). C’est un édulcorant dont le pouvoir sucrant est
comparable à celui de la saccharine, soit environ 300 fois supérieur à celui
du saccharose. Cependant la sensation sucrée qu’il procure est différente de
celle du saccharose ou de la saccharine. Il est utilisé comme substitut du
sucre pour les diabétiques. Remarque : On trouve d'autres hétérosides à
pouvoir sucrant dans la plante dont l'une d'elles, le rébaudioside A qui ne
diffère du stévioside que par la présence d'une molécule supplémentaire de
glucose. Cet édulcorant qui comme le stévioside n'induit pas de réponse
glycémique de l'organisme est moins amer que le stévioside et son pouvoir
sucrant est supérieur (environ 400 fois celui du saccharose) ; il possède un
arrière goût de réglisse. |
|
C14H17NO6 Masse molaire : 295,288 N° CAS : 1328-73-0 |
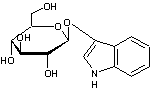
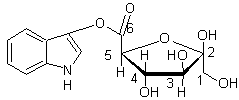
Indican Remarque : Isatan L’indigo existe aussi à l’état naturel dans les feuilles de pastel (Isatis tinctoria, une crucifère pouvant atteindre 1m de
haut) sous forme d'une molécule qui n'est pas à proprement parler un
hétéroside, mais qui s'y apparente, l’isatan B ; le fructose est sous
forme de β-D-fructofuranose oxydé en C6 et c’est le –OH de ce
carboxyle qui est mis en jeu :
La partie non glucidique de cette molécule est aussi l'indoxyle. |
β-D-Glucopyranose
|
Indoxyle :
Remarque : Il s'agit d'un énol et compte-tenu de
la tautomérie il nous faut également tenir compte de sa forme cétonique qui
est d'ailleurs majoritaire :
C8H7NO Aspect : Cristaux jaune-clair 480-93-3 Solubilité : Soluble dans l'eau, l'éthanol,
l'éther. |
Matière colorante, qui dans sa forme première
est d'un bleu un peu violacé. Elle est extraite de l'indigotier (Indigofera
suffruticosa ou indigofera anil arbrisseau des régions chaudes
(Salvador...) autrefois cultivée comme plante tinctoriale, de la famille des
papilionacées), ou obtenue par synthèse. L'indican (dérivé de l'indole) est
la molécule première existant dans les feuilles. L'hydrolyse enzymatique
suivie d'une oxydation à l'air conduit à la molécule d'indigo. Cette matière
colorante a été pendant des siècles utilisée comme teinture ; On obtenait
100g d'indigo en traitant 50kg de feuilles. C'est Eliza Lucas Pinckney
(1723-1793) qui est à l'origine des premières plantations d'indigotiers aux
USA. |
Ø Acide carboxylique
|
Nom de l'hétéroside |
Formule de l'hétéroside |
Nom et formule de la partie glucidique |
Nom et formule de l'aglycone |
Sources et propriétés principales de l'hétéroside |
|
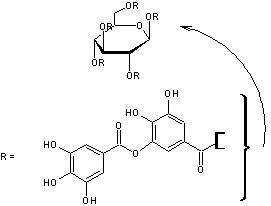
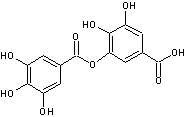
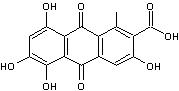
C76H52O46 Aspect : Poudre amorphe,
jaune-brun. N° CAS : 1401-55-4 Solubilité : Trés soluble dans l'ethanol, l'acétone ; insoluble dans le benzène, le chloroforme, l'éther. |
|
β-D-Glucopyranose
|
Acide digallique ou Acide
3,4-Dihydroxy-5-[(3,4,5-trihydroxybenzoyl)oxy]benzoïque
C14H10O9 Aspect : Feuilles (si
recristallisé dans l'éthanol dilué). 322,224 g.mol-1
N° CAS : 536-08-3 Solubilité : Trés soluble dans l'acétone et l'ethanol. |
Ce ne sont pas à proprement parler des
osides. Les tanins sont des combinaisons
complexes de glucose et d'acides polyphénoliques (dont l'acide gallique) que
l'on trouve dans l'écorce de chêne, l'écorce de châtaigner et dans les noix
de galle. Les fonctions alcooliques du glucose
sont estérifiées par les acides ; l'hydrolyse libère le glucose. Les tanins rendent les peaux imputrescibles d'où leur utilisation dans le traitement des cuirs. On les utilise aussi dans la fabrication des encres. |
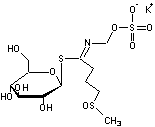
2-3) S-hétérosides
|
Nom de l'hétéroside |
Formule de l'hétéroside |
Nom et formule de la
partie glucidique |
Nom et formule de l'aglycone |
Sources et propriétés
principales de l'hétéroside |
|
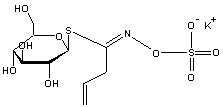
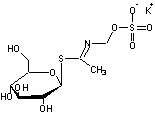
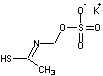
ou Sinigrine C10H17KNO9 S2 Masse molaire : 398,472 g.mol-1 Fusion : 126°C N° CAS : 534-69-0 |
|
β-D-glucopyranose
|
Cet aglycone est à base
d'isothiocyanate d'allyle (anciennement isosulfocyanate d'allyle) :
|
Hétéroside soufré (ou thioglucoside) présent dans les graines de
moutarde noire (Brassica nigra), le
raifort auxquels il donne une saveur piquante, mais aussi les choux de
Bruxelles, les brocolis. C'est aussi un antibactérien. |
|
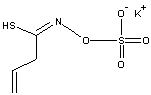
|
β-D-glucopyranose
|
Génine de la gluco-ibérine
|
Hétéroside soufré (ou thioglucoside), métabolite secondaire des plantes
de la famille des Brassicacées (choux, radis, raifort, cresson….) qui
correspond à un moyen de défense de la plante contre les ravageurs. Il donne la
saveur piquante à la moutarde, aux radis… |
|
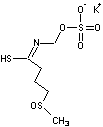
|
|
β-D-glucopyranose
|
Génine de la gluco-capparine
|
Hétéroside soufré (ou thioglucoside), métabolite secondaire des plantes
de la famille des Brassicacées (choux, radis, raifort, cresson) qui
correspond à un moyen de défense de la plante contre les ravageurs. Il donne
la saveur piquante à la moutarde, aux radis… |
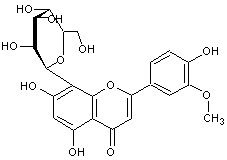
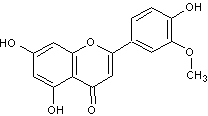
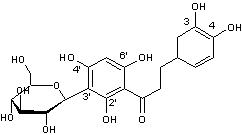
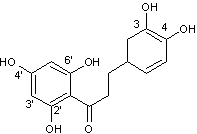
2-4) C-hétérosides
2-5) N-hétérosides :
Les nucléosides résultent d'une
condensation entre un ose et une base azotée hétérocyclique. Les nucléosides
entrent dans la constitution des acides nucléiques ADN (Acides
désoxyribonucléiques, DNA en anglais) et ARN (Acides ribonucléiques, RNA en
anglais).
Il est à présent établi que
des molécules géantes de désoxyribonucléoprotéines, qui sont des ADN liés à des
protéines de soutien, sont responsables du contrôle génétique ; elles sont
essentiellement situées dans les noyaux des cellules et sont appelées
chromosomes ; on en trouve aussi dans les mitochondries (organites responsables
de la production d’énergie pour les cellules et transmises exclusivement par
les femelles) ; on sait aussi, plus précisément que la fraction protéique
de ces molécules n’est pour rien dans les informations génétiques nécessaires à
la biosynthèse des enzymes et autres protéines, c’est l’ADN qui porte toutes
ces informations.
C’est à l’ ARN qu’est dévolu le rôle de transmettre le code
génétique dans les zones où ont lieu les synthèses des protéines.
Ces ADN et ARN dont nous
donnerons une idée sommaire un peu plus loin, nous serviront de repère pour les
explications qui vont suivre :
- Les aglycones des nucléosides sont :
· Des bases à noyau pyrimidine (bases pyrimidiques)
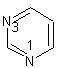
· Des bases a noyau purine (bases puriques)
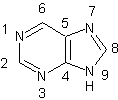
Remarque : cette numérotation, qui est anormale est consacrée
par l'usage.
Dans les ADN on trouve de
l'adénine et de la guanine issues de la purine :
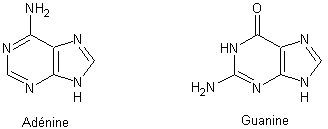
ainsi que de la cytosine
et de la thymine issues de la 2-hydroxy-pyrimidine :
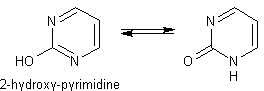
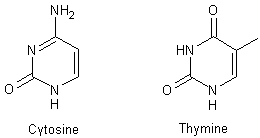
Dans les ARN on trouve
adénine, guanine, cytosine et uracile :
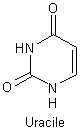
- Les oses sont :
* Dans les ARN, le ribose
:
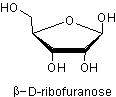
* Dans les ADN,
le désoxyribose :
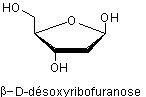
-
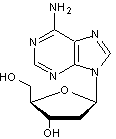
N-hétérosides : Les nucléosides
sont des N-hétérosides avec :
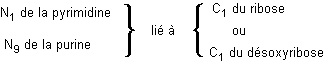
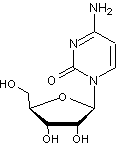
Deux exemples :
Ribose et cytosine : c'est la cytidine
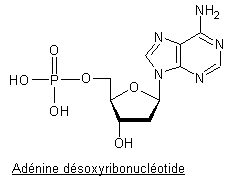
Désoxyribose et adénine : c'est la 2-désoxyadénosine
|
Complément 1 : Les acides nucléiques : ·
Pour former les chaînes
macromoléculaires d'acides nucléiques, il faut d'abord que le ribose ou le
désoxyribose soit estérifié par l'acide phosphorique (H3PO4)
; cela se fait en C5. Un ester phosphorique de nucléoside est un nucléotide :
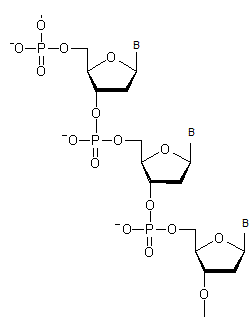
·
Enfin l'acide nucléique résulte de
l'enchaînement de très nombreux nucléotides grâce à une deuxième
estérification par H3PO4 sur les C3 de la
fraction glucidique. Exemple : fragment d'une chaîne d'ADN (B représente une base purique).
|
Adenosine TriPhosphate (ATP) :
Dans les muscles, on trouve de l'acide 5-adénylique où une molécule d'acide phosphorique
estérifie la fonction alcool portée par le carbone C5 de l'ose du
nucléoside. Si au lieu d'une molécule d'acide phosphorique, trois sont mises en
jeu, on obtient :
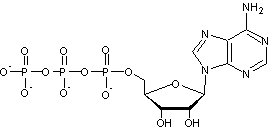
C'est l'acide adénosine triphosphorique, en pratique l'adénosine
triphosphate (ATP) qui joue un rôle fondamental pour les échanges d'énergie
dans les cellules.
2-6) Les glycoprotéines :
Les hétéroprotéines
dont le groupement prosthétique dérive d'une molécule osidique sont appelées
glycoprotéines.
Parmi les glycoprotéines on trouve des N-hétérosides et des O-hétérosides.
Parmi les constituants de la fraction glucidique des
glycoprotéines, on trouve fréquemment :
- des oses
·
hexoses (D-galactose D-mannose et peu de
glucose)
·
des 6-désoxyhexoses sous forme L
(L-fucose, L-rhamnose)
- des dérivés d'oses, par exemple des
2-amino-2-désoxy-D-hexoses, généralement N-acétylés (N-acétyl-D-glucosamine et
N-acétyl-D-galactosamine).
Remarque : Dans ces derniers cas, il reviendrait
au même de dire que la protéine est l'aglycone d'un hétéroside glucosidique ou
galactosidique.
Dans l'immense majorité des cas c'est au niveau de résidus
séryle, thréonyle ou asparaginyle qu'a lieu le branchement du glucide sur la
chaîne polypeptidique, mais tous les résidus de la chaîne ne sont pas
glycosylés ; ces résidus doivent avoir un environnement peptidique convenable
pour être glycosylés.
Parmi les glycoprotéines on trouve
- des N-hétérosides
Exemple : N-acétylglucosamine fixée sur un
reste de molécule d'asparagine d'une chaîne polypeptidique :

Il s'agit bien d'un N-hétéroside
puisque nous avons
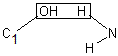
- des O-hétérosides
Exemple : N-acétylgalactosamine fixée sur un
reste d'une molécule de sérine d'une chaîne polypeptidique :
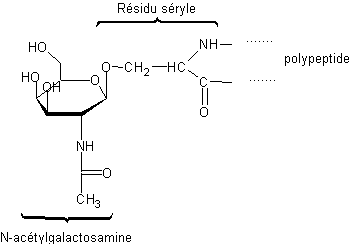
Il s'agit bien d'un O-hétéroside
puisque nous avons
![]()
On remarquera cependant qu'avec ces glycoprotéines,
l'hydrolyse libère un ose aminé en C2. En prenant le premier exemple
pour fixer les idées, le 2-amino-β-D-glucopyranose :
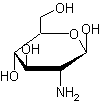
Les glycoprotéines ont une grande importance biologique.
On les rencontre à tous les niveaux :
- chondrine du cartilage, plus
spécialement sous forme de sulfate de la fonction alcool primaire (chondroïtine-6-sulfate),
- dans la mucine du mucus et du tissu
conjonctif,
- dans le plasma sanguin (transferrine,
transcortine, immunoglobulines …..),
- en tant qu'enzymes (ribonucléases)
- ……