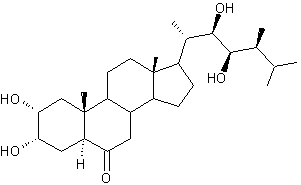
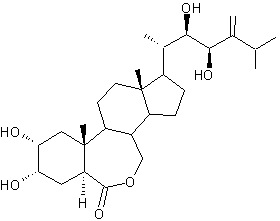
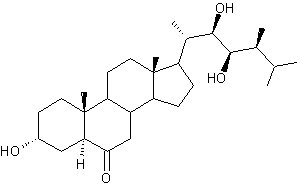
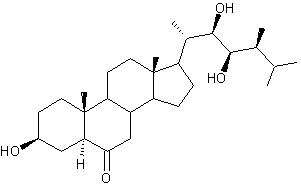
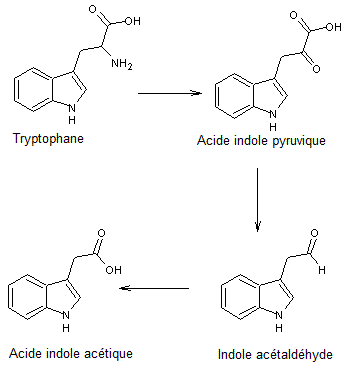HORMONES VEGETALES
Gérard
GOMEZ
1) Définition : D'une
façon très générale, une hormone est une molécule synthétisée par un organisme
et qui, à très faible concentration, va avoir une action sur le développement
de certains tissus de cet organisme, généralement différents de ceux dans
lesquels cette molécule a été produite.
Cette molécule porte
donc une information à la cellule de destination et influence, oriente le
fonctionnement de celle-ci. Cela la distingue d'une vitamine
qui aura seulement pour rôle d'intervenir comme catalyseur des réactions
métaboliques de la cellule.
Par ailleurs le
caractère endogène de la molécule est important pour la classer dans la
catégorie des hormones ; les substances produites par synthèse et ayant les
mêmes effets sur la plante seront appelées facteurs ou régulateurs de
croissance.
2) Hormones animales
et hormones végétales :
Les hormones animales
étudiées depuis longtemps appartiennent à diverses familles chimiques comme les
stéroïdes (hormones sexuelles :
testostérone, oestradiol, progestérone, oestrone…), les protéines (hormone de
croissance ou somatotropine), les peptides (insuline, calcitonine) ou sont des
molécules plus simples (adrénaline,
mélatonine, ,..).
Les hormones végétales
(ou phytohormones) sont de structure relativement simple et se distinguent des
hormones animales par le fait que souvent elles peuvent être produites en
plusieurs endroits du végétal sur des lieux de formation privilégiés, qu'elles
peuvent agir sur le site de production ou loin de celui-ci par diffusion de
cellules en cellules et enfin qu'elles agissent rarement seules ; le plus
souvent elles agissent en synergie avec d'autres hormones ou au contraire sont
antagonistes de celles-ci.
Il ne faut pas
confondre phytohormones et phyto-oestrogènes,
ces derniers étant des nutriments d'origine végétale de structure non
stéroïdienne capables de se fixer sur le récepteur des oestrogènes.
3) Différentes
phytohormones :
On distingue quatre
groupes de phytohormones :
- Les auxines,
- Les gibbérellines,
- Les cytokinines,
- Les brassinostéroïdes
et deux molécules
considérées comme hormones végétales :
- L'éthylène.
3-1) Les auxines :
L'auxine et une série
d'autres composés apparentés (naturels ou de synthèse) induisent l'élongation
cellulaire des tissus végétaux, la dominance apicale (ramification des parties
aériennes), la rhizogénèse adventive (formation des racines adventives), la
croissance et la maturation des fruits, la production d'éthylène ; elles
inhibent l'abscission (chute) des feuilles et des fruits.
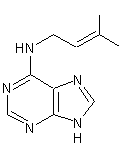
3-1-1) L'auxine :
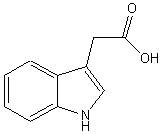
|
Auxine ou Acide indole acétique ou AIA Feuilles (si
recristallisé dans le benzène ; plaques si recristallisé dans le
chloroforme). Masse molaire : Environ 4,8 Fusion : N° CAS : 87-51-4 Solubilité : Très soluble dans
l'éthanol ; soluble dans l'éther, l'acétone, le benzène ; légèrement soluble
dans le chloroforme ; insoluble dans l'eau. |
Auxine Elle est synthétisée essentiellement
dans les jeunes feuilles et est transportée vers d'autres tissus pour en
coordonner le développement. Une des biosynthèses de l'auxine à partir du tryptophane :
|
L'auxine induit
également le phototropisme d'un végétal. Le phototropisme
d'une plante est sa tendance à orienter ses organes aériens vers la lumière. Si la source
lumineuse est isotrope, la tige s'élèvera verticalement ; si l'on éclaire la
partie gauche en laissant la partie droite dans l'ombre, la tige se courbera
vers la gauche. Cette courbure nécessite que la partie droite de la tige
s'allonge un peu plus que la partie gauche. On a en effet
remarqué (sans en connaître pour le moment la raison) que lors d'un
éclairement dirigé, l'auxine existe en plus grande quantité dans la zone de
la plante la moins éclairée, ce qui entraîne, une croissance de la partie
droite (dans l'exemple que nous avons choisi) plus importante que celle de la
partie gauche. |
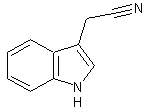
3-1-2) Les autres auxines naturelles :
De structure voisine de
l'auxine, elles peuvent assez facilement se transformer en auxine ; on ne sait
pas bien si leur action auxinique est due à leur molécule ou à l'auxine en
laquelle elles se transforment.
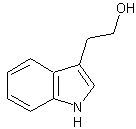
|
1H-Indole-3-éthanol ou Tryptophol ou IEt C10H11NO
Prismes (si
recristallisé dans un mélange benzène-éther de pétrole). Masse molaire : Ebullition : 174°C (sous 2 mm de
Hg). N° CAS : 526-55-6 Solubilité : Très soluble dans
l'acétone, l'éther, l'éthanol, le chloroforme. |
|
En dehors de ses
propriétés de phytohormone (son oxydation biologique conduit à l'acide
indoleacétique (Auxine ou AIA)), le tryptophol est une molécule
induisant le sommeil chez l'homme ; lors d'un traitement au disulfirame, il se forme dans le
foie. |
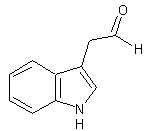
|
ou AIAld C10H9NO Masse molaire : 1,205 Ebullition : 352,7°C. N° CAS : 2591-98-2 |
|
C'est une
phytohormone ; son oxydation biologique conduit à l'auxine (ou AIA). |
|
C10H8N2 Masse molaire : 36 Ebullition : 160°C (sous 0,2 mm de
Hg). N° CAS : 771-51-7 |
|
Phytohormone ; sa
transformation biologique conduit à l'auxine (ou AIA). |
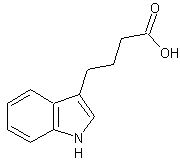
3-1-3) Les auxines de synthèse :
Elles agissent comme l'auxine
sur la croissance de la plante ; on les utilise, pour certaines, comme hormone
de bouturage et pour d'autres comme herbicide, car elles induisent une
croissance incontrôlée qui aboutit à la destruction de la plante.
|
|
|
Acide 1H-indol-3-butanoïque ou Acide indolebutyrique ou AIB C12H13NO2 Masse molaire : Ebullition : Se décompose. N° CAS : 86-87-3 Solubilité : Très soluble dans le benzène
; soluble dans le DMSO ; insoluble dans l'éther de pétrole. |
|
"Hormone"
de bouturage. |
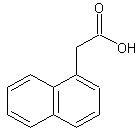
|
ou Acide
α-Naphtalène acétique ou ANA C12H10O2 Aspect : Aiguilles (si
recristallisé dans l'eau). Masse molaire : Ebullition : Se décompose. N° CAS : 86-87-3 Solubilité : Très soluble dans
l'éther, l'acétone, le chloroforme ; soluble dans le benzène ; légèrement
soluble dans l'eau et l'éthanol. |
|
C'est une auxine de
bouturage très utilisée. |
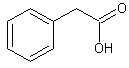
|
C8H8O2 Aspect : Feuilles ou plaques
(lorsque recristallisé dans l'éther de pétrole). Masse molaire : Ebullition : 265,5°C Densité : 1,228 (à 6°C) N° CAS : 86-87-3 Solubilité : Très soluble dans
l'éther ou l'éthanol ; soluble dans l'acétone ; légèrement soluble dans
l'eau, le chloroforme. |
|
Molécule ayant une
faible activité auxinique. |
|
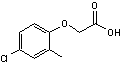
Acide (4-chloro-2-méthylphénoxy) acétique ou MCPA C9H9ClO3 Aspect : Plaques (si
recristallisé dans le benzène ou le toluène) de couleur brune. Masse molaire : N° CAS : 94-74-6 Solubilité : Très soluble dans
l'éthanol et l'éther ; soluble dans le benzène ; légèrement soluble dans
l'eau. |
|
Herbicide puissant et
sélectif (efficace surtout pour les dicotylédones). Il est très utilisé. Il imite une hormone
de croissance (l'acide indol-3-acétique ou auxine) mais
en induisant une croissance incontrôlée qui aboutit à la destruction de la
plante. |
|
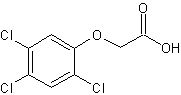
Acide (2,4-Dichlorophénoxy) acétique ou 2,4-D C8H6Cl2O3 Aspect : Cristaux (si
recristallisé dans le benzène). Masse molaire : Ebullition : 160°C (sous 0,4 mm de
Hg). N° CAS : 94-75-7 Solubilité : Soluble dans
l'éthanol ; légèrement soluble dans le benzène et le DMSO ; insoluble dans
l'eau. |
|
Herbicide systémique
sélectif, le plus utilisé dans le monde, qui imite une hormone de croissance
(l'acide indol-3-acétique ou auxine) mais en induisant
une croissance incontrôlée qui aboutit à la destruction de la plante. |
|
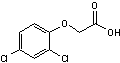
Acide (2,4,5-trichlorophénoxy) acétique ou 2,4,5-T C8H5Cl3O3 Aspect : Cristaux (si
recristallisé dans le benzène). Masse molaire : Ebullition : Se décompose. N° CAS : 93-76-5 Solubilité : Très soluble dans le
benzène ; soluble dans l'éthanol ; insoluble dans l'eau. |
|
Herbicide systémique
sélectif, imitant une hormone de croissance (l'acide indol-3-acétique
ou auxine) mais en induisant une croissance incontrôlée qui aboutit à la
destruction de la plante. |
|
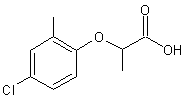
Acide 2-(4-Chloro-2-méthylphénoxy)propanoïque ou MCPP ou MECOPROP C10H11ClO3 Masse molaire : N° CAS : 93-65-2 Risques : |
|
Herbicide souvent
utilisé en association avec le 2,4-D, le MCPA ou le Dicamba en particulier
contre le trèfle ou le mouron blanc. |
|
Acide 3,6-dichloro-2méthoxybenzoïque ou Dicamba C8H6Cl2O3 Aspect : Cristaux (si recristallisé
dans le pentane). Masse molaire : Ebullition : Se décompose à 200°C. Densité : 1,57 (à 25°C) pKa : 1,97 N° CAS : 1918-00-9 Solubilité : Très soluble dans
l'eau et dans l'acétone (810g.L-1), le dichlorométhane (260g.L-1),
le dioxanne (1,18 kg.L-1), l'éthanol (922g.L-1). Risques : |
|
Herbicide qui en
stimulant la croissance incontrôlée des dicotylédones, contribue à la
destruction de la plante. |
3-2) Les gibbérellines :
Les gibbérellines
constituent un autre groupe de phytohormones ; l'acide gibbérellique trouvé la
première fois dans Gibberella fujikuroi un champignon qui lui a donné son nom est l'une de ces hormones, la
plus connue. On la désigne aussi par GA3.
Il existe plus de cent gibbérellines désignées par GAn, n pouvant
varier de 1 à 130 environ.
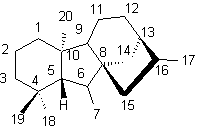
Elles ont toutes un noyau commun qui est le noyau gibbane (C15H24),
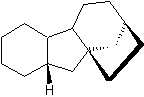
et une structure
commune qui est la suivante :
Les gibbérellines ont
une action sur la croissance des tiges (et non des racines contrairement à
l'auxine), des fruits comme le fait l'auxine, mais aussi pour des espèces
(pommes, pêches, raisins) pour lesquelles l'auxine n'a pas d'action. Elles ont
une influence sur la levée ou interruption de la dormance (la dormance étant la
période pendant laquelle la végétation est au repos) et s'opposent donc aux
effets de l'acide abscissique ; elles interviennent également sur l'initiation
de la floraison et le débourrement des bourgeons.
Les sites de synthèse
des gibbérellines sont les jeunes feuilles, les fruits, les graines, les apex
des tiges (caulinaires) et des racines (racinaires).
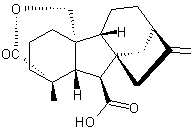
3-2-1) L'acide gibbérellique :
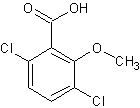
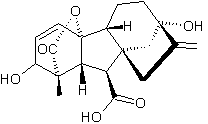
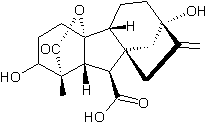
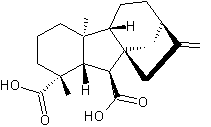
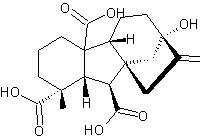
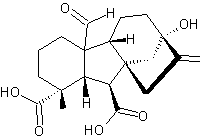
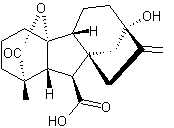
3-2-2) Quelques autres gibbérellines :
|
|
|
|
|
|
|
|
|
3-3) Les cytokinines :
Les cytokinines sont
des adénines substituées ; l'adénine (ou
6-aminopurine) est une base purique qui intervient dans la synthèse des acides nucléiques.
Les cytokinines
naturelles correspondent à une molécule d'adénine où un H du groupement –NH2
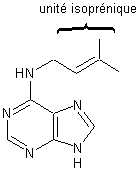
est remplacé par une chaîne à 5 carbones (unité isoprénique) : elles
existent aussi à l'état de nucléoside et de nucléotide.
|
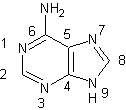
Adénine (ou
6-aminopurine)
|
Exemple de cytokinine
:
|
Elles sont présentes
dans presque tous les tissus mais ce sont surtout les tissus proches de l'apex
racinaire qui sont impliquées dans cette production.
Les cytokinines en
présence d'auxine stimulent la division cellulaire, leur rôle précis portant
sur la duplication des chromosomes et le recloisonnement cellulaire. Elles
agissent sur l'auxèse des cellules foliaires adultes et favorisent l'extension
radiale des tiges et des racines. Elles activent la production de chlorophylle.
Environ deux cents
cytokinines ont été identifiées et isolées.
Nous avons regroupé
quelques-unes d'entr'elles dans les tableaux ci-dessous :
|
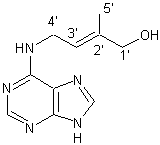
Zéatine (isomère E) C10H13N5O Aspect : Poudre cristalline
blanche Masse molaire : 219,25g.mol-1 Fusion : 207°C Ebullition : 583,9°C N° CAS : 1637-39-4 Solubilité : Soluble dans l'eau Risques : |
|
La plus connue car la
plus répandue dans le règne végétal. |
|
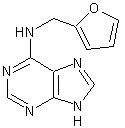
ou 6-furfurylaminopurine
Obtenue en 1955 à
partir de sperme de hareng. C10H9N5O Aspect : Poudre blanche Masse molaire : 215,2114 g.mol-1 Fusion : 270°C N° CAS : 525-79-1 |
C10H13N5 Masse molaire : 203,2437 g.mol-1 Densité : 1,266 N° CAS : 2365-40-4 |
N(6)-Benzyladénine ou N-(Phénylméthyl)-1H-purin-6-amine
C12H11N5 Aspect : Poudre blanche Masse molaire : 225,249 g.mol-1 Fusion : 232,8°C Densité : 0,899 Indice de réfraction
: nD20
= 1,418 N° CAS : 1214-39-7 |
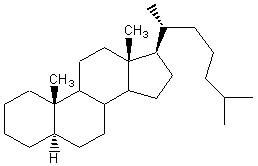
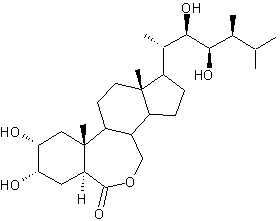
3-4) Les brassinostéroïdes
:
Depuis les années 1970,
on a caractérisé une soixantaine de molécules (dans les algues, les fougères,
les gymnospermes, les angiospermes), à structure de cholestane, c'est-à-dire
proche de celles des stéroïdes animaux.
|
|
Elles ont de multiples effets sur le
développement des végétaux : germination des graines, élongation des tiges,
expansion des feuilles, différenciation des tissus vasculaires.
La plus active et la plus répandue est le
brassinolide (BR1) trouvé en 1979 dans le pollen de colza (Brassica napus).
Quelques
brassinostéroïdes ont été regroupés dans un tableau :
|
C28H48O6 Aspect : Cristaux blancs Masse molaire : 480,66 g.mol-1 Ebullition : 633,7°C Densité : 1,141 N° CAS : 72962-43-7 |
Castastérone
Elle a été retrouvée
en 1982 dans le pollen de châtaignier (Castanea
crenata). C28H48O5 Masse molaire : 464,678 g.mol-1 N° CAS : 80736-41-0 |
|
Elle a été pour la première fois isolée en 1982 de la dolique pourpre (Dolichos lablab).
C28H46O6 Masse molaire : 478,661 g.mol-1 N° CAS : 85228-11-1 |
Typhastérol
C28H48O4 Masse molaire : 448,668 g.mol-1 N° CAS : 87734-68-7 N° CAS : 87734-68-7 |
|
Il fut isolé la
première fois en 1984 de l'arbre à thé (Thea
sinensis ou camellia sinensis).
C28H48O4 Masse molaire : 448,668 g.mol-1 N° CAS : 92751-21-8 |
Cathastérone Isolée en 1995 de la
pervenche de Madagascar (Catharantus
roseus).
C28H48O3 Masse molaire : 432,68 g.mol-1 N° CAS : 168146-23-4 |
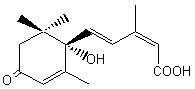
3-5) L'acide abscissique :
Phytohormone découverte
dans les années 1960 et impliquée dans l'abscission des feuilles et la dormance
des bourgeons (on l'a même appelée la dormine). Elle agit sur la réaction au
stress hydrique des plantes en provoquant la fermeture des stomates
(responsables des échanges gazeux assurant la photosynthèse mais aussi des
principales pertes d'eau par évapotranspiration) ; elle agit également sur la
régulation de la germination des graines ; elle induit la synthèse des
protéines de réserves. C'est également la principale hormone inhibitrice,
antagoniste des gibbérellines.
|
Acide abscissique Cristaux blancs
(lorsque recristallisé dans un mélange chloroforme, éther de pétrole). Masse molaire : Ebullition : Se sublime à 120°C Densité : 1,193 Pouvoir rotatoire
spécifique : Solubilité : Très soluble dans
l'acétone, l'éther, le chloroforme. |
|
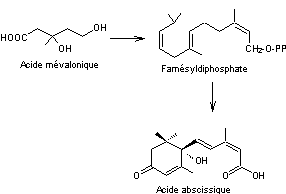
C'est à partir de
l'acide mévalonique
que l'acide abscissique est synthétisé dans les plantes. Les chloroplastes constituent
probablement le principal mais pas l'unique site de synthèse de l'ABA.
|
3-6) L'éthène ou éthylène :
Tous les tissus
végétaux produisent de l'éthylène avec un accroissement de cette production
lors de la maturation des fruits, de la germination, mais aussi lors
d'évènements climatiques (sécheresse, variations brutales de la température…).
Les effets
physiologiques de ce gaz sont nombreux ; le principal étant d'inhiber l'allongement
des tiges et de favoriser au contraire la croissance radiale de la plante.
L'éthylène favorise le
mûrissement des fruits, la floraison de l'ananas, mais par contre elle inhibe
la floraison d'autres espèces ; elle accélère la sénescence des organes d'une
plante et facilite par exemple la mise en place des zones d'abscission des
feuilles et des fruits.
|
Ethène ou Ethylène C2H4 Aspect : Gaz incolore et
inodore. Masse molaire : Ebullition : -103,77°C Densité : 0,5678 (à -104°C) Indice de réfraction : 1,363 (à -100°C) Solubilité : Soluble dans l'éther
; légèrement soluble dans l'éthanol, le benzène, l'acétone ; insoluble dans
l'eau. |
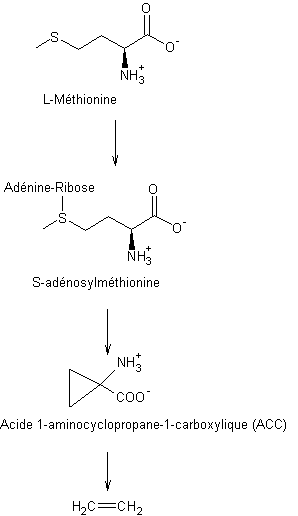
Elle est synthétisée
dans la plante à partir de la L-méthionine par un processus complexe dont les
trois principales étapes sont :
Cette dernière étape
a lieu en présence d'une oxydase, avec formation en outre de CO2, HCN
et H2O. |