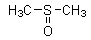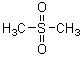QUELQUES MOLECULES "DE LA MER"
Gérard GOMEZ
1) Généralités :
La recherche de molécules "pharmaceutiques" dans le milieu marin est
assez récente et date des années 1950 environ. On en connaît quelques milliers
actuellement, c'est quinze fois moins que le nombre de molécules issues du
milieu terrestre. Quelques molécules présentes dans des organismes marins ont
été réunies dans le tableau ci-dessous.
On y trouve :
- Des substances que l'on
utilise comme médicaments (aplidine,
bryostatine, céphalosporines, dysidazirine, lamellarine D, macrolactine A, roscovitine, sceptrine,
squalamine, trabectédine, vidarabine, précurseurs de la zidovudine, ziconotide).
- Des molécules souvent
secrétées par des algues ou du phytoplancton, qui s'accumulent dans les
coquillages filtrant l'eau de mer (moules, huîtres, coquilles St Jacques.) ; la
consommation de ces coquillages entraîne des intoxications alimentaires car ces
molécules sont des toxines pour les organismes humains :
·
Toxines
diarrhéiques (Acide okadaïque)
·
Toxines
paralysantes (Saxitoxine)
·
Toxines amnésiantes.(Acide domoïque)
- Des colorants comme l'astaxanthine qui donne la couleur rose aux
salmonidés, crabes, crevettes, homards, langoustes au moment de la cuisson, ou
comme le 6,6'-Dibromoindigo, la pourpre du murex,
ou encore la caulerpine, la
fucoxanthine, la phycocyanobiline, la phycoérythrobiline,
pigments de certaines algues.
- Des polysaccharides extraits de la paroi
cellulaire des algues brunes (Alginates)
- Une molécule plus
simple, le diméthylsulfoniopropionate
ou DMSP produit par les cellules de phytoplancton qui pourrait en limitant
l’ensoleillement contribuer à une certaine régulation du climat global de la
planète.
2) Quelques molécules :
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
2-1) Quelques
médicaments :
|
C10H15
NO4 Aspect : Cristaux (lorsque recristallisé dans l'éthanol aqueux). Masse molaire : 213,231 g.mol-1 Fusion : 253°C (se décompose) N° CAS : 487-79-6 Solubilité : Soluble dans l'eau ; insoluble dans l'éthanol. |
|
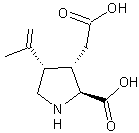
Analogue structural de l'acide
glutamique isolé de l'algue rouge Digenea simplex. C'est
un agoniste des récepteurs ionotropes du glutamate. En pratique vétérinaire c'est aussi un antihelminthique actif sur les
nématodes. |
|
ou Déhydrodidemnine B |
|
Cette molécule encore appelée Plitidepsine,
isolée d'un tunicier (Aplidium albicans),
organisme marin, est un depsipeptide*
et montre une forte activité antitumorale sur différentes cellules
cancéreuses (de type humain) croissant in
vivo et in vitro. * Un depsipeptide est un peptide dans lequel
une ou plusieurs liaisons amides ont été remplacées par des liaisons esters. |
|
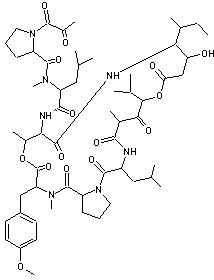
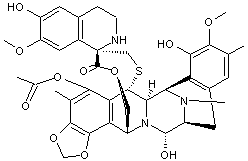
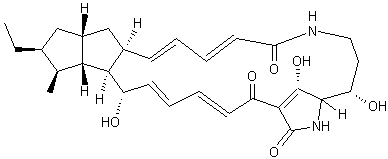
Bryostatine 1 On a pu simplifier chimiquement la bryostatine en
gardant ses propriétés antitumorales et nous donnons ci-dessous un analogue
simplifié de génération 2 :
|
Des bactéries symbiotiques présentes sur les larves de bryozoaires
produisent une molécule, la bryostatine qui
préserve ces larves de la prédation des poissons. Cette molécule a des propriétés anticancéreuses (pancréas, reins,
leucomes, mélanomes et lymphomes de type non-hodgkinien) qui sont
actuellement à l'étude. |
|
|
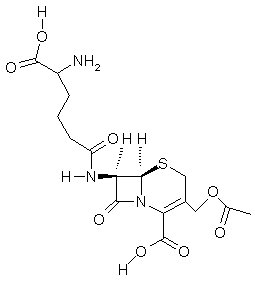
Céphalosporine C |
L’activité des céphalosporines et des pénicillines s’explique par la
présence d’un cycle β-lactame qui est tendu (quatre carbones) et ne
demande qu’à s’ouvrir ; il se révèle beaucoup plus réactif qu’un simple
amide. Les céphalosporines
contrairement aux pénicillines résistent aux pénicillinases, enzymes secrétés par des bactéries, qui
permettent l’hydrolyse du β-lactame avant que la molécule n’ait eu le
temps de « s’accrocher » au transpeptidase et qu’elle n’ait eu donc le temps de le
neutraliser. Rappelons que le transpeptidase est nécessaire à la biosynthèse de la
membrane cellulaire des bactéries. |
Les céphalosporines, sont une classe d'antibiotiques découverte en 1948
dans un champignon marin des côtes de Sardaigne (Cephalosporium acremonium). Actuellement elles sont toutes obtenues par synthèse. Les céphalosporines sont des β-lactames s’apparentant aux pénicillines. Elles
sont actives vis-à-vis des germes résistant à celles-ci. |
|
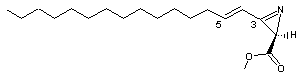
C19H33NO2 Masse molaire : 307,47082 g.mol-1 N° CAS : 113507-74-7 |
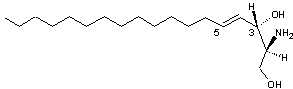
Dysidazirine La réactivité de cette
molécule s'explique par la tension du cycle azacyclopropène ; il y a une
attaque nucléophile au niveau du carbone C3 et addition conjuguée au niveau
du carbone C5. La synthèse dans la nature se fait à partir de la D-sphingosine,
une amine primaire à longue chaîne (C18) possédant deux fonctions
alcool et une double liaison trans et qui existe, chez l'homme, dans les
lipides du tissu cérébral et médullaire :
Il y a oxydation de la fonction alcool secondaire en C3 puis formation
d'une imine par réaction intramoléculaire entre la cétone ainsi formée et la
fonction amine, pour donner le cycle à trois atomes et enfin oxydation de la
fonction alcool primaire sur le carbone C1 suivie d'une estérification de
l'acide obtenu. Remarque : Cette molécule fait partie de la famille des azirines,
molécules dérivées de la 2H-azirine
(ou 1-azirine) hétérocycle (azacyclopropène) très
tendu, très instable et donc très réactif :
C2H3N Masse molaire : 41,0519 g.mol-1 Densité : 1,03 Ebullition : 16,3 °C |
La dysidazirine est une molécule isolée en
1987 d'une éponge marine (Dysidea fragilis) collectée aux îles Fidji (Pacifique sud). Elle possède des propriétés antibiotiques (inhibe le développement des
bactéries Gram (-)). Elle se montre également toxique vis-à-vis de certaines
cellules cancéreuses. Un de ses isomères (Z au niveau de la double liaison C4-C5), a des
propriétés antifongiques. |
|
C6H11ClN4O Masse molaire : 190,631 g.mol-1 |
|
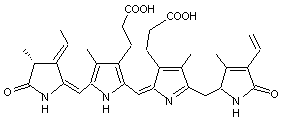
Substance antitumorale extraite de l'éponge calédonienne Pseudaxinyssa cantharella
n.sp. (Axinellidae) à
allure de girolle ; c'est un inhibiteur de la synthèse des protéines. Les essais qui ont été entrepris pour en faire un médicament ont été
abandonnés (effets de la molécule sur le système nerveux central). |
|
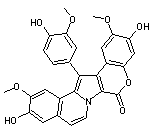
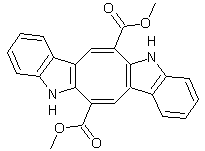
C28H21NO8 Masse molaire : 499,468 g.mol-1 N° CAS : 97614-65-8 |
|
Molécule antitumorale extraite des ascidies, organismes marins. Elle tue les cellules cancéreuses par apoptose (très forte inhibition de
la topoisomérase I ; cet enzyme nucléaire peut couper un brin de l'ADN ; il
est nécessaire lors des étapes de réplication ; si on l'inhibe, la seule
issue est la mort de la cellule). Elle appartient à la famille des lamellarines,
alcaloïdes pyrroliques hexacycliques, d'origine
marine. |
|
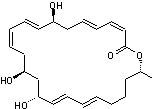
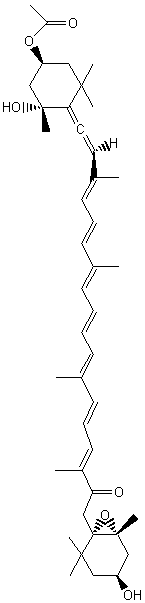
C24H34O5 Masse molaire : 402,524 g.mol-1 |
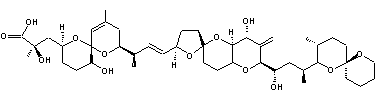
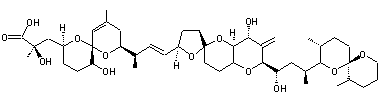
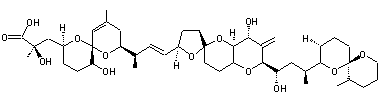
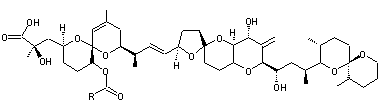
|
Molécule découverte en 1989 par le Professeur William Fenical (Scripps Research
Institute de San Diego) et extraite la première fois d'un micro-organisme des
fonds marins. Cette molécule, la plus abondante des 14 extraites du micro-organisme
est une macrolactone à 24 chaînons avec 3 systèmes
diéniques conjugués dont 2 (Z,E) et 4 carbones
asymétriques oxygénés. C'est un antibiotique à large spectre s'avérant efficace notamment
contre l'entérocoque résistant à la vancomycine (VRE) et le staphylocoque
doré, résistant à la méthicilline (MRSA).On l'obtient à partir de Bacillus polyfermenticus
KJS-2. |
|
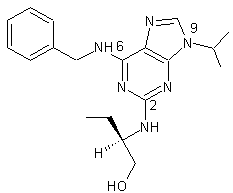
(R)-Roscovitine C19H26N6O Aspect : Poudre blanche Masse molaire : 354,45 g.mol-1 Fusion : 107°C pKa : 4,4 Pouvoir rotatoire : [α]D20 =+56,3° Longueur d'onde d'absorption : λmax = 210 et 292 nm N° CAS : 186692-46-6 Solubilité : Soluble dans le DMSO et le chloroforme. |
|
Cette molécule obtenue à partir d'œufs d'étoiles de mer est un
inhibiteur puissant des kinases cycline-dépendantes (CDK). L'activation de ces CDK est responsable de la transition entre les
différentes phases du cycle cellulaire. Dans certaines tumeurs humaines on a
observé des anomalies de l'expression et de la régulation des CDK. |
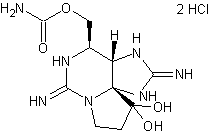
|
C22H24Br2N10O2,
2 HCl Masse molaire : 693,22 g.mol-1 N° CAS : 79703-25-6 |
|
Molécule récoltée sur des éponges du genre Agelas (exemple Agelas sceptrum). C'est un alcaloïde qui montre une activité contre des germes
responsables de maladies nosocomiales tels que Pseudomonas aeruginosa (bacille
pyocyanique) ou Staphylococcus aureus
(staphylocoque doré). |
|
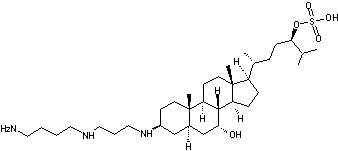
C34H65 N3O5S Masse molaire : 627,969 g.mol-1 N° CAS : 148717-90-2 |
|
Substance trouvée dans le foie d'un petit requin, l'aiguillat ou chien
de mer (Squalus acanthias) et qui constitue un
antibiotique à large spectre. Cette molécule est également un puissant inhibiteur de la
néo-angiogenèse (développement des vaisseaux, facteurs de croissance des
cancers) ; on la teste donc dans plusieurs tumeurs (ovaire, poumon, cerveau
…). On remarquera que cette molécule n'est pas un dérivé du squalène. |
|
ou Yondelis ® C39H43N3O11S Masse molaire : 761,84 g.mol-1 N° CAS : 114899-77-3 |
|
Molécule que l'on trouve dans un invertébré marin des Caraïbes (Ecteinascidia turbinata)
d'où on l'a initialement extraite dans les années 1970. On l'obtient
actuellement par synthèse. Elle est utilisée comme médicament actif sur les sarcomes des tissus
mous (liposarcomes et leiomyosarcomes). |
|
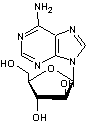
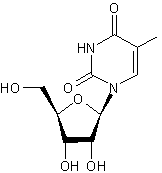
ou β-D-9-Arabinofuranosyladénine C10H15 N5O5 Aspect : Aiguilles (lorsque recristallisé dans l'eau) Masse molaire : 282,257 g.mol-1 Fusion : 257°C N° CAS : 5536-17-4 |
Vidarabine |
Utilisée comme antiviral contre l'herpès. Elle a été découverte en 1984 dans une gorgone. Avant de savoir que cette molécule existait naturellement, des
chimistes l'avaient synthétisée à partir du modèle d'une molécule isolée de
l'éponge des Caraïbes (Cryptotethya crypta). |
|
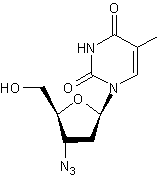
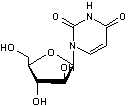
ou AZT ou Rétrovir ® ou C10H13 N5O4 Aspect : Cristaux (lorsque recristallisé dans l'eau) Masse molaire : 267,242 g.mol-1 Fusion : 121°C N° CAS : 30516-87-1 |
Zidovudine
Spongo-uridine ou Spongouridine ou 1-β-D-Ribofuranosyluracile C9H12 N2O6 Aspect : Aiguilles (lorsque recristallisé dans l'éthanol aqueux) Masse molaire : 244,200 g.mol-1 Fusion : 165°C N° CAS : 58-96-8 Solubilité : Soluble dans l'eau, l'éthanol, la pyridine.
Spongothymidine C10H14 N2O6 Masse molaire : 258,22796 g.mol-1 N° CAS : 605-23-2 |
Premier antirétroviral utilisé pour traiter le VIH (SIDA). A été ensuite utilisé dans le cadre de trithérapies en association avec
d'autres molécules. Il agit sur les rétrovirus en inhibant certaines enzymes virales
(transcriptase inverse et ADN polymérase). C'est une molécule qui, au début, a été obtenue en modifiant des
molécules (spongo-uridine et spongothymidine)
découvertes dans l'éponge des caraïbes, Tethya crypta, dans les années 1950 et qui furent les premiers
médicaments d'origine marine. |
|
C107H172N36O32S7C2H4O2 Aspect : Blanc à blanc cassé Masse molaire : 2699,18 g.mol-1 N° CAS : 107452-89-1 |
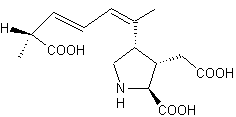
|
C’est une molécule d'origine naturelle, dérivée d’un venin de cône marin
(Conus magus),
un mollusque marin. C’est
un peptide
synthétique de 25 acides aminés. Inhibiteur
sélectif des canaux calciques de type N (voltage-dépendants) situés dans la
moelle épinière. Il
bloque la libération de neurotransmetteurs impliqués dans la transmission de
la douleur (comme la substance P et le glutamate). Il n'agit pas via les récepteurs opioïdes, ce qui évite les effets secondaires typiques des morphiniques (comme la dépression respiratoire ou la dépendance). |
2-2) Quelques toxines :
|
Acide domoïque C15H21 NO6 Masse molaire : 311,3303 g.mol-1 Fusion : 228°C Densité : 1,273 N° CAS : 14277-97-5 Solubilité : Soluble dans l'eau ; légèrement soluble dans le méthanol Risques :
Lorsqu'il est chauffé, il émet des vapeurs toxiques (NOx). |
|
Molécule présente dans certaines algues (par exemple Chondria armata) et
certaines diatomées. C'est une phycotoxine provoquant des intoxications alimentaires,
notamment lors de l'ingestion des fruits de mer qui en contiennent. Pour
l'homme c'est une neurotoxine (dégénerescence
cellulaire dans le cerveau par augmentation incontrôlée du flux calcique)
causant des pertes de mémoire (on la qualifie de toxine amnésiante). |
||||||||||||||||||||||||
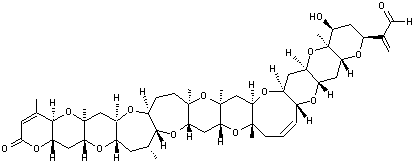
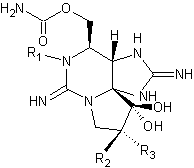
|
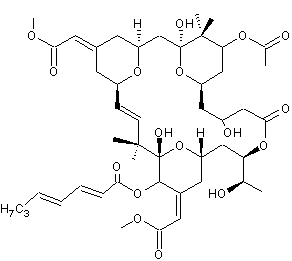
Acide okadaïque C44H68O13 Masse molaire : 805,0029 g.mol-1 N° CAS : 78111-17-8 |
Acide okadaïque
(AO)
Dinophysistoxine-1 (DTX1)
Dinophysistoxine-2 (DTX2)
Dinophysistoxine-3 (DTX3) |
L'acide okadaïque (AO) est une toxine
diarrhéique produite par certaines espèces de phytoplancton (Dinoflagellés du
genre Dinophysis) ; concentrée dans certains coquillages qui filtrent l'eau
de mer ( moules, huîtres, coquilles St Jacques….), cette toxine peut devenir la source
d'intoxications alimentaires qui se traduisent par des diarrhées, nausées,
vomissements et douleurs abdominales, peu de temps après la consommation de
ces bivalves. Cette molécule a été découverte dans une éponge (Halichondria okadai)
d'où son nom. D'autres toxines analogues, DTX1, DTX2, DTX3 (voir formules jointes) sont classées dans le groupe dit des AO. |
||||||||||||||||||||||||
|
|
Un alcaloïde
tétracyclique cytotoxique isolé d’une culture de la bactérie marine Alteromonas sp. associée à une éponge Halichondria okadai. |
|||||||||||||||||||||||||
|
C45H69N5O8S Masse molaire : 840,1243 g.mol-1 N° CAS : 350791-64-9 |
Des
modifications chimiques de la molécule sont en cours pour : ·
Améliorer la sélectivité envers les cellules
cancéreuses ·
Réduire la toxicité pour les cellules saines ·
Faciliter la synthèse et la production à grande
échelle · Explorer de nouveaux modes d’action pour élargir les applications thérapeutiques. |
C’est
un composé naturel, métabolite secondaire de Cyanobactéries marines (ex. Lyngbya majuscula) C’est
un peptide cyclique hybride (cyclodepsipeptide)* On
l’utilise : ·
Comme modèle pour comprendre la régulation de la
translocation des protéines. ·
Comme candidat pour le développement d’agents
anticancéreux ciblés. ·
Comme outil pour bloquer de manière spécifique le
transport de protéines. * Un depsipeptide
est un peptide dans lequel une ou plusieurs liaisons amides ont été
remplacées par des liaisons esters. |
||||||||||||||||||||||||
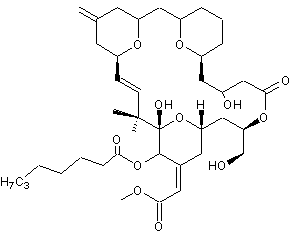
|
C49H68O14 Masse molaire : 881,056 g.mol-1 |
|
Neurotoxine produite par certains dinoflagellés ; elle modifie la
propagation de l'influx nerveux. D'un point de vue chimique c'est un polyéther cyclique. |
||||||||||||||||||||||||
|
ou STX C10H19 Cl2N7O4 Aspect : Solide blanc hygroscopique. Masse molaire : 372,209 g.mol-1 N° CAS : 35554-08-6 Solubilité : Très soluble dans l'eau, l'éthanol, le méthanol. |
Saxitoxine Quelques
toxines paralysantes faisant partie des saxitoxines :
GTX pour gonyautoxine (isolées sur
des microalgues du type Gonyaulax
ou Alexandrium) NEO pour néosaxitoxine. |
Une des puissantes cyanotoxines paralysantes
produites par des dinoflagellés (Alexandrium tamarense, Gymnodium catenatum, Phyrodinium bahamense) mais aussi par des cyanobactéries. |
2-3) Quelques colorants :
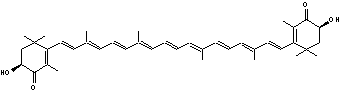
|
Astaxanthine |
|
Caroténoïde. |
|
|
Pigment jaune synthétisé par certaines algues du genre Caulerpa ( Caulerpa
sertularioides, Caulerpa serrulata, Caulerpa biserrulata). C'est un régulateur de croissance chez
les végétaux ; la caulerpine inhibe les phénomènes
de multi-résistance aux xénobiotiques (pesticides
par exemple) chez les végétaux. |
|
|
C16H8Br2N2O2 Ebullition : .486°C N° CAS : 19201-53-7 |
|
Certains gastéropodes marins (pourpres, murex (Bolinus brandaris)) fournissent le
6,6'-dibromoindigo dont les rouges étaient très prisés dans l'Antiquité. On
les trouve sur les côtes, dans presque toutes les parties du monde. Le colorant n'existe pas dans l'animal ; il y a un précurseur – comme
pour les plantes à indigo – et l'union de deux molécules en présence
d'oxygène engendre le colorant à la mort de l'animal. |
|
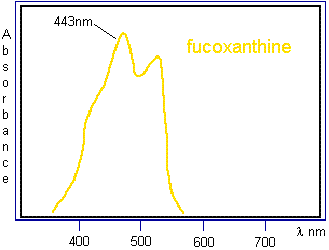
Fucoxanthine |
|
Ce pigment caroténoïde est présent en proportion importante par rapport
à la chlorophylle dans les algues brunes (phéophycées) ainsi que dans les
diatomées (algues unicellulaires munies d'une frustule de silice). Il
contribue à la photosynthèse en absorbant dans le bleu (voir courbe
d'absorption ci-jointe). |
|
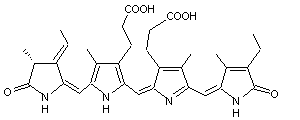
C33H38N4O6 Masse molaire : 586,678 g.mol-1 Ebullition : 892,1°C Densité : 1,315 Indice de réfraction : 1,639 |
|
Cette molécule qui apporte la couleur bleue à certaines algues, est
associée à une protéine formant le pigment appelé phycocyanine. Il est présent dans les cyanobactéries et les algues rouges
(rhodophycées). Avec la chlorophylle il participe à la photosynthèse en
absorbant l'orangé et même un peu le jaune (absorption maximale à 620 et 650
nm). |
|
C33H38N4O6 Masse molaire : 586,678 g.mol-1 Densité : 1,31 N° CAS : 18097-67-1 |
|
Cette molécule qui apporte la couleur rouge à certaines algues est
associée à une protéine formant le pigment appelé phycoérythrine. Il est présent dans les algues rouges (rhodophycées) et les
cyanobactéries. Avec la chlorophylle, il participe à la photosynthèse en
absorbant dans le vert (absorption maximale à 520 nm). |
Parmi les colorants issus d'organismes marins, nous pouvons citer l’encre
de seiche (en grec ancien sepia) contenue
dans une poche particulière aux céphalopodes, qui est composée de la mélanine le pigment
foncé libéré par les mélanosomes (organites secrétés par des cellules de grande
taille, les mélanocytes) et différents aminoacides, la taurine, l’hydroxyproline, l’acide aspartique, l’acide glutamique, l’alanine, la leucine, l’homarine, la glycine bétaïne. La synthèse de la mélanine
ayant lieu à partir de la tyrosine
via la dopa (grâce à la
tyrosinase) et la dopaquinone, il n’est pas
surprenant de trouver aussi tous ces composés dans l’encre de seiche. On trouve
enfin également un peu de TMAO
(oxyde de triméthylamine).
Cette encre très foncée lorsqu’elle sort de la poche de la seiche, pâlit
avec le temps pour donner un brun clair. Elle est utilisée en dessin (dessin à
la sépia) soit directement, soit légèrement diluée. On peut aussi laisser
sécher le liquide sortant de la poche, pour récupérer le pigment solide que
l’on doit dissoudre dans l’eau au moment de l’utilisation. Certains ajoutent un
peu de gomme arabique à cette préparation.
2-4) Diverses autres
molécules :
|
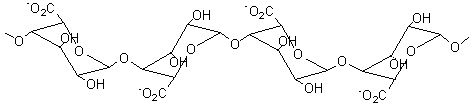
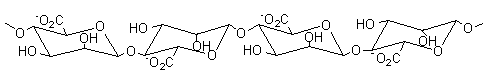
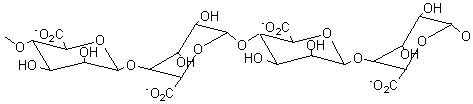
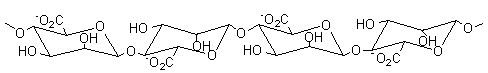
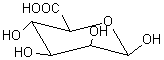
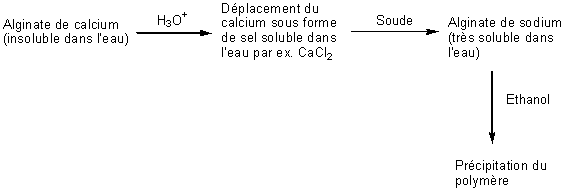
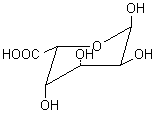
Alginates – Acide alginique |
Nature chimique : Les
alginates sont des copolymères linéaires constitués de deux unités de base,
l'acide α-L-guluronique G (annexe 1), et
l'acide β-D-mannuronique M (annexe1). Le
rapport M/G dépend de l'algue de départ et conditionne les propriétés
physiques, chimiques et mécaniques du polymère. BLOCS GG :
Ces polymères existent dans les algues sous forme de sels de calcium
insolubles dans l'eau. Le schéma du traitement (pour l'extraction) est le
suivant :
Acide α-L-Guluronique
Acide β-D-mannuronique
|
La plupart des algues appartiennent à l'un des trois groupes : Chlorophyceae (algues vertes), Rhodophyceae
(algues rouges), Phaeophyceae (algues
brunes). |
|
ou DMSP C5H10O2S Masse molaire : 134,1967 g.mol-1 N° CAS : 7314-30-9 |
Les cellules phytoplanctoniques présentes dans l’eau des mers et des
océans produisent naturellement du DMSP pour assurer leur homéostasie
(stabilisation de leurs différentes constantes physiologiques). Dans certaines régions des océans se produisent régulièrement des
phénomènes d’upwelling : les eaux profondes riches en substances nutritives
(nutriments) sont brassées et ces substances remontent dans les zones
superficielles euphotiques (la lumière est encore présente) où le
phytoplancton peut réaliser sa photosynthèse. Dans ces zones il se produit
une augmentation importante (nombre et biomasse) du phytoplancton (bloom) ce
qui entraîne selon le processus de cause à effet (le zooplancton étant
prédateur du phytoplancton) une augmentation importante de la biomasse
zooplanctonique. Par voie de conséquence les poissons prédateurs du
zooplancton sont présents en masse également dans ces zones. Les cellules de phytoplancton lorsqu’elles sont consommées par le
zooplancton, sont détruites et libèrent du DMSP transformé (par clivage
enzymatique) en DMS (et acide acrylique) qui est libéré dans la basse
atmosphère. Dans ces zones, certains oiseaux sont attirés par l’odeur du DMS,
car ils « savent » qu’elle est associée à la présence en nombre de poissons
et viennent y chasser. C’est notamment le cas des procellariformes. De même, sous forte luminosité (UV) l’ADN des cellules de phytoplancton
est détruite, les cellules meurent et il y a
libération de DMSP. Le DMSP ainsi produit est transformé en DMS, puis en différents composés
soufrés (dioxyde de soufre, DMSO, acide sulfurique…). Certains de ceux-ci,
libérés dans l’atmosphère constituent des points de cristallisation de
l’humidité et ainsi la formation de nuages s’accélère. La luminosité baisse,
moins de cellules de phytoplancton sont détruites… Le DMSP produit par les cellules de phytoplancton pourrait donc en
limitant l’ensoleillement contribuer à une certaine régulation du climat
global de la planète. |
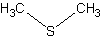
DMSP
Sulfure de diméthyle ou DMS ou méthylthiométhane Substance à odeur forte prenant naissance lors de la cuisson du chou, des
betteraves, des asperges. Diméthylsulfoxyde ou DMSO
Obtenu par oxydation du sulfure de diméthyle
Par oxydation par l'eau oxygénée il donne la diméthylsulfone
Solvant non protique, très polaire, souvent utilisé en chimie organique
dans les réactions de substitution nucléophile (SN). |
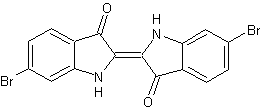
|
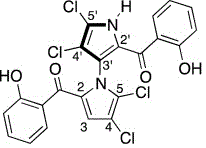
C22H12Cl4 N2O4 Masse molaire : 510,15 g.mol-1 N° CAS : 1227962-62-0 |
|
Molécule utilisée comme outil pour étudier les
mécanismes de la résistance aux thérapies ciblées dans certains cancers. En Biologie cellulaire : Sert à moduler l’expression de
Mcl-1 dans des modèles cellulaires afin d’analyser l’apoptose. C’est un antibactérien potentiel : Des études ont montré
une activité contre des souches de Staphylococcus aureus résistantes à
la méthicilline (MRSA). Son Usage est limité : Pour l’instant, ce composé est
réservé à la recherche scientifique uniquement, et non utilisé en clinique. |
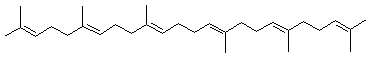
|
C30H50 Aspect : Huile Masse molaire : 410,718 g.mol-1 Fusion : -4,8°C Ebullition : 421,3°C ; 280°C (sous 17 mm de Hg) Densité : 0,8584 (20°C) Indice de réfraction : 1,4990 (à 20°C) N° CAS : 111-02-4 Solubilité : Soluble dans l'éther et l'acétone ; légèrement soluble dans l'éthanol ;
insoluble dans l'eau. |
|
Précurseur métabolique des stérols. C'est un triterpène (ou prénoïde) contenant donc 6
unités isoprène. |