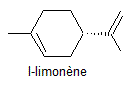R ET S, Z ET E, CIS ET TRANS …de faux
jumeaux
Gérard GOMEZ
Plan de l'étude
1) Isomères
1-1) Définition
1-3) Stéréo-isomérie
2) Différences de propriétés des isomères
3) Des propriétés physiques différentes
3-1) Fusion
3-3) Séparation
des énantiomères
4) Des propriétés organoleptiques différentes
5) Des propriétés chimiques, biochimiques et pharmacologiques
différentes
5-1) Propriétés
chimiques
5-2) En
biochimie
5-3) Propriétés
pharmacologiques
1) Isomères :
1-1) Définition
:
Deux
molécules sont des isomères si elles ont même formule moléculaire et des formules développées, semi-développées, topologiques, ou stéréochimiques différentes.
Ainsi
l'éthanol et le méthoxyméthane ont même formule moléculaire C2H6O,
mais
- la formule topologique de
l'éthanol est :
![]()
- la formule topologique du
méthoxyméthane est :
![]()
Parmi
les isomères on distingue :
v
les isomères de constitution
v
Les stéréo-isomères
On peut
les repérer par la façon dont les atomes sont enchaînés :
Exemple
1 :
|
Butane |
2-méthylpropane
|
Exemple
2 :
|
1-chloropropane
|
2-chloropropane
|
Exemple
3 :
|
Ethanol
|
Ethoxyéthane
|
1-3) Stéréo-isomérie
Les
atomes sont liés entre eux dans le même ordre mais l'arrangement de ces atomes
diffère dans le plan ou dans l'espace
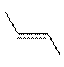
Exemple
1 :
|
E-but-2-ène
|
Z-but-2-ène
|
Exemple
2 :
|
Cis-1,3-diméthylcyclopentane
|
Trans-1,3-diméthylcyclopentane
|
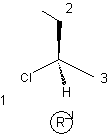
Exemple
3 :
|
2-Chlorobutane
(R)
|
2-Chlorobutane
(S)
|
Il est
utile de rappeler la définition des termes employés pour désigner les
stéréo-isomères dont il va être question dans cette étude. Les règles de Cahn, Ingold,
Prelog sont supposées connues ainsi que la projection de Fischer.
Ø
Les deux stéréo-isomères Z et E
qui peuvent exister quand il y a une liaison éthylénique sont des diastéréo-isomères.
Ø
Pour les cycles on utilise les termes
de cis ou de trans pour désigner les stéréo-isomères ; ce sont aussi des diastéréo-isomères.
Ø
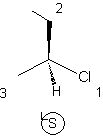
Dans le cas d'un carbone
asymétrique dans une molécule, il existe deux stéréo-isomères R ou S qui
sont des énantiomères. Leur mélange en quantités égales constitue un
mélange racémique.
Ø
S'il existe plusieurs carbones
asymétriques (n) il y a 2n stéréo-isomères. Pour n=2 donc 2 carbones
asymétriques, il y a 4 stéréo-isomères : R,R ; R,S ; S,R ; S,S.
- Les stéréo-isomères R,R ; S,S
constituent un couple d' énantiomères.
- Les stéréo-isomères R,S ; S,R
constituent un couple d' énantiomères.
- Tous les autres couples possibles
(par exemple R,R et R,S ou R,R et S,R…) sont des diastéréo-isomères.
Si on mélange en quantités
égales les deux constituants d'un couple d'énantiomères on obtient un
mélange racémique.
Ø
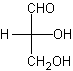
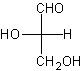
Rappelons enfin que pour des familles
importantes en biochimie (oses, aminoacides …), on continue à utiliser les
notations L et D pour différencier des stéréo-isomères. En projection de
Fischer, par exemple, on distingue le D et le L-glycéraldéhyde :
|
D-glycéraldéhyde ou (R)-glycéraldéhyde
|
L-glycéraldéhyde ou (S)-glycéraldéhyde
|
Pour les acides
aminés habituels sauf la cystéine, on peut dire qu'à la configuration D
correspond le composé (R) et qu'à la configuration L correspond le composé (S)
; rappelons aussi qu'on ne peut pas déduire le sens du pouvoir rotatoire (+)
dextrogyre, (-) lévogyre de la mention D, L, (R) ou (S). Exemple : la
D-alanine est lévogyre ; sa désignation plus précise est D-(-)-alanine.
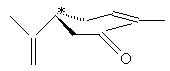
2) Différences de propriétés des isomères:
On va
s'intéresser aux stéréo-isomères ; ils naissent parfois ensemble au cours d'une
réaction ; on pourrait les croire jumeaux .Pourtant, leur différence de
structure dans l'espace entraîne souvent des différences de propriétés
physiques, chimiques et parfois même organoleptiques.
Remarque : Ceci n'est pas
vérifié pour les couples d'énantiomères qui ont souvent les mêmes propriétés
physiques (température de fusion, point d'ébullition, masse volumique, indice
de réfraction, solubilité…. Mais bien sûr des pouvoirs rotatoires opposés) et
les mêmes propriétés chimiques à l'exception parfois des réactions avec une
autre molécule chirale.
Ainsi à
20°C le cis-but-2-ène-1,4-diol est liquide (température de fusion 2,0°C),
tandis que le trans-but-2-ène-1,4-diol est solide (température de fusion 25°C)
(annexe 1).
|
Z-but-2-ène-1,4-diol
|
E-but-2-ène-1,4-diol
|
De
même, le Z-But-2-ène a une température de fusion de -139°C tandis qu'elle est
de -106°C pour le E-But-2-ène .
Ainsi,
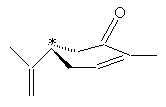
aussi, parmi les huit stéréo-isomères de la nootkatone (voir
annexe 2) seul celui représenté ci-après a l'odeur du pamplemousse :
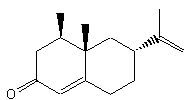
Ainsi, enfin,
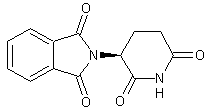
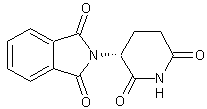
seul l'isomère (S,S)-(+)de l'éthambutol (voir annexe 3), à propriétés antibiotiques, bactériostatiques et
antimycobactériennes, est utilisé contre la tuberculose mycobactérienne. Les
deux autres stéréo-isomères((R,R)-(-) et (R,S) composé méso) sont toxiques pour
l'organisme.
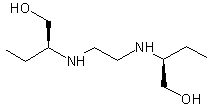
Ethambutol
isomère (S,S).
3) Des propriétés physiques
différentes
3-1)
Fusion - Ebullition :
v Fusion :
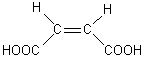
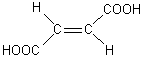
Prenons l'exemple de l'acide maléique et l'acide
fumarique qui sont respectivement les acides (Z)-but-2-ène-1,4-dioïque et (E)-
but-2-ène-1,4-dioïque
|
Acide maléique
|
Acide fumarique |
Ces deux substances sont solides à température
ambiante.
Un solide formé de molécules fond d'autant plus
difficilement que les liaisons entre les molécules (liaisons intermoléculaires)
sont nombreuses et solides.
Ces acides donnent lieu à des liaisons hydrogènes
entre l'hydrogène d'un groupement carboxyle et l'oxygène doublement lié au
carbone d'un autre groupement carboxyle :
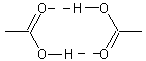
Dans le cas de l'acide maléique, les deux
groupements carboxyles d'une même molécule sont favorablement situés dans
l'espace pour pouvoir ainsi se lier ; il s'agit de liaisons intramoléculaires
qui ne contribuent donc pas à l'élévation du point de fusion :
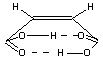
Pour l'acide fumarique, les groupements carboxyles sont
trop éloignés et ne peuvent donner lieu à des liaisons intramoléculaires.
Toutes les liaisons sont donc intermoléculaires :
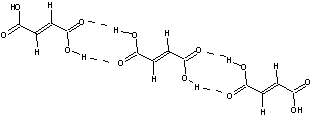
Il y a tout lieu de penser dans ces conditions que
l'acide fumarique fond à température plus élevée que l'acide maléique. La
littérature indique que l'acide fumarique fond à 287°C (en tube scellé car à
l'air libre il se décompose) alors que l'acide maléique fond à 130°C (point de
fusion théorique).
v Ebullition :
Le
Z-1,2-dichloroéthène a une température
d'ébullition de 60°C, tandis que le E-1,2-dichloroéthène bout à 48°C .
Z-1,2-dichloroéthène E-1,2-dichloroéthène
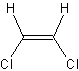
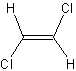
Pour comprendre cette différence il faut examiner
les moments dipolaires de ces deux molécules ; ils résultent de la somme géométrique des moments
dipolaires μ1 et μ2 de chacune des liaisons
C-Cl.
-
Pour l'isomère E ce moment est nul car μ1 et μ2 sont opposés :
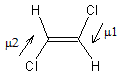
- Pour
l'isomère Z il n'est pas nul :
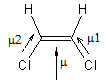
Les attractions électrostatiques entre molécules
seront donc plus nombreuses dans le Z-1,2-dichloroéthène composé polaire que
dans le composé E globalement apolaire ; il faut plus d'énergie pour les
dissocier et on comprend alors pourquoi
le composé Z a une température d'ébullition plus élevée que le composé
E.
3-2)
Solubilité dans l'eau :
L'eau est
un solvant polaire ; l'électronégativité de l'oxygène plus importante que celle
de l'hydrogène entraîne une polarisation de la liaison O-H comme l'indique la
représentation ci-dessous :
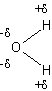
La molécule
n'étant pas linéaire, elle possède un moment dipolaire global μ résultant
de la somme géométrique des moments dipolaires μ1 et μ2
de chacune des liaisons :
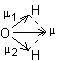
L'eau
est un bon solvant des molécules polaires, par exemple l'éthanol, et un mauvais
solvant des molécules apolaires, par exemple l'éthane ; cela est dû au fait que
l'eau peut établir des liaisons de nature électrostatique avec les molécules
polaires et qu'elle ne le peut pas avec des molécules apolaires.
On
prend à nouveau comme molécules d'étude, l'acide maléique et l'acide fumarique.
Leur
caractère polaire est différent, car bien que les deux groupements carboxyles
des molécules soient des groupements polaires et qu'ils existent dans les deux
molécules, ils ne contribuent pas de la même façon à la polarité globale
compte-tenu de leurs positions relatives différentes dans les deux cas.
- Pour l'acide maléique :
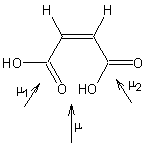
La
molécule est polaire (moment dipolaire global µ).
- Pour l'acide fumarique :
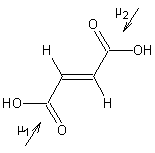
La
molécule est apolaire (moment dipolaire global 0) ; en effet les deux moments
dipolaires µ1 et µ2 sont opposés, leur somme géométrique
est nulle.
En
conséquence on doit s'attendre à une bonne solubilité de l'acide maléique dans
l'eau et au contraire à une faible solubilité pour l'acide fumarique ; c'est
effectivement ce qu'on constate, la solubilité de l'acide maléique est 780 g.L-1
à 25°C alors que l'acide fumarique n'est soluble qu'à 6,3 g.L-1 à la
même température.
3-3) Séparation
des énantiomères :
On
utilise parfois la différence de propriétés physiques des diastéréo-isomères
pour séparer les énantiomères :
Principe :
- Soit deux stéréo-isomères R et S
mélangés en quantités égales ; désignons le mélange racémique par R ; S.
Il est impossible de les séparer par
des méthodes physiques simples (cristallisation fractionnée…) car ils possèdent
les mêmes propriétés physiques.
- On fait réagir ce mélange avec un
des stéréo-isomères d'une molécule chirale que nous désignerons par R'. Il se
forme alors un mélange : RR' ; SR'.
- Il s'agit d'un mélange de deux
diastéréo-isomères que l'on peut séparer par cristallisation fractionnée par
exemple puisque leurs propriétés physiques sont différentes ; on obtient donc
RR' + SR'.
- Par une réaction chimique
appropriée on passe de RR' à R+R' et de SR' à S+R'.
- On purifie R+R' et on obtient R
pur en récupérant R' ; de la même façon on obtient S pur en récupérant R'.
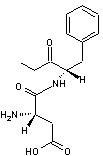
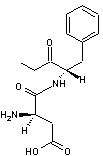
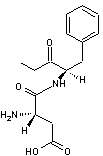
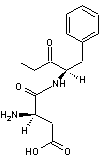
Exemple : On peut par
exemple séparer les énantiomères de l'acide lactique racémique CH3-CHOH-COOH
en utilisant la phényléthanamine C6H5-CH(NH2)-CH3
de configuration (S). Une réaction acido-basique entre le groupement –COOH de
l'acide lactique et le groupe –NH2 de la phényléthanamine conduit à
deux sels d'ammonium diastéréo-isomères que l'on peut séparer facilement par
cristallisation fractionnée ; par hydrolyse acide, on peut ensuite récupérer
les énantiomères de l'acide lactique et régénérer l'amine qui pourra être
réutilisée.
4) Des propriétés organoleptiques différentes :
Il
semble acquis que l'odeur, par exemple, résulte du signal qu'une terminaison
nerveuse de l'épithélium de la cavité nasale envoie au cerveau après qu'une
molécule se soit fixée sur une protéine de ce récepteur.
L'interaction
entre la molécule et la protéine se faisant suivant un mécanisme clé-serrure :
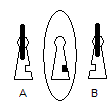
Seule
la clé A (molécule A) s'adaptera à la serrure (la protéine du récepteur) ; la
clé B (molécule B) symétrique de A ne pourra y pénétrer.
On peut
alors comprendre pourquoi l'un des stéréo-isomères de la carvone (annexe 4), (la R(-)carvone) a une odeur de menthe :
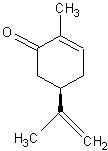
alors
que son image dans un miroir (la S(+) carvone) a une odeur d'aneth ou de carvi
:
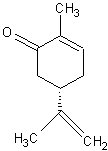
Chacun
des deux stéréo-isomères s'adapte à une "serrure" qui n'ouvrira pas
la même "porte" dans le champ des odeurs.
Les cas
des cinq molécules suivantes sont également intéressants dans ce domaine :
Asparagine – Aspartame – Citral – Glutamate monosodique – Limonène -
|
Asparagine stéréo-isomère (S)
Goût
légèrement amer On
trouve cet aminoacide dans les jeunes pousses d'asperges. |
Asparagine stéréo-isomère (R)
Goût
sucré C'est
un produit synthétique. |
|
Aspartame stéréo-isomère (S,S)
Goût
sucré beaucoup plus prononcé que le saccharose. |
Les
trois autres stéréo-isomères ont un goût sucré beaucoup moins prononcé.
|
|
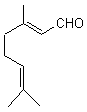
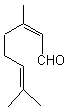
(E)-Citral
géranial
Molécule
à odeur de citron très prononcée. On la
rencontre dans les huiles essentielles de citron, de verveine et de
citronnelle. |
(Z)-Citral néral
Molécule
à odeur de citron très discrète. On la
rencontre dans les huiles essentielles de citron, de verveine et de
citronnelle. |
|
L-
Glutamate monosodique stéréo-isomère (S) ou GMS
Exhausteur
de goût pour les aliments carnés. Classé
comme additif alimentaire avec le code E621. L'acide
glutamique est un aminoacide naturel non essentiel. Il est donc normal de le
retrouver dans une viande vieillie (il se forme par décomposition des
protéines). On le
prépare industriellement par fermentation ; on utilise des souches
bactériennes (Micrococcus, Brevibacterium …) dans un milieu
riche en ammoniac. |
D-
Glutamate monosodique stéréo-isomère (R)
Ce
stéréoisomère n'est pas un exhausteur de goût. |
|
Limonène stéréo-isomère (S)
C'est
l'isomère lévogyre plutôt à odeur de citron. |
Limonène stéréo-isomère (R)
C'est
l'isomère dextrogyre plutôt à odeur d'orange. |
5) Des propriétés chimiques, biochimiques et pharmacologiques
différentes :
5-1) Propriétés
chimiques :
- Exemple 1 :
En
chauffant une molécule d'acide maléique, une déshydratation intramoléculaire a
lieu, donnant naissance à un anhydride d'acide :
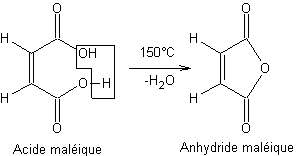
Rien de
tel ne se produit avec l'acide fumarique.
C'est
la proximité géométrique des deux groupements carboxyles qui facilite cette
réaction.
- Exemple 2 :
Une
réaction stéréospécifique appliquée à deux diastéréo-isomères aboutit à des
produits différents.
Prenons
l'exemple de l'addition électrophile de Br2 sur un alcène. C'est une
addition anti. On donne ci-dessous le mécanisme de la réaction :
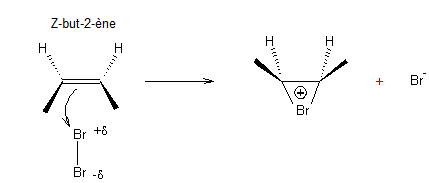
puis

Les
deux attaques par l'ion Br- ayant la même probabilité de se
produire, on obtient les deux énantiomères en quantité égale c'est-à-dire le
mélange racémique.
En
partant de l'isomère (E) on aboutit aux stéréo-isomères (2S,3R) et (2R,3S)
c'est-à-dire, ici, à la même molécule, le composé méso.
5-2) En
biochimie :
Les
enzymes tiennent une large place dans les réactions en biochimie et on observe
souvent une stéréospécificité de ceux-ci vis-à-vis des substrats ; par exemple,
la L-aminoacide-déshydrogénase, n'agit que sur les aminoacides de la série L et
n'agit ni sur les D-aminoacides, ni sur la glycine.
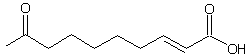
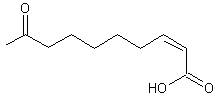
Un
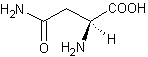
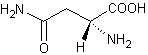
autre exemple est l'action de la fumarase qui catalyse l'hydratation de l'acide
fumarique en acide L-malique (stéréo-isomère (S)) (annexe 5)
alors qu'aucune réaction n'a lieu avec l'acide maléique.
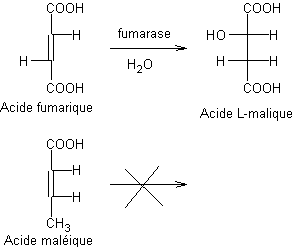
Les
molécules suivantes constituent quatre autres exemples :
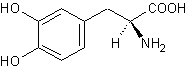
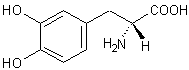
|
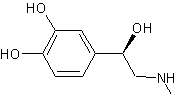
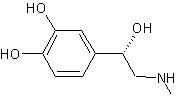
ou (S)-3,4-Dihydroxyphénylalanine
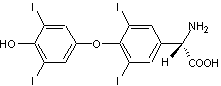
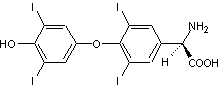
Dans
le cerveau, seule la lévodopa a une activité biologique ; elle est le
précurseur dans l’organisme des neurotransmetteurs : dopamine, norépinéphrine
(noradrénaline) et épinéphrine
(adrénaline) collectivement nommés catécholamines : |
Son
énantiomère, la (R)-3,4- Dihydroxyphénylalanine est, elle, toxique.
|
|
ou 9-Oda
Phéromone extraite de la substance royale des abeilles. Cette molécule produite par les glandes mandibulaires de la reine,
attire les mâles, favorise l'accouplement et en association avec d'autres
sécrétions inhibe le développementdes ovaires des ouvrières. Cette phéromone fait partie des QMP : Queen Mandibular Pheromon. |
Acide
(Z) 9-oxodéc-2-ènoïque
Ne
présente aucune activité de phéromone. |
|
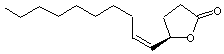
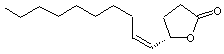
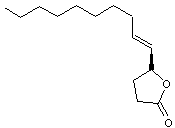
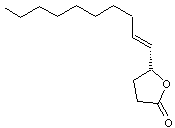
Phéromone
sexuelle du scarabée japonais (popillia japonica). Des
traces (par exemple 5µg) sont aussi efficaces que 4 femelles vierges pour
attirer un mâle. |
Autres
stéréo-isomères de cette molécule :
Ces
molécules n'ont pas la propriété d'une phéromone. |
|
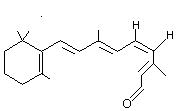
ou 11-(Z)-Rétinal
En se
nichant dans une cavité d'une protéine, l'opsine (du grec ôps vue), le
rétinal cis réagit avec un site aminé de l'opsine pour donner une imine la rhodopsine
qui constitue la partie photosensible de la rétine. Lorsqu'un photon atteint
la rhodopsine, il y a isomérisation immédiate de la partie rétinal cis en
rétinal trans qui s'emboîte beaucoup moins bien dans la cavité de la
protéine. Il s'ensuit une séquence de transformations qui engendre un influx
nerveux que nous percevons sous forme de lumière. |
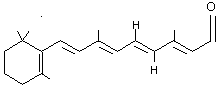
Rétinal
trans ou 11-(E)-Rétinal
Molécule
présente dans les cellules photosensibles de l'oeil humain. S'isomérise en
rétinal cis, grâce à la rétinal isomérase et participe ainsi au mécanisme de
perception de la lumière (voir rétinal cis). Est
obtenu par oxydation du carotène. Sa
réduction donne la vitamine
A. |
|
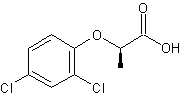
Acide
(R)-2-(2,4-dichlorophénoxy)-propanoïque ou (R)-2,4-DP ou Dichlorprop
C'est
un herbicide appartenant à la famille des acides phénoxyalcanoïques comme le 2,4-D ou le 2,4,5-T. La
molécule possède un carbone asymétrique et il existe donc deux
stéréo-isomères mais seul l'isomère (R) et ses dérivés ont des propriétés
herbicides. Il
est interdit en France depuis 2003. |
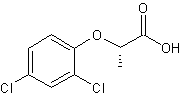
Acide
(S)-2-(2,4-dichlorophénoxy)-propanoïque
Ne
possède pas de propriétés herbicides. |
5-3) Propriétés
pharmacologiques :
Il est
courant de rencontrer des médicaments dont la molécule active présente des
stéréo-isomères aux propriétés médicamenteuses différentes.
Souvent
l'un des isomères est actif sur une maladie et l'autre inactif ou parfois
beaucoup plus faiblement actif.
C'est
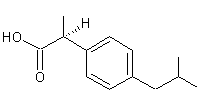
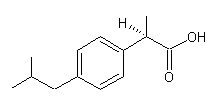
le cas par exemple de l'ibuprofène dont le stéréo-isomère (S) est
anti-inflammatoire et dont le composé (R) est très faiblement actif.
|
(S)-Ibuprofène
|
(R)-Ibuprofène
|
Définition : Celui des deux
énantiomères qui est actif et donc retenu comme médicament est appelé l'eutomère ; l'autre est le distomère.
Parfois
cependant, l'un des isomères soigne et l'autre est toxique ; le thalidomide est
resté dramatiquement célèbre dans ce domaine ; le (R)-(+)-thalidomide a des
propriétés analgésiques et antinauséeuses tandis que le (S)-(-)- thalidomide
est tératogène. Administré à des femmes enceintes dans les années 1950-1960, le
racémique a entraîné du fait de la présence du stéréo-isomère (S) des
malformations graves :
|
(S)-Thalidomide Effets
tératogènes
|
(R)-Thalidomide Propriétés
analgésiques
|
Des
études ont cependant montré que le stéréo-isomère (R) subissait dans
l'organisme une racémisation et que l'administration de l'isomère (R) pur
n'aurait pas évité la catastrophe.
On
explique les différences de propriétés biochimiques et pharmacologiques comme
on a expliqué les différences de propriétés organoleptiques, par des mécanismes
du type clé-serrure, l'un des isomères s'adaptant à la protéine d'un récepteur
et l'autre pas.
Près de
75% des médicaments mis sur le marché aujourd'hui correspondent à un
stéréo-isomère seul.
Les
cinq molécules qui suivent illustrent aussi les différences de propriétés entre
des stéréo-isomères :
Adrénaline – Cétirizine - Propranolol – Quinine – Lévothyroxine -
|
D-Adrénaline Ou Epinéphrine (R)-(-)
Molécule
utilisée à des fins médicales, dans le traitement des arrêts
cardio-circulatoires en cas d'asystolie. |
L-Adrénaline Ou Epinéphrine
(S)-(+)
Molécule
toxique pour l'organisme. |
|
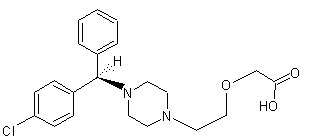
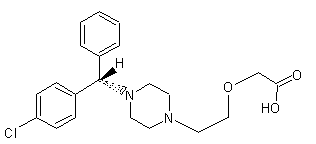
Cétirizine stéréo-isomère
(R)-(-) ou Lévocétirizine
Appartient
à la famille des pipérazines. Antiallergique
de la classe des antihistaminiques H1 (neutralise l’action de l’histamine au
niveau de ses récepteurs H1) ; indiqué dans le traitement symptomatique
des rhinites et /ou conjonctivites allergiques saisonnières ou non, ainsi que
l’urticaire aigu localisé. Pour adulte et enfant de plus de douze ans
(Activix®, Réactine®, Zyrtecset®). La
lévocétirizine est un eutomère c’est-à-dire le plus actif dans la maladie
traitée (le moins actif étant le distomère). Parfois
les laboratoires, lorsqu’un médicament est le racémique et arrive en fin de
brevet pratiquent le « chiral switching » c’est-à dire qu’ils
mettent sur le marché l’eutomère au lieu du racémique sous un autre nom. Ainsi
la cétirizine racémique (zyrtec) arrivant en fin de brevet a été remplacée
par l’eutomère, la lévocétirizine (Xyzal). |
Cétirizine stéréo-isomère
(S)-(+) ou dextrocétirizine
C'est
le distomère du médicament que constitue la cétirizine racémique (zyrtec). |
|
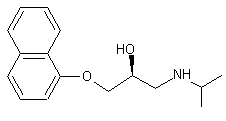
Propranolol (S)-(-)
Molécule
utilisée comme β-bloquant non sélectif en cardiologie. C'est un des
premiers mis au point. |
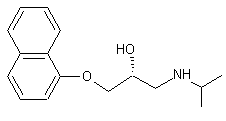
Propranolol
(R)-(+)
Molécule
agissant comme contraceptif masculin. |
|
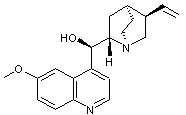
C'est
un agent antimalarique (antipaludéen) |
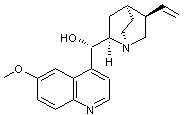
Molécule
qui a été utilisée en cardiologie comme agent antiarythmique. Comme la
quinine on peut l'extraire de l'écorce du quinquina. On
peut la fabriquer par hémisynthèse à partir de la quinine. |
|
Lévothyroxine
(S)
Médicament
contre l'hypothyroïdie |
Dextrothyroxine
(R)
Médicament
contre l'hypercholestérolémie |
|
(Z)-but-2-ène-1,4-diol
C4H8O2 Masse
molaire
: 88,106
g.mol-1 Fusion : 2,0°C Ebullition : 235°C Densité : 1,0698
(à 20°C) Indice
de réfraction
: 1,4782
(à 20°C) Solubilité : Très
soluble dans l'éthanol ; soluble dans l'eau. N°
CAS
: 6117-80-2 |
(E)-but-2-ène-1,4-diol
C4H8O2 Masse
molaire
: 88,106
g.mol-1 Fusion : 25°C Ebullition : 131°C
(sous 13 mm de Hg) Densité : 1,0700
(à 20°C) Indice
de réfraction
: 1,4755
(à 20°C) Solubilité : Très
soluble dans l'éthanol et dans l'eau. N°
CAS
: 821-11-4 |
La
nootkatone possède 3 carbones asymétriques donc 8 stéréo-isomères. Les carbones
asymétriques du stéréo-isomère ayant l'odeur du pamplemousse ont la
configuration suivante :
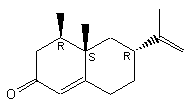
C'est
une cétone sesquiterpénique.
Cette molécule a été isolée pour la première fois du bois de cèdre d'Alaska
puis plus tard de la pulpe de pamplemousse et d'autres agrumes. Sa structure a
été déterminée en 1965 et sa synthèse totale a dès lors fait l'objet de
nombreuses recherches en raison de son utilisation dans l'industrie des
parfums.
C'est
une matière première très coûteuse (le prix est aux alentours de 100 euros le
gramme ; à titre de comparaison 1g de limonène coûte environ 0,035 euro).
- Citrus grandis (Pamplemoussier)
famille des rutacées.
- Cupressus
nootkatensis (Cèdre
de l'Alaska). Le nom nootkatensis vient de l'île de Nootka proche de l'île
de Vancouver ou cet arbre a été découvert en 1793.
|
Ethambutol (Isomère (S,S)-(+))
C10H24N2O2 Aspect : Cristaux
blancs. Masse
molaire : 204,310
g.mol-1 Fusion : 89°C Solubilité : Légèrement
soluble dans l'eau ; soluble dans le benzène et le chloroforme. N° CAS |
Ethambutol
(R,R)-(-)
Ethambutol
(R,S) composé méso.
|
Annexe 4 La carvone
|
Carvone lévogyre ou R(-) Carvone ou (R) p-mentha-1,8-dièn-6-one C10H14O Masse molaire: N° CAS : 6485-40-1 Solubilité : Très soluble dans
l’éthanol ; soluble dans l’éther et le chloroforme ; légèrement soluble dans
l’eau. Carvone dextrogyre S(+) Carvone ou (S) p-mentha-1,8-dièn-6-one C10H14O Masse molaire: N° CAS : 2244-16-8 Solubilité : Très soluble dans
l’éthanol ; soluble dans l’éther et le chloroforme ; légèrement soluble dans
l’eau. |
ou
R(-) Carvone
ou
S(+) Carvone |
La R(-) carvone est présente dans
l'huile essentielle de menthe verte Mentha
sp. ; elle en possède l'odeur. La S(+) Carvone à odeur de carvi existe
notamment dans les huiles essentielles de
|
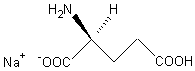
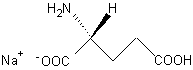
Acide malique
ou
Acide hydroxysuccinique.
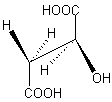
Le stéréoisomère S (-) représenté ci-dessus,
optiquement actif, est utilisé à la séparation des énantiomères
basiques.
Masse molaire :
134,09 g.mol-1
Fusion :
101-103°C
Pouvoir rotatoire :
[a]= -27°