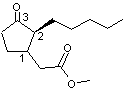
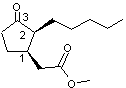
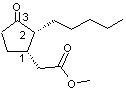
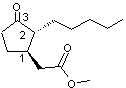
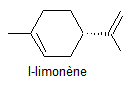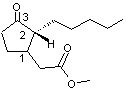PARFUMS
Gérard
GOMEZ
Plan de l'étude :
1) Le parfum
2) L'odorat en quelques chiffres – Les familles de parfums
2-1) Quelques
chiffres
2-2) Familles
de parfums
4) Les techniques d'extraction
4-1) L'enfleurage
4-2) L'extraction
par macération
4-3) L'extraction
au dioxyde de carbone supercritique
4-4) L'entraînement
à la vapeur d'eau
4-5) L'expression
4-6) L'incision
5) Quelques molécules odorantes
5-1) Les
terpènes et les terpénoïdes
5-2) Les
composés aromatiques et notamment phénoliques
5-3) D'autres
molécules odorantes
6) D'autres molécules dans les parfums
6-1) Les fixatifs
6-2) Ambres
et muscs
7) Les
présentations des parfums dans le commerce
8) Les parfums des produits de nettoyage
1) Le
parfum : art et
chimie
De nombreux parfums sont élaborés chaque jour
dans le monde ; rares sont ceux qui accèderont au statut de très grand parfum ;
quelques-uns par siècle seulement. Ce sont alors des œuvres d'art, grisantes
effluves, légères, évanescentes, presque immatérielles, mélanges subtils de
dizaines de molécules odorantes.
Est-il raisonnable de chercher à expliquer la
sensualité de "Shalimar" de Guerlain
ou la volupté de "N°5" de Chanel en établissant
leur composition chimique ? Pas plus que de tenter de découvrir pourquoi
l'écoute d'une symphonie de Mahler ou d'un concerto de Beethoven nous fait
vibrer, en examinant leur partition.
Le parfumeur est un compositeur ; devant son
orgue à parfums, multitude de petits flacons enveloppant les senteurs de base,
il joue avec les notes, les rapproche, les unit, les renforce ou les assouplit
au gré de sa sensibilité, pour atteindre un ensemble qui évoluant en trois
temps, dévoile peu à peu des trésors olfactifs.
Le chimiste n'est pas loin ; sans cesse il tente
de repérer dans les fleurs, les fruits, les feuilles, les écorces, les racines,
pour ne parler que des végétaux, des principes qu'il extrait par différentes
techniques, à chaud, à froid, avec de l'eau ou des solvants et qui viendront
enrichir la palette des senteurs nouvelles. Il synthétise aussi un grand nombre
de molécules ; cinq pour cent seulement des senteurs des parfums sont dues de
nos jours à des molécules extraites de produits naturels.
2) L'odorat en quelques chiffres – Les familles
de parfums:
2-1) Quelques chiffres :
La muqueuse nasale contient entre cinq et huit
millions de récepteurs olfactifs (répartis en 400 types environ, certains
spécifiques à une molécule odorante d'autres compatibles avec plusieurs d'entre
elles (CNRS article de Léa Galanopoulo du 14 mai 2018)) répartis sur une surface
d'environ six centimètres carrés. Quinze mille fibres nerveuses envoient les
informations jusqu'au cortex. Un homme peut distinguer jusqu'à dix mille odeurs
(une étude publiée dans Science en 2014 suggère que ce sont au moins
1000 milliards d'odeurs que l'on peut distinguer).
C'est dans le néocortex que s'élabore la
sensation consciente des odeurs. Parallèlement à ces informations conscientes,
les informations atteignant l'amygdale sont ensuite transmises à l'hypothalamus
et au mésencéphale. Ce sont ces voies du système limbique qui sont à l'origine
de la composante affective des odeurs. L'hippocampe, quant à lui, reconnaît et
classe les odeurs en catégories.
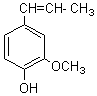
L'odeur est liée à la structure chimique de la
molécule et en particulier à la présence de groupements osmophores (-OH,
CHO, -O-CH3, -NO2…..). Mais les choses ne sont pas
simples, car un même groupe osmophore dans
différentes molécules n'entraîne pas forcément la même odeur ; par exemple le linalol :
a une odeur de muguet,
tandis que le géraniol :
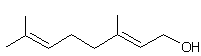
a une
odeur de rose.
La
place du groupement osmophore dans la molécule ainsi
que la présence de doubles ou de triples liaisons et leur place dans la
molécule semblent avoir une influence sur l'odeur du composé ; c'est ce que
l'on peut remarquer dans l'exemple précédent du linalol et du géraniol.
La
présence d'un cycle aussi semble avoir une importance, de même que la forme le
volume de la molécule c'est-à dire d'une façon générale les facteurs
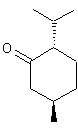
géométriques ou spatiaux ; ainsi la R(-)-Carvone :
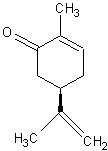
a une odeur de menthe
verte, alors que la S(+)-Carvone :
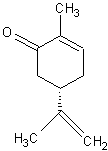
a une
odeur de cumin.
Deux
molécules peuvent avoir la même odeur sans avoir le même groupe osmophore ; c'est le cas par exemple
de
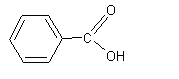
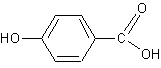
l'aldéhyde benzoïque 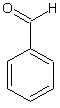 et du nitrobenzène
et du nitrobenzène 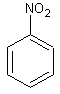 qui ont
toutes deux l'odeur d'amande amère.
qui ont
toutes deux l'odeur d'amande amère.
Certaines
études réfutent cette notion de groupe osmophore et
se contentent de dire que pour qu'une substance possède des propriétés
odorantes, il faut qu'elle ait un poids moléculaire modéré, une polarité
faible, une certaine solubilité dans l'eau une pression de vapeur et un
caractère lipophile élevés. (De la
molécule à l'odeur – Les bases moléculaires des premières étapes de l'olfaction
–Uwe J. Meierhenrich, Jérôme Golebiowski,
Xavier Fernandez et Daniel Cabrol-Bass).
2-2) Familles de parfums :
On a l'habitude de
classer les parfums en familles qui regroupent des senteurs analogues :
Ø Ambrés : Notes douces, poudrées ou vanillées. "Shalimar" de
Guerlain appartient à ce type.
Ø
Boisés : Quatre notes principales, patchouli, santal,
bois de cèdre, vétiver.
Ø
Chypres : Notes de mousse de chêne, ciste, patchouli.
"Femme" de Rochas en est un exemple.
Ø
Cuir : rares ; senteurs âcres : essences de cade, de
styrax, d'encens… Citons "cuir de Russie" de Chanel.
Ø
Floraux : Ce sont les parfums les plus nombreux ; les
notes florales dominent. "Air du temps" de Nina Ricci ou
"N°5" de Chanel.
Ø
Fougères : ne correspondent pas à l'odeur des fougères
(Ce nom vient de la création "fougère royale" par Paul Parquet de
chez Houbigant en 1882 qui a introduit pour la
première fois de la coumarine (10%) dans un parfum) mais à un mélange de notes
de lavandes, boisées, coumarinées. C'est par exemple
"Jicky" de Guerlain ou "Azzaro"
pour hommes en 1978.
Ø
Hespéridées : La plupart des eaux de Cologne correspondent à cette famille ;
c'est un mélange d'huiles essentielles d'agrumes. "Eau sauvage" de
Christian Dior ou "Eau" de Guerlain.
Ø Marine : note récente, parfums "frais" (calone).
3) Le langage du parfumeur :
Il est différent de
celui du chimiste ; il est nécessaire pour le comprendre de connaître quelques
définitions :
Ø
Concrètes : C'est le résultat de l'extraction des
molécules odorantes des fleurs par des solvants volatils (macération).
Ø Absolues : Elles sont obtenues à partir des concrètes que l'on concentre
d'abord puis que l'on traite par l'éthanol ; les molécules odorantes se
dissolvent alors dans l'éthanol.
Ø Enfleurage : c'est une technique d'extraction directe des molécules
odorantes des fleurs par un corps gras (voir plus loin les détails de la technique) ;
elle est de nos jours presque complètement abandonnée.
Ø Absolue de pommade : Elles sont obtenues à partir des produits de
l'enfleurage. Les corps gras résultant de l'enfleurage sont traités par
l'éthanol pour en extraire les molécules odorantes ; puis on évapore celui-ci
pour obtenir une pommade où les senteurs sont concentrées. Ce produit est très
coûteux.
Ø Huiles essentielles (souvent abrégées en H.E.) ou essences :
Obtenues à partir de la peau de certains végétaux par pression ou par entraînement
à la vapeur d'eau.
Ø Hydrolat aromatique (H.A.) ou eau florale : C'est l'eau qui
accompagne les huiles essentielles dans l'entraînement à la vapeur d'eau. Elle
se charge plus ou moins de senteurs (environ cinq pour cent en moyenne) selon
la solubilité des molécules odorantes entraînées.
Ø Résinoïdes : Ils résultent de l'extraction par des solvants (macération) des
résines, baumes, gommes de certains arbres.
Ø Nez : C'est le parfumeur….Capable de mémoriser plus de mille odeurs,
il est le créateur d'un parfum…..Spécialité très recherchée dans l'industrie
des cosmétiques !
Ø Note de tête : Un parfum se développe en trois temps ; la note de tête est la
première impression qu'il laisse à la sortie du flacon juste après son contact
avec la peau ; elle dure quelques secondes et correspond à des molécules issues
de fruits (orange, mandarine, citron, bergamote…) de fleurs ou de feuilles
(mimosa, laurier, néroli…) ou d'aromates (lavande, citronnelle…).
Ø Note de cœur : perçue pendant environ quatre heures après la disparition de la
note de tête. Elle est constituée de senteurs fruitées (pêche, framboise…)
épicées (muscade, cannelle…) ou fleuries (rose, jasmin…).
Ø Note de fond : Elle soutient la note de cœur et doit durer plus d'un jour ; la
note de fond constitue "le sillage". On utilise pour cela des
essences plus lourdes, plus tenaces, provenant d'arbres ou d'arbustes :
l'oliban, le bois de cèdre, le santal, le patchouli, le baume du Pérou….
Ø Fragrance : Mot d'origine latine (Fragrantia) désignant
une odeur agréable. C'est un des termes que les anglais utilisent pour désigner
un parfum. Ce terme est très souvent utilisé dans le langage du parfumeur.
Le
parfumeur dit par exemple que le parfum N°5 de Chanel se compose d'une :
- note de tête due aux
senteurs de bergamote, citron, néroli (huile essentielle obtenue par
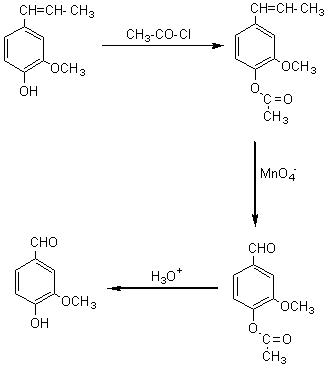
distillation des fleurs d'oranger) et d'aldéhydes (notamment le C12-MNA (méthylnonylacétaldéhyde ou 2-méthylundécanal)).
- note de cœur due au jasmin,
à la rose, à l'ylang, à l'iris.
- note de fond due au
vétiver, santal, vanille, ambres.
4) Les techniques d'extraction :
4-1) L'enfleurage
:
C'est
une technique qui peut être utilisée à froid ou à chaud et qui convient pour
les fleurs,
·
A froid pour les fleurs
fragiles, celles dont l'odeur disparaît rapidement après la cueillette ; elle
consiste à faire absorber par un corps gras olfactivement neutre (aujourd'hui
de la vaseline, hier de l'huile végétale ou des graisses animales mélangées)
les molécules odorantes. Dans la pratique on enduit de vaseline des plaques de
verre et on dispose des fleurs sur la partie grasse pendant une durée variable
suivant la nature des fleurs (24h pour le jasmin par exemple), puis on les
remplace par de nouvelles fleurs jusqu'à saturation en parfum de la couche de
graisse.
·
A chaud les opérations
sont identiques mais la graisse est chauffée au bain-marie.
4-2) L'extraction par macération :
On
fait macérer à froid les végétaux dans de l'hexane ou de l'éther (éthoxyéthane) puis on filtre et on concentre sous vide. On
obtient les concrètes pour les fleurs et les résinoïdes pour les gommes, les
résines…
4-3) L'extraction au dioxyde de
carbone supercritique :
A une
température relativement basse (31°C) et sous pression (73,8 bars), le dioxyde
de carbone prend un état dit supercritique, intermédiaire entre l'état gazeux
et l'état liquide propice à l'extraction par dissolution de certaines molécules
(molécules apolaires) contenues dans les végétaux (Un fluide est dit
supercritique lorsqu'il est placé dans des conditions de température et de
pression au-delà de son point critique. Les fluides supercritiques ont une
viscosité proche de celle des gaz, une densité proche de celle des liquides et
une diffusivité élevée. Les fluides supercritiques ont un pouvoir solvant à
"géométrie variable" ; la solubilité des composés évolue avec les
conditions de température et de pression du fluide). Il suffit ensuite d'abaisser
la pression (détente) pour éliminer le dioxyde de carbone qui passe à l'état
gazeux. L'avantage de cette méthode est de pouvoir extraire les molécules
odorantes sans les dénaturer (la température est assez basse et permet de
garder toute les facettes olfactives) et d'éliminer le solvant ensuite sans
résidu. C'est une technique onéreuse et réservée aux produits de haute valeur
ajoutée (notamment dans l'industrie des arômes alimentaires).
4-4) L'entraînement
à la vapeur d'eau :
On
met la substance végétale (fleurs, feuilles, écorces…) dans de l'eau et l'on
fait bouillir cet ensemble. La vapeur d'eau "entraîne les essences"
du végétal qui sont peu solubles dans l'eau, sous forme de vapeur et ce mélange
(vapeur d'eau et essences vaporisées) est ensuite condensé dans un réfrigérant
à serpentin. Le mélange hétérogène est ensuite décanté (séparation par
différence de densité) et l'on obtient d'un côté les essences ou huiles
essentielles et de l'autre l'eau florale.
4-5) L'expression
:
On
peut soumettre la peau des agrumes (zeste d'orange, de mandarine, de
pamplemousse…) à une pression à froid en les faisant passer entre des rouleaux
par exemple ; on obtient de l'huile essentielle.
4-6) L'incision
:
C'est
une technique utilisée pour certains arbres ; on incise avec une pointe, le
tronc et on enlève une étroite bande d'écorce de quelques centimètres de long,
pour recueillir une gomme-résine qui durcit en séchant. C'est ainsi par exemple
que l'on recueille l'oliban (encens) d'un arbre mâle (3m de haut à maturité) du
genre Boswellia qui vit en Somalie au Yémen et en
Inde, de la famille des térébinthacées.
5) Quelques molécules odorantes :
Les
molécules odorantes naturelles utilisées pour élaborer des parfums
appartiennent essentiellement à deux grandes familles chimiques, d'une part les
terpènes et terpénoïdes et d'autre part les composés
aromatiques (au sens chimique du terme) et notamment phénoliques. Quelques-unes
d'entre elles ont été répertoriées et classées par ordre alphabétique :
5-1) Les
terpènes et les terpénoïdes : (annexe 1)
Acide zizanoïque - Bergamol - Bisabolène - Cadinènes
– Camphènes – Camphres – Carvones - β-Caryophyllène –
α-Caryophyllène
(Humulène) - Cédrène
– Cédrol
– Cinéol (Eucalyptol) - Citrals – Citronellal – Citronellols – Eucalyptol
- Farnesènes
– Farnesols
– Fenchol
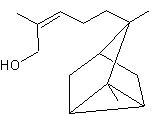
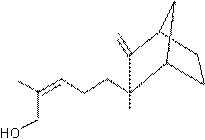
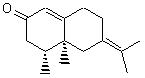
– Fenchone - Géranial – Géraniol – Géranylacétone – Humulène – Ionones – Irones – Isobornéol – α-Isométhylionone – Isovalencénol – Khusimol - Limonènes – Linalol – Menthol – Menthones – Myrcène
– Myrcénol
– Néral
(cis-Citral) – Nérol
– Nootkatone
– Occidentalol
– Ocimènes
– Patchoulol - Pinènes – Santalols – Térésantalol – Terpinéol – α-Vétivérone – α-Vétivone – β-Vétivone
5-2) Les composés aromatiques et notamment
phénoliques : (annexe 2)
Voici
quelques molécules qui sont ou ont été utilisées pour élaborer des parfums :
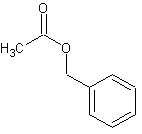
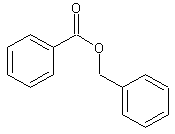
Acétate de benzyle
– Acétyleugénol - Acide benzoïque - Acide caféique - Acide ellagique - Acide 4-hydroxybenzoïque
- Acide salicylique
- Alcool benzylique
– Alcool cinnamique - Alcool coniférylique -
Aldéhyde benzoïque
– Amylcinnamal - Anéthole
- 4-Anisaldéhyde -
Anthranilate de
méthyle - Benzoate de
benzyle - Cinnamal - Coumarine - Eugénol – Héliotropine
- Hexylcinnamal
– Isoeugénols - Safrole – Thymol - Vanilline
–
5-3) D'autres molécules odorantes
: (annexe 3)
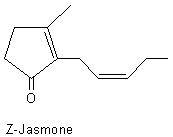
Calone - Florhydral® - Hédione – Jasmone
– Lilial – Méthyl octyne carbonate - 2-méthylundécanal
– Iso E Super ® -
5-4)
Deux exemples de parfums :
Il est
intéressant de comparer quelques ingrédients entrant dans la composition de
deux parfums, l'un pour femme, l'autre pour homme qui viennent d'un même
parfumeur ; les molécules soulignées sont celles qui sont communes aux deux
parfums.
Ø Un parfum pour femme :
L'air du temps de Nina Ricci
Une analyse des principales senteurs perçues dans ce parfum
:
- Notes de
tête : œillet, pêche, néroli, bergamote, rose, palissandre du Brésil et
aldéhydes.
- Notes de cœur
: romarin, œillet, gardénia, violette, orchidée, clou de girofle, racine
d'iris, jasmin, ylang-ylang et rose.
- Notes de
fond : Epices, iris, ambre, bois de santal, musc, benjoin, mousse de chêne,
vétiver, et cèdre.
Salicylate
de benzyle, hydroxycitronellal,
α-isométhylionone, Linalol, Eugénol,
Benzoate de benzyle, Amylcinnamal, Limonène,
Isoeugénol, Citronellol, Géraniol, Farnesol,
Hexylcinnamal, Alcool benzylique, Citral.
Ø Un parfum pour homme :
Ricci club de Nina Ricci
Une analyse des principales senteurs perçues dans ce parfum
:
- Notes de
tête : Armoise, lavandes, notes vertes, bergamote et citron.
- Notes de
cœur : Œillet, cyprès, pêche, jasmin, ylang-ylang, muguet et rose.
- Notes de
fond : Bois de santal, fève de tonka, ambre, patchouli, cannelle, musc, vanille
et cèdre.
Limonène, linalol, Ethylméthylméthoxycinnamate,
Coumarine, Hydroxyisohexyl-3-cyclohexènecarboxaldéhyde, Citronellol, Butylméthoxybenzoylméthane, Butylphénylméthylpropional,
α-isométhylionone, Salicylate d'éthylhexyle, Eugénol, Citral, Géraniol,
evernia furfuracea (mousse
d'arbre, extraits), Cinnamal, Isoeugénol, Benzoate
de benzyle, Cinnamate de benzyle, Salicylate
de benzyle, Farnesol, Alcool benzylique.
Colorant : jaune 6 (CI 15985).
6) D'autres molécules dans les parfums :
6-1) Les fixatifs :
Parfois
on incorpore aux parfums des substances souvent odorantes elles-mêmes dont le
rôle est de renforcer l'odeur perçue et surtout de réduire la vitesse
d'évaporation du parfum (par complexation parfois des molécules volatiles) et
donc d'augmenter la stabilité de la "fragrance" ; ce sont des
fixatifs ou fixateurs. C'est le cas des extraits (absolues) d'evernia furfuracea (dans
Ricci club cité précédemment) un lichen (Treemoss en
anglais) de la famille des Parméliacées ; rappelons
qu'un lichen est l'association symbiotique d'une algue et d'un champignon. On
peut citer un autre lichen Pseudevernia prunastri (Oak moss en
anglais), la mousse de chêne qui est un fixatif à parfum de violette.
Parmi
les fixatifs souvent utilisés on trouve également des extraits de bois de
santal, le vétiver (Le vétiver est une plante d'Asie tropicale (qui pousse dans les
plaines alluvionnaires) de la famille des Poacées de l'espèce Vetiveria zizanoides,
dont le nom local est Khus-khus ; c'est la racine séchée qui sert en parfumerie)
les ambres et les muscs.
Parmi les substances que
l'on utilise (ou utilisait) pour développer la senteur d'un parfum et qui
servent à le fixer on trouve des substances initialement d'origine animale
telles que :
ü L'ambre gris :
Composé dont l'odeur rappelle celle du
tabac. C'est une concrétion intestinale du cachalot formée en partie à partir de la
sépia des calmars ingérés par le cétacé. Après avoir flotté longtemps dans la
mer, ces résidus de digestion forment des blocs gris et poreux, faits notamment
de cristaux longs et minces, enchevêtrés d'ambrox :
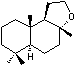
La texture, l'odeur et la couleur de
l'ambre gris varient en fonction du temps passé en mer. De texture molle à
l'état frais, il devient friable et de consistance visqueuse en durcissant.
Il sert surtout à
rehausser certaines odeurs dans un parfum ; on le ramasse à la surface ou sur
les rivages des mers chaudes ; il se présente sous forme de masses arrondies
irrégulières grises avec quelques taches jaunes ou noires, ayant des masses de
quelques grammes à quelques kilogrammes. Il est également synthétisé, notamment
à partir du sclaréol, produit naturel extrait de la sauge sclarée (Salvia sclarea L.)
:
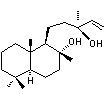
et c'est actuellement le produit
synthétique qui est exclusivement utilisé par les parfumeurs.
On donne le nom de musc à toutes les substances à forte odeur
provenant à l'origine de la glande abdominale d'un ruminant, le chevrotain
porte-musc (Moschus moschiferus)
des hautes montagnes d'Asie, produites en période de rut, ou de certains
animaux comme la civette ou la loutre.
La muscone
est le constituant majeur des muscs naturels :
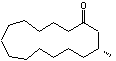
La source de l'odeur semble être la cétone
cyclique (cyclopentadécanone). Cependant on trouve
plusieurs classes de muscs synthétiques, certains étant des composés nitrés et
d'autres des composés polycycliques, dont les structures sont éloignées de
celles des molécules des muscs naturels ; parmi les composés nitrés citons le musc xylol, le
musc cétone,
le musc ambrette,
le musc tibetene, le musc moskene ; parmi
les composés polycycliques,
citons le célestolide et enfin parmi les composés
macrocycliques on trouve, muscone, exaltone, cervolide,
musc ambrettolide, exaltolide, musc T, ambrettolide,
civettone,
ambrettone.
7) Les présentations des
parfums dans le commerce :
On trouve, dans le
commerce, par ordre de
concentration décroissante :
![]() Le parfum : C'est la préparation
la plus concentrée ; 15 à 30% de produit dans de l'éthanol à 98%.
Le parfum : C'est la préparation
la plus concentrée ; 15 à 30% de produit dans de l'éthanol à 98%.
![]() L'eau de parfum : 10 à 15% de produit
dans de l'éthanol à 98%.
L'eau de parfum : 10 à 15% de produit
dans de l'éthanol à 98%.
![]() L'eau de toilette : 5 à 10% de produit
dans de l'éthanol à 85%.
L'eau de toilette : 5 à 10% de produit
dans de l'éthanol à 85%.
![]() L'eau de cologne : 3 à 5% de produit dans de l'éthanol à 70 à 80%.
L'eau de cologne : 3 à 5% de produit dans de l'éthanol à 70 à 80%.
8) Les parfums
des produits de nettoyage :
La composition des parfums présents
dans sept produits de nettoyage du commerce est donnée ci-après ; on remarquera
que le nombre d'ingrédients est réduit, le plus souvent quatre et que l'on
retrouve presque toujours les mêmes constituants :
o
Woolite laine et soie : Hexylcinnamal, Butylphénylméthylpropional, Linalol, Citronellol.
o
Génie sans frotter : Limonène, Linalol, Coumarine.
o
K2R Gel détachant avant lavage : Butylphénylméthylpropional,
Citronellol, Hexylcinnamal, Limonène.
o
AS détachant avant lavage : Butylphénylméthylpropional,
Citral.
o
Ajax eucalyptus :
Coumarine, Limonène.
o
Mir black : Amylcinnamal, Butylphénylméthylpropional,
Géraniol, Hexylcinnamal, Linalol.
o
Petit Marseillais Lait : Coumarine, Citronellol, Linalol, Butylphénylméthylpropional,
Géraniol, α-isométhylionone.
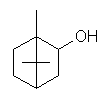
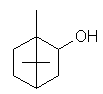
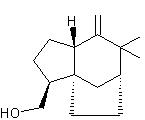
Annexe 1 : quelques molécules odorantes, terpènes ou terpénoïdes :
|
MOLECULES ODORANTES |
FORMULE CHIMIQUE |
ORIGINES NATURELLES PRINCIPALES |
|
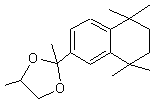
Acétate de linalyle ou Bergamol ou Ethanoate de 3,7-diméthylocta-1,6-dièn-3-yle. C12H20O2 Aspect : Liquide légèrement jaune à odeur de citron. Masse molaire : 220°C 44°C (sous 0,2 mm de Hg) Densité : 0,859 (à 20°C) Indice de réfraction : 1,4460 (à 20°C) N° CAS : 115-95-7 Solubilité : Miscible à l'éthanol et à l'éther ; insoluble dans l'eau |
|
·
Lavandula augustifolia ou lavande fine
(environ 36% de l'huile essentielle). ·
Lavandula hybrida ou lavandin (environ 31% de l'huile essentielle). ·
Citrus bergamia (Bergamotier). |
|
Acide zizanoïque ou Acide khusénique C15H22O2 Masse molaire : 234,33398 g.mol-1 N° CAS : 16203-25-1 |
|
Une des molécules indésirable présente dans l'huile
essentielle de vétiver ; le vétiver bourbon en contient très peu. A cet acide correspond l'alcool primaire khusimol qui est au contraire une des molécules
constituant un critère de qualité pour l'huile essentielle de vétiver. |
|
ou (4Z)-1-méthyl-4-(6-méthylhept-5-èn-2-ylidène)cyclohexène C15H24 Masse molaire : 262°C Densité : 0,867 Indice de réfraction : 1,493 N° CAS : 495-62-5 Risques : |
|
·
Citrus bergamia (Bergamotier) C'est un composant de l'huile essentielle de bergamote ;
s'obtient aussi par déshydratation acide du farnesol. |
|
C15H24 Masse molaire : 204,352 g.mol-1 (+)-α-cadinène d-cadinène g-cadinène : Ebullition : 126°C (sous 12 mm de Hg) Densité : 0,9182 (à 15°C) Indice de réfraction : 1,3166 (à 20°C) N° CAS : 39029-41-9 |
α-cadinène
d-cadinène
g-cadinène |
·
Juniperus oxycedrus (Genévrier oxycèdre ou genévrier cade) : c'est de cet arbuste du
bassin méditerranéen que les cadinènes ont été
extraits pour la première fois. Leur nom dérive de celui de l'arbuste. ·
En
quantités plus ou moins importantes dans les huiles essentielles de nombreux
végétaux. |
|
Camphène (+) ou 2,2-diméthyl-3-méthylènebicyclo[2.2.1.]heptane,(1R)- C10H16 Aspect : Cristaux en aiguilles Fusion : 52°C Ebullition : 161°C Densité : 0,8950 (à 50°C) Indice de réfraction : 1,4570 (raie D du sodium, à 25°C) N° CAS : 5794-03-6 Solubilité : Très soluble dans l'éther. Camphène (-) ou 2,2-diméthyl-3-méthylènebicyclo[2.2.1.]heptane,(1S)- Fusion : 52°C Ebullition : 158°C Densité : 0,8446 (à 50°C) Indice de réfraction : 1,4564 (raie D du sodium, à 54°C) N° CAS : 5794-04-7 Solubilité : Très soluble dans l'éther. |
Camphène (±)
Camphène (+)
Camphène (-) Le camphène peut
s'obtenir à partir de l'α-pinène par catalyse
acide :
|
·
Citrus bergamia (Bergamotier) C'est un composant de
l'huile essentielle de bergamote. ·
Cymbopogon citratus
(Citronnelle) de la famille des poacées. ·
Zingiber officinale (Gingembre) de la
famille des zingibéracées. |
|
Camphre (d,l) ou (d,l)( 1,7,7-triméthylbicyclo[2,2,1]heptan-2-one) C10H16O Masse molaire : Ebullition : Se sublime Densité: 0,99420 Indice de réfraction: 1,427878 N° CAS : Solubilité : Très soluble dans l'éthanol et l'éther ;
soluble dans l'acétone et le benzène ; insoluble dans l'eau. Camphre (+) ou (1R)
1,7,7-triméthylbicyclo[2,2,1]heptan-2-one C10H16O Masse molaire : Ebullition : 207,4°C Densité : 0,990 à 25°C Indice de réfraction : 1,5462 N° CAS : Solubilité : Très soluble dans l'éthanol et l'éther ;
soluble dans l'acétone et le benzène ; insoluble dans l'eau. Camphre (-) ou (1S) C10H16O Masse molaire : Densité : 0,9853 à 18°C N° CAS : Solubilité : Très soluble dans l'éthanol, l'éther et
l'acide acétique; soluble dans l'acétone et le benzène ; insoluble dans
l'eau. |
Camphre (
Camphre (-)
Camphre (+) |
·
Cinnamomum camphora (camphrier) ·
Lavandula latifolia (ou spica) (Lavande aspic) 19% environ de l'huile essentielle. ·
Lavandula
hybrida (Lavandin) 6% environ
de l'huile essentielle. C'est un terpène
oxygéné, extrait du camphrier (Cinnamomum camphora), arbre de la famille des lauracées, à feuilles
persistantes qui pousse bien en Asie tropicale où il porte le nom Kapuru-gaha. La
distillation des copeaux de la tige, ou des racines produit l'huile de
camphre, analgésique et antiseptique. On l'utilise aussi pour activer la
circulation (frictions de la poitrine et des muscles). C'est Julius Bredt (1885-1937) qui
proposa en 1893 une formule constituée de deux cycles "en pont".
Citons aussi Otto Wallach (1847-1931)
Prix Nobel de chimie en 1910 qui a particulièrement fait progresser la chimie
du camphre et des terpènes. 1903 : Synthèse partielle par Albin Haller (1849-1925),
Professeur à la Sorbonne. 1948 Synthèse, par Niilo Toivonen (né en 1888) Professeur à Helsinki, sur le
modèle des synthèses de l'acide camphorique et de l'α-pinène qui avaient été menées en 1903
par Gustav Komppa (1867-1949) Professeur à
Helsinki. |
|
Carvone lévogyre ou R(-) Carvone ou (R) p-mentha-1,8-dièn-6-one C10H14O Masse molaire: N° CAS : 6485-40-1 Solubilité : Très soluble dans l’éthanol ;
soluble dans l’éther et le chloroforme ; légèrement soluble dans l’eau. Carvone dextrogyre S(+) Carvone ou (S) p-mentha-1,8-dièn-6-one C10H14O Masse molaire: N° CAS : 2244-16-8 Solubilité : Très soluble dans l’éthanol ;
soluble dans l’éther et le chloroforme ; légèrement soluble dans l’eau. |
ou
R(-) Carvone
ou
S(+) Carvone |
·
Mentha sp. (menthe) La R(-) carvone présente dans l'huile
essentielle de menthe verte, elle en possède l'odeur. ·
Carum carvi (cumin des prés) de la famille des apiacées (anciennement
ombellifères). ·
Anethum graveolens (fenouil bâtard ou faux anis) de la famille des apiacées. La S(+) Carvone à odeur de carvi existe
dans les huiles essentielles des deux plantes mentionnées. |
|
(-)-b-Caryophyllène C15H24 Masse molaire : 263°C ; 122°C (sous 13,5 mm de Hg) Densité : 0,9075 (à 20°C) Indice de réfraction : 1,4986 (à 20°C) N° CAS : 87-44-5 Solubilité : Très soluble dans le benzène. |
|
·
Syzygium aromaticum (Giroflier originaire d'Indonésie) Le β-Caryophyllène apporte une note boisée et légèrement
poivrée à l'odeur des clous de girofle. ·
Dianthus caryophyllus (Oeillet des fleuristes) de la famille
des caryophyllacées. |
|
α-Cédrène (1S,2R,5S)-2,6,6,8-tétraméthyltricyclo[5,3,1,1,5]undec-8-ène C15H24 Aspect : Liquide huileux
incolore à odeur boisée, fraîche, de cèdre. Masse molaire : 204,3510600 g.mol-1 Ebullition : 262,5°C ; 125°C (sous
12mm de Hg) Densité : 0,94 Indice de réfraction : 1,515 N° CAS : 469-61-4 Solubilité : Soluble dans l'éthanol
; insoluble dans l'eau. Sécurité : |
|
·
Cedrus libani
(Cèdre du liban). ·
Toona ciliata
(Cèdre rouge d'Australie). Sesquiterpène présent
dans l'huile essentielle de cèdre, utilisé comme agent de saveur et de
senteur. Dans un parfum,
l'α-cédrène fait partie des notes de fond du
parfum, les plus tenaces (sillage) ; surtout utilisé pour les parfums
masculins. |
|
α-Cédrol Aspect : C'est un solide cristallin à odeur de cèdre Fusion : 86°C Densité : 0,9479 (à 90°C) Indice de réfraction : 1,4824 (raie D du sodium, à 90°C) N° CAS : 77-53-2 |
|
·
Cedrus libani
(Cèdre du liban). ·
Toona ciliata
(Cèdre rouge d'Australie). Agent odoriférant. Il est utilisé ainsi que son acétate dans la
formulation des parfums. |
|
géranial isomère (E) ou (2E)-3,7-diméthylocta-2,6-diènal C10H16O Liquide clair de couleur jaune très
pâle. Masse molaire : 228,5°C Densité : 0,856 Indice de réfraction : 1,456 N° CAS : 141-27-5 Solubilité : Soluble dans l'éthanol, insoluble dans l'eau. néral isomère (Z) ou (2Z)-3,7-diméthylocta-2,6-diènal C10H16O Liquide clair de couleur jaune pâle. Masse molaire : 229,5°C Densité : 0,885 Indice de réfraction : 1,480 N° CAS : 141-27-5 |
ou
Géranial
Néral |
·
Citrus sp. (Orangers et citronniers, agrumes
d'une façon générale). ·
Verbena officinalis
(Verveine) ·
Cymbopogon citratus
(Citronnelle) de la famille des poacées. Le citral est un liquide à odeur de citron, mélange de deux isomères : le
géranial (isomère E) à odeur beaucoup plus prononcée que le néral (isomère Z). On le rencontre dans les huiles
essentielles de citron, de verveine et de citronnelle. |
|
ou 3,7-diméthyl-6-octénal C10H18O Aspect : Cristaux en aiguilles. Masse molaire : 207,5°C Densité : 0,853 (à 20°C) Indice de réfraction : 1,4473 (à 20°C) N° CAS : 106-23-0 Solubilité : Soluble dans l'éthanol ; légèrement
soluble dans l'eau. |
|
·
Cymbopogon citratus ·
Cymbopogon martini ·
Cymbopogon nardus ·
Citrus sp. (Citronelles
et agrumes) ·
Le
citronellal a une vigoureuse odeur de citron et se retrouve dans l'huile
essentielle des végétaux cités ci-dessus. |
|
Citronellol (+) ou 3,7-diméthyl-6-octène-1-ol, (R) C10H20O Aspect : Huile Masse molaire : 224°C ; 108°C (sous 10 mm de Hg) Densité : 0,8550 (à 20°C) Indice de réfraction : 1,4565 (à 20°C) N° CAS : 1117-61-9 Solubilité : Miscible à l'éthanol, l'éther ;
légèrement soluble dans l'eau. Citronellol (-) ou 3,7-diméthyl-6-octène-1-ol, (S) C10H20O Aspect : Huile Masse molaire : 224°C ; 108°C (sous 10 mm de Hg) Densité : 0,859 (à 18°C) Indice de réfraction : 1,4576 (à 18°C) N° CAS : 7540-51-4 Solubilité : Très soluble dans l'éthanol, l'éther. |
Citronellol (+)
Citronellol (-) |
·
Rosa sp. (Roses) Odeur de roses. C'est l'une des 26 substances allergènes dont la présence doit
être mentionnée dès lors que leurs concentrations dépassent 0,001% pour les
produits à ne pas enlever (crèmes....) et 0,01% pour les produits à enlever
par rinçage. (Directive européenne, JO du 11 mars 2003). |
|
ou Cinéol C10H18O Masse molaire : 0,8°C Ebullition : 176,4°C Densité : 0,9267 (20°C) Indice de réfraction : 1,4586 (20°C) N° CAS : 502-61-4 Solubilité : Soluble dans l'éthanol l'éther et le chloroforme ; insoluble
dans l'eau. |
|
·
Eucalyptus sp (Eucalyptus). ·
Salvia officinalis (Sauge). ·
Ocimum basilicum (Basilic). ·
Rosmarinus officinalis (Romarin) ·
Lavandula latifolia (ou spica) (lavande aspic)
environ 26% de l'huile essentielle. ·
Lavandula hybrida (lavandin) environ 5% de l'huile essentielle. Monoterpène ; existe dans l'huile
essentielle des eucalyptus et de certaines plantes (sauge, basilic, romarin).
Utilisé comme décongestionnant. |
|
ou 3,7,11-triméthyldodéca-1,3,6,10-tétraène C15H24 Masse molaire : 130°C (sous 12 mm de Hg) Densité : 0,8410 (20°C) Indice de réfraction : 1,4836 (20°C) N° CAS : 502-61-4 Solubilité : Soluble dans l'éthanol et l'acétone ; insoluble dans l'eau. β-Farnesène ou 7,11-diméthyl-3-méthylènedodéca-1,6,10-triène C15H24 Masse molaire : 121°C (sous 9 mm de Hg) Densité : 0,8363 (20°C) Indice de réfraction : 1,4899 (20°C) N° CAS : 18794-84-8 Solubilité : Très soluble dans l'acétone, l'éther et le chloroforme. |
α-(E,E)-Farnesène
β-Farnesène |
·
Cymbopogon citratus
(Citronnelle) de la famille des poacées : dans l'huile essentielle de
citronnelle. Parmi les nombreux
isomères l'isomère α- (E,E) existe dans la
peau des pommes et est responsable de l'odeur des pommes vertes. |
|
C15H26O Masse molaire : Ebullition : 160°C (10 mm de Hg) ; 137°C (3 mm de Hg) Densité : 0,888 (20°C) Indice de réfraction : 1,4877 (20°C) N° CAS : 106-28-5 Solubilité : Très soluble dans l'éthanol ; soluble dans l'éther et l'acétone
; insoluble dans l'eau. 2-cis,6-trans-Farnesol C15H26O Masse molaire : Ebullition : 156°C (12 mm de Hg) ; 120°C (0,3 mm de Hg) Densité : 0,8908 (20°C) Indice de réfraction : 1,4877 (20°C) N° CAS : 106-28-5 Solubilité : Très soluble dans l'éthanol, l'éther et l'acétone. |
ou 2-trans,6-trans-Farnesol
2-cis,6-trans-Farnesol |
·
Convallaria majalis (Muguet) Alcool sesquiterpénique
(2 isomères). L'une des substances les plus répandues dans le règne végétal.
A l'odeur du muguet. |
|
ou endo (±)- 1,3,3-triméthylbicyclo[2,2,1]heptan-2-ol C10H18O Masse molaire : 154,249 g.mol-1 Fusion : 39°C Ebullition : 199,5°C Densité : 9420 (à 40°C) N° CAS : 36386-49-9 Solubilité : Très soluble dans
l'éthanol et l'éther. |
|
·
Foeniculum vulgare (Fenouil commun). ·
Pinus sylvestris (Pin sylvestre) Molécule isomère du bornéol,
utilisée en parfumerie. |
|
ou 1,3,3-triméthylbicyclo[2,2,1]heptan-2-one. C10H16O Aspect : Liquide huileux
incolore Masse molaire : 152,233 g.mol-1 Fusion : 6,1°C Ebullition : 193,5°C Densité : 0,9492 (à 15°C) Indice de réfraction : 1,4702 (20°C, raie D
du sodium) N° CAS : 18492-37-0 Solubilité : Très soluble dans
l'éthanol ; soluble dans l'éther, l'acétone ; insoluble dans l'eau. |
|
·
Foeniculum vulgare (Fenouil commun). ·
Pinus sylvestris (Pin sylvestre) ·
Artemisia absinthium (Absinthe) Monoterpène comportant
une fonction cétone et utilisé en parfumerie. On trouve de la
fenchone dans l'huile essentielle de fenouil. La fenchone est aussi
présente dans l'Absinthe (Artemisia absinthium) qui est une armoise aromatique de la
famille des composées, à croissance rapide et qui était utilisée autrefois
dans la liqueur d'absinthe. |
|
ou (2E)-3,7-diméthylocta-2,6-dièn-1-ol C10H18O Aspect : Liquide clair de couleur jaune très
pâle. Masse molaire : Inférieur à -15°C Ebullition : 230°C Densité : 0,8894 (à 20°C) Indice de réfraction : 1,4766(à 20°C) N° CAS : 106-24-1 Solubilité : Soluble dans l'éthanol, l'éther, l'acétone, le chloroforme ;
insoluble dans l'eau. |
|
·
Rosa sp. (Roses). ·
Citrus bergamia (Bergamotier). ·
Citrus sp. (orangers et citronniers, agrumes
d'une façon générale). ·
Lavandula sp. (Lavandes). ·
Jasminum officinale (Jasmin). Contribue à donner son
odeur à la rose. |
|
ou Trans-6,10-diméthylundéca-5,9-dièn-2-one C13H22O Masse molaire : Ebullition : 124°C (sous 10 mm de Hg) Densité : 0,873 Indice de réfraction : 1,4670 N° CAS : 3796-70-1 Risques : |
|
·
Magnolia officinalis (Magnolia) Le géranylacétone
est présent dans l'huile essentielle extraite de l'écorce du magnolia, mais
aussi dans des substances plus communes comme le riz, les tomates … |
|
ou α-Caryophyllène C15H24 Masse molaire : 123°C (sous 10 mm de Hg) Densité : 0,8905 (à 20°C) Indice de réfraction : 1,5038 (à 20°C) N° CAS : 6753-98-6 |
Humulène Ce sesquiterpène peut également s'obtenir à partir de l'alcool correspondant
(que l'on trouve également dans des extraits d'œillets) par déshydratation.
Alcool de l' α-Caryophyllène |
·
Humulus lupulus (Houblon) de la famille des cannabacées. ·
Dianthus caryophyllus (Oeillet des fleuristes) de la famille
des caryophyllacées. |
|
trans-α-Ionone (±) C13H20O Masse molaire : 192,297 g.mol-1 Aspect : Liquide jaune clair.. Ebullition : 260°C ; 146 (28 mm de Hg). Densité : 0,9298 (à 21°C) Indice de réfraction : 1,5041 (à 20°C) N°CAS : 30685-95-1 Solubilité : Très soluble dans l'éthanol et l'éther, l'acétone. trans-β-Ionone C13H20O Masse molaire : 192,297 g.mol-1 Ebullition : 124°C (10 mm de Hg) ; 73°C (0,1 mm de Hg). Densité : 0,945 (à 20°C) Indice de réfraction : 1,5198 (à 20°C) N°CAS : 79-77-6 Solubilité : Miscible à l'éthanol et l'éther ; soluble dans le chloroforme ;
légèrement soluble dans l'eau. |
trans-α-Ionone (±) Composé à odeur de violette. Il est utilisé dans de nombreuses
synthèses, notamment celle du phytol et de la vitamine
A.
trans-β-Ionone Composé à odeur fruitée. |
·
Viola odorata (violette ; fleur de mars). ·
Rosa damascena trigintipetala (rose de Damas). L' α-Ionone a une
odeur agréable de violette. La β-ionone a une
odeur fruitée et boisée de cèdre et de framboise. Les ionones
proviennent de la dégradation des caroténoïdes dans les végétaux. |
|
ou 4-(2,5,6,6-tétraméthyl-2-cyclohexèn-1-yl)-3-butèn-2-one C14H22O Masse molaire : 206,324 g.mol-1 Ebullition : 90°C (0,4 mm de Hg). Densité : 0,9362 (à 20°C) Indice de réfraction : 1,5002 (à 20°C) N°CAS : 79-69-6 ou 4-(2,5,6,6-tétraméthyl-1-cyclohexèn-1-yl)-3-butèn-2-one C14H22O Masse molaire : 206,324 g.mol-1 Ebullition : 125°C (11 mm de Hg). Densité : 0,9434 (à 21°C) Indice de réfraction : 1,5162 (à 25°C) N°CAS : 79-70-9 Solubilité : Très soluble dans l'éthanol, l'éther, le benzène, le
chloroforme. |
α-Irone
β-Irone |
·
Iris germanica var. florentina (Iris bleu
d'Allemagne).
Odeur de violette ; présent
dans l'iris. |
|
Isobornéol (dl) Masse molaire :
Fusion : 212°C Ebullition : |
|
·
Pinus sylvestris (Pin sylvestre) C'est un isomère du bornéol
(terpène
; Contribue à donner son odeur au pin. |
|
α-Isométhylionone C14H22O Aspect : Liquide incolore ou couleur jaune paille. Masse molaire : 206,32388 g.mol-1 Densité : 0,929 Indice de réfraction : 1,508 N°CAS : 124-76-5 Solubilité : Très soluble dans l'éthanol, l'éther, le chloroforme ; soluble
dans le benzène ; insoluble dans l'eau. Sécurité : |
|
·
Viola odorata (Violette ; fleur de mars). ·
Rosa damascena trigintipetala (rose de Damas). Entre dans la formulation
des parfums et des cosmétiques. |
|
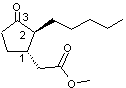
C15H24O N° CAS : 22387-74-2 |
|
Alcool présent en particulier dans l'huile
essentielle de vétiver et elle en constitue un des critères de qualité en
parfumerie avec le khusimol. |
|
C15H24O Masse molaire : 220,3505 g.mol-1 N° CAS : 16223-63-5 |
|
Alcool présent en particulier dans l'huile
essentielle de vétiver et elle en constitue un des critères de qualité en
parfumerie avec l'isovalencénol. |
|
ou p-Mentha-1,8-diène, (R) C10H16 Masse molaire : 136,234 g.mol-1 Aspect : Huile incolore à odeur
d'orange. Fusion : -74,0°C Ebullition : 178°C Densité : 0,8411 (à 20°C) Indice de réfraction : 1,4730 (à 20°C) N°CAS : 5989-27-5 Solubilité : Miscible à l'éthanol
et l'éther ; insoluble dans l'eau. l-Limonène ou p-Mentha-1,8-diène, (S) C10H16 Masse molaire : 136,234 g.mol-1 Aspect : Huile incolore à odeur
de citron. Ebullition : 178°C ; 64,4°C (à
15°C) Densité : 0,843 (à 20°C) Indice de réfraction : 1,4746 (à 20°C) N°CAS : 5989-54-8 Solubilité : Très soluble dans
l'éthanol et l'éther ; insoluble dans l'eau. |
Le d-limonène est l'une des 26 substances allergènes dont la présence
doit être mentionnée dès lors que leurs concentrations dépassent 0,001% pour
les produits à ne pas enlever (crèmes....) et 0,01% pour les produits à
enlever par rinçage. (Directive européenne, JO du 11 mars 2003).
|
·
Citrus sp. (Orangers et citronniers, agrumes
d'une façon générale). ·
Pinus sylvestris (Pin sylvestre d'Auvergne ou d'Ecosse). ·
Mentha sp.
(les menthes) Le limonène se forme
aussi par déshydratation du produit naturel α-terpinéol. |
|
ou (±) 3,7-diméthyl-1,6-octadièn-3-ol C10H18O N° CAS : 22564-99-4 |
Muguet - Convallaria majalis Jardin
botanique de Belgique |
·
Lavandula sp. (le
linalol constitue entre 25 et 30% de l'huile essentielle). ·
Convallaria majalis (Muguet) ·
Pinus sylvestris (Pin sylvestre d'Auvergne ou d'Ecosse). ·
Mentha piperita (Menthe poivrée). isolé de l'essence de cannelle, de sassafras, de fleur
d'oranger, de menthe poivrée, de pin sylvestre et de muguet.
|
|
ou Lévomenthol ou (1R,2S,5R)-menthol ou 5-méthyl-2-isopropylcyclohexanol, [1R-(1α,2β,5α)] C10H20O Aspect : Cristaux en aiguilles (quand recristallisé dans le méthanol). Masse molaire : 156,265 g.mol-1 Fusion : 43°C Ebullition : 216°C Densité : 0,903 (à 15°C) Indice de réfraction : 1,460 (à 22°C) N° CAS : 2216-51-5 Solubilité : Très soluble dans l'éthanol, l'éther, l'acétone, le benzène ;
légèrement soluble dans l'eau. Sécurité : |
|
·
Mentha piperita (Menthe poivrée) En association avec l’huile essentielle d’eucalyptus, cette
molécule a des propriétés antiseptiques et décongestionnantes et est utilisée
pour soulager les irritations de la gorge chez l’adulte (Valda®).
Volatil, ses vapeurs font pleurer (utilisé au cinéma). |
|
ou ou Isomenthone C10H18O Masse molaire : 154,249 g.mol-1 Ebullition : 205°C ; 89°C (sous 15 mm de Hg) Densité : 0,8995 (à 20°C) Indice de réfraction : 1,4527 (à 20°C) N° CAS : 491-07-6 ou C10H18O Aspect : liquide Masse molaire : 154,249 g.mol-1 Fusion : -6°C Ebullition : 207°C Densité : 0,8954 (à 20°C) Indice de réfraction : 1,4505 (à 20°C) N° CAS : 14073-97-3 Solubilité : Miscible à l'éthanol, l'éther, le benzène, le disulfure de carbone
; soluble dans l'acétone ; légèrement soluble dans l'eau. |
(+) Menthone
(-) Menthone |
·
Mentha piperita (Menthe poivrée) ·
Mentha pulegium (Menthe pouliot) ·
Pelargonium graveolens x tomentosum (Pélargonium). La menthone correspond
au mélange des deux formes. C'est une cétone monoterpénique,
utilisée en parfumerie et pour les cosmétiques. |
|
ou β-Myrcène ou 7-méthyl-3-méthylène-1,6-octadiène C10H16 Masse molaire : Ebullition : 167°C. Densité : 0,8013 (à 15°C) Indice de réfraction : 1,4722(à 20°C) N° CAS : 123-35-3 Solubilité : Soluble dans l'éthanol, l'éther,le
benzène, le chloroforme, l'acide éthanoïque. |
|
·
Laurus nobilis (Laurier d'Apollon) ·
Lindera benzoin (Laurier-benjoin) ·
Verbena officinalis
(Verveine) ·
Cananga odorata (Ylang-ylang, la fleur des fleurs) de la famille des
annonacées. La molécule de myrcène a une odeur agréable mais est rarement utilisée
directement dans la formulation d'un parfum. Elle sert plutôt comme
intermédiaire dans diverses préparations comme celles du menthol,
du citral, du linalol, du géraniol, du nérol…. |
|
ou 2-méthyl-6-méthylidènoct-7-èn-2-ol C10H18O Masse molaire : Ebullition : 224,5°C. Densité : 0,851 N° CAS : 543-39-5 |
|
·
Humulus lupulus (Houblon) de la famille des cannabacées. ·
Hedychium coronarium (gingembre sauvage originaire de l'Himalaya ;
Népal). Fine odeur de lavande. |
|
ou (2Z)-3,7-diméthylocta-2,6-dièn-1-ol C10H18O Masse molaire : Inférieur à -15°C Ebullition : 225°C ; 125°C (sous 25 mm de Hg). Densité : 0,8756 (à 20°C) Indice de réfraction : 1,4746(à 20°C) N° CAS : 106-25-2 Solubilité : Très soluble dans l'éthanol. |
C'est l'isomère cis du géraniol. |
·
Rosa sp. (Roses) ·
Citrus aurantium (bigaradier) ·
Citrus sp. (orangers et citronniers, agrumes
d'une façon générale). ·
Jasminum
officinale (Jasmin) Parfum de rose présent
dans l'essence de néroli (initialement obtenue à partir de fleurs de
bigaradier). |
|
C15H22O Masse
molaire : Données concernant la (+)-nootkatone : Aspect : A l'état liquide,
liquide visqueux jaune à odeur de pamplemousse ; à l'état solide cristaux à
odeur de pamplemousse. Fusion : 36°C Ebullition: N° CAS : 4674-50-4 |
Parmi les huit stéréoisomères de cette molécule, seul l'isomère
suivant possède l'odeur de pamplemousse :
|
·
Citrus grandis (Pamplemoussier) famille des rutacées. ·
Cupressus nootkatensis
(Cèdre de l'Alaska). Le
nom nootkatensis vient de l'île de Nootka proche de
l'île de Vancouver ou cet arbre a été découvert en 1793. C'est une cétone sesquiterpénique. C'est une matière
première très coûteuse (le prix est aux alentours de 100 euros le gramme ; à titre
de comparaison 1g de limonène coûte environ 0,035 euro le gramme). |
|
|
·
Thuja
occidentalis (Cèdre blanc ou thuya
du Canada). C'est un sesquiterpène qui a été isolé du bois de
cèdre. |
|
|
cis-β-Ocimène ou cis-3,7-diméthyl-1,3,6-octatriène C10H16 Masse molaire : 136,234 g.mol-1 Ebullition : 177°C Densité : 0,799 (à 20°C) N°CAS : 3338-55-4 |
|
·
Ocimum
basilicum (Basilic) |
|
trans-β-Ocimène ou trans-3,7-diméthyl-1,3,6-octatriène C10H16 Masse molaire : 136,234 g.mol-1 Ebullition : 177°C Densité : 0,799 (à 20°C) N°CAS : 3779-61-1 |
|
·
Ocimum
basilicum (Basilic) |
|
α-Ocimène ou 3,7-diméthyl-1,3,7-octatriène C10H16 Masse molaire : 136,234 g.mol-1 Ebullition : 177°C (se décompose) Indice de réfraction : 1,4862 (à 20°C) Densité : 0,8000 (à 20°C) N°CAS : 502-99-8 Solubilité : Soluble dans
l'éthanol, l'éther, le chloroforme, l'acide éthanoïque ; insoluble dans
l'eau. |
|
·
Ocimum
basilicum (basilic) |
|
(-) Patchoulol
(1R,3R,6S,7S,8S) ou Alcool patchouli C15H26O Masse molaire : 222,36 g.mol-1 Fusion : 56°C (racémique 40°C) Indice de réfraction : 1,5029 Densité : 1,0284 N°CAS : 5986-55-0 Solubilité : Soluble dans l'éthanol
et l'éther ; insoluble dans l'eau). |
|
Une des molécules qui contribue à donner une odeur à l'extrait de Patchouli. |
|
a-Pinène 2-pinène ou Aspect : liquide Fusion : 156,2°C Densité : 0,8539 (à 25°C) Indice de réfraction : 1,4632 (à 25°C) N° CAS : 80-56-8 Solubilité : Miscible à l'éthanol, l'éther, le chloroforme ; insoluble dans
l'eau. |
|
·
Pinus sylvestris (Pin sylvestre d'Auvergne ou d'Ecosse). ·
Thymus vulgaris (Thym) Principal constituant de l'essence de térébenthine.
Possède des propriétés antiseptiques. Matière première dans une synthèse
du camphre. |
|
b-Pinène Aspect : liquide Fusion : 166°C Densité : 0,860 (à 25°C) Indice de réfraction : 1,4768 (à 25°C) N° CAS : 127-91-3 Solubilité : Soluble dans le benzène, l'éthanol, l'éther, le chloroforme ;
insoluble dans l'eau. |
|
·
Pinus sylvestris (Pin sylvestre d'Auvergne ou d'Ecosse). |
|
α-Santalol C15H24O Aspect : liquide 301,5°C Densité : 0,9679 (à 20°C) Indice de réfraction : 1,5023 (à 20°C) N° CAS : 115-71-9 Solubilité : Soluble dans l'éthanol ; insoluble dans l'eau. |
|
·
Santalum album (Santal) : Arbre semper virens à croissance
lente de la famille des santalacées. L'huile essentielle de
Santal où est présent le santalol peut être extraite de toutes les parties de
l'arbre, mais elle est plus abondante dans le bois de cœur et les racines
(61% environ). |
|
β-Santalol C15H24O Aspect : liquide 167°C (sous 10 mm de Hg) Densité : 0,9750 (à 20°C) Indice de réfraction : 1,5115 (à 20°C) N° CAS : 77-42-9 Solubilité : Soluble dans l'éthanol ; insoluble dans l'eau. Sécurité : |
|
·
Santalum album (Santal) : Arbre semper virens à croissance
lente de la famille des santalacées. L'huile essentielle de Santal où est
présent le santalol peut être extraite de toutes les parties de l'arbre, mais
elle est plus abondante dans le bois de cœur et les racines (61% environ). |
|
ou 2,3-diméthyl-tricyclo[2.2.1.0.(2,6)]heptane-3-méthanol C10H16O Masse molaire : N° CAS : 29550-55-8 |
|
·
Magnolia (virginiana,
tripetala, pyramidata, macrophylla, grandiflora, fraseri, ashei, acuminata) Magnolias ; Ce sont des arbres ou des arbustes de la famille
des magnoliacées. ·
Liriodendron tulipifera
Tulipier de Virginie ; arbre de la famille
des magnoliacées. ·
Santalum album (Santal) : Arbre semper virens à croissance
lente de la famille des santalacées. |
|
C10H18O Aspect : Cristaux Masse molaire : 40,5°C Ebullition : 220°C Densité : 0,9337 (à 20°C) Indice de réfraction : 1,4831 (à 20°C) N° CAS : 2438-12-2 Solubilité : Très soluble dans le
benzène, l'acétone, l'éther et l'éthanol ; légèrement soluble dans l'eau. |
|
·
Pinus sylvestris (Pin sylvestre d'Auvergne ou d'Ecosse). ·
Syringa vulgaris (Lilas) ·
Jasminum
officinale (Jasmin) C'est aussi un
constituant de la térébenthine. Par déshydratation en milieu
acide, on obtient différents terpènes : Limonène, terpinolène,
g-terpinène, Isoterpinolène, α-terpinène. |
|
|
Molécule présente dans l'huile essentielle de
vétiver. |
|
|
ou Isonootkatone ou (4R,4aS)-4,4a-diméthyl-6-propanylid-2-ène-4,5,7,8-tétrahydro-3H-naphthalèn-2-one C15H22O Masse molaire: 218,335 g.mol-1 Fusion : 51,5°C Ebullition : 144°C (sous 2 mm de Hg) Densité: 1,003520/4 Indice de réfraction : nD: 1,537020 Solubilité : Soluble dans l'acétone. N° CAS : 15764-04-2 |
|
Molécule présente dans l'huile essentielle de
vétiver. |
|
C15H22O Masse molaire : 218,335 g.mol-1 Ebullition : 141°C (sous 2 mm de Hg) Fusion : 44,5°C Densité : 1,000120/4 Indice de réfraction : nD : 1,530920 Solubilité : Soluble dans l'acétone. N° CAS : 18444-79-6 |
|
Molécule présente dans l'huile essentielle de
vétiver. |
Annexe 2 : Quelques molécules odorantes aromatiques et
notamment phénoliques.
|
MOLECULES ODORANTES |
FORMULE
CHIMIQUE |
DES ORIGINES NATURELLES |
|
C9H10O2
Aspect : Liquide. Masse molaire : -51,3°C Ebullition : 213°C Densité : 1,0550 (à 20°C) Indice de réfraction : 1,5232(à 20°C) N° CAS : 140-11-4 Solubilité : Miscible à l'éthanol ; soluble dans l'éther, l'acétone, le
chloroforme ; légèrement soluble dans l'eau. |
|
·
Jasminum
officinale (Jasmin) L'acétate de benzyle constitue environ 20% de l'absolue de
jasmin. |
|
ou Acétate de 4-Allyl-2-méthoxyphényl C12H14O3
Aspect : Solide prismatique
(lorsque recristallisé dans l'éthanol), à odeur de clou de girofle. Masse molaire : 30,5°C Ebullition : 281°C ; 127°C à 6 mm
de Hg. Densité : 1,0806 (à 20°C) Indice de réfraction : 1,5205(à 20°C) N° CAS : 93-28-7 Solubilité : Soluble dans l'éthanol ; insoluble dans l'eau. |
|
·
Syzygium aromaticum
(famille des myrtacées) :
Giroflier. Phénol présent dans les clous de girofle ; constituant de
certains désinfectants utilisés pour les soins dentaires. Utilisé dans les parfums et cosmétiques. |
|
ou Acide benzènecarboxylique C7H6O2
Aspect : Cristaux en aiguilles
ou en feuilles. Masse molaire : 122,35°C Ebullition : 249,2°C Densité : 1,2659 (à 15°C) Indice de réfraction : 1,504 (à 132°C) N° CAS : 65-85-0 Solubilité : Très soluble dans
l'éthanol et l'éther ; soluble dans l'acétone, le benzène le chloroforme ;
légèrement soluble dans l'eau. |
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. ·
Styrax tonkinensis (Styrax benjoin ou benjoin) arbre originaire du
Siam. C'est dans la résine de cet arbre que l'on trouve de l'acide
benzoïque. ·
Vaccinium myrtillus (Canneberge) |
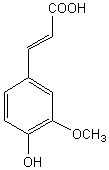
|
ou ou Acide 3-(3,4-dihydroxyphényl)- prop-2-énoïque Cristaux jaunes Masse molaire : 180,158 g.mol-1 225°C (se décompose) N° CAS : 331-39-5 Solubilité : Très soluble dans l'éthanol. |
Acide caféique
Acide 4-hydroxy (trans) cinnamique
Acide férulique |
Acide présent dans le café et de nombreuses plantes. Il présente deux fonctions phénol. L'acide caféique se forme naturellement dans les végétaux par
hydroxylation de l'acide 4-hydroxy (trans) cinnamique et se transforme en
acide férulique : |
|
Acide Ellagique Ebullition : 796,5°C Densité : 2,066 |
|
·
Vaccinium myrtillus (Canneberge) ·
Punica granatum (grenadier) ·
Fragaria vesca (fraisier) famille des rosacées. · Juglans regia (noyer commun) famille des juglandacées. Substance présente
dans les tanins (ellagitanins) produits par de
nombreux fruits ; composés solubles dans l'eau. |
|
C7H6O3
Aspect : Cristaux en plaques
(si recristallisé dans l'eau ou dans l'éthanol. Masse molaire : 214,5°C Densité : 1,46 (à 25°C) N° CAS : 99-96-7 Solubilité : Très soluble dans l'éthanol ; soluble dans l'acétone, et l'éther
; légèrement soluble dans l'eau. |
|
·
Myroxylon balsamum Arbre d'où l'on extrait le baume de Tolu en incisant le tronc.
Le baume de Tolu qui contient de l'acide 4-hydroxybenzoïque a une odeur de
vanille et de cannelle et un goût sucré de citron. Le nom de Tolu est celui d'une ville de Colombie (province de
Carthagène). |
|
ou Acide 2-hydroxybenzoïque C7H6O3
Aspect : Aiguilles (si
recristallisé dans l'eau) ; primes monocliniques (si recristallisé dans
l'éthanol. Masse molaire : 159°C Ebullition : 211 (sous 20 mm de Hg) Densité : 1,443 (à 20°C) Indice de réfraction : 1,565 N° CAS : 69-72-7 Solubilité : Très soluble dans l'éthanol, l'acétone, et l'éther ; légèrement
soluble dans l'eau, le benzène, le chloroforme. |
|
·
Filipendula ulmaria (Reine des près) de la famille des Rosacées. C'était une plante
sacrée pour les druides. Ses boutons
floraux contiennent de l'acide salicylique. ·
Salix
alba (Saule blanc) Arbre
poussant au bord de l'eau à écorce gris foncé profondément fissuré de la
famille des salicacées. C'est dans son écorce que l'on trouve l'acide
salicylique. |
|
C7H8O Aspect : Liquide Masse molaire : -15,4°C Ebullition : 205,31°C Densité : 1,0419 (à 24°C) Indice de réfraction : 1,5396 (à 20°C) N° CAS : 100-51-6 Solubilité : Soluble dans le benzène, l'acétone, l'éther l'éthanol, le
méthanol, le chloroforme, l'eau. |
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. C'est l'une des 26 substances allergènes dont la présence doit
être mentionnée dès lors que leurs concentrations dépassent 0,001% pour les
produits à ne pas enlever (crèmes....) et 0,01% pour les produits à enlever
par rinçage. (Directive européenne, JO du 11 mars 2003). |
|
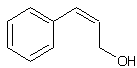
(trans) ou (trans)-3-phénylprop-2-èn-ol C9H10O Aspect : Aiguilles blanches à
odeur de jacinthe. Masse molaire : 34°C Ebullition : 257,5°C Densité : 1,0444 (à 20°C) Indice de réfraction : 1,5819 (à 20°C) N° CAS : 4407-36-7 Solubilité : Très soluble dans l'éther et l'éthanol ; légèrement soluble dans
le chloroforme, l'eau. Alcool cinnamique (cis) ou (cis)-3-phénylprop-2-èn-ol C9H10O Aspect : Aiguilles blanches à
odeur de jacinthe. Masse molaire : 34°C Ebullition : 257,5°C Densité : 1,0444 (à 20°C) Indice de réfraction : 1,5819 (à 20°C) N° CAS : 4510-34-3 Solubilité : Très soluble dans l'éther et l'éthanol. |
Alcool cinnamique trans
Alcool cinnamique cis |
·
Hyacinthoides
non-scripta (jacinthe sauvage) ·
Cinnamomum
verum (famille des lauracées) : Cannelier C'est l'une des 26 substances allergènes dont la présence doit
être mentionnée dès lors que leurs concentrations dépassent 0,001% pour les
produits à ne pas enlever (crèmes....) et 0,01% pour les produits à enlever
par rinçage. (Directive européenne, JO du 11 mars 2003). |
|
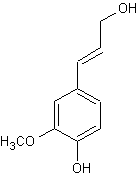
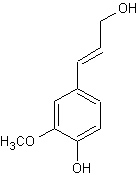
ou 4-(3-hydroxyprop-1-ènyl)-2-méthoxyphénol
Aspect : Cristaux prismatiques. Masse molaire : 74°C Ebullition : 458-35-5 Solubilité : Très soluble dans
l'éther ; soluble dans l'éthanol ; insoluble dans l'eau. |
Alcool coniférylique
Acide férulique |
·
Styrax tonkinensis (Styrax benjoin ou benjoin) arbre originaire du
Siam. C'est dans la résine de cet arbre que l'on trouve de l'alcool coniférylique. Partie aglycone d'un
hétéroside présent dans la sève des conifères. Il dérive tout comme l'acide
férulique du métabolisme de la phénylalanine et de la tyrosine et peut être
obtenu à partir de l'acide férulique par réduction. C'est un monolignol, un des monomères de la lignine. |
|
ou Benzènecarboxaldéhyde ou Benzaldéhyde C7H6O Aspect : Liquide à odeur
d'amande amère. Masse molaire : -57,1°C Ebullition : 178,8°C Densité : 1,0401 (à 25°C) Indice de réfraction : 1,5463 (à 20°C) N° CAS : 100-52-7 Solubilité : Miscible à l'éther, l'éthanol ; très soluble dans le benzène,
l'acétone ; légèrement soluble dans l'eau. |
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. ·
Prunus amygdalus amara Amandier sauvage à amande amère. |
|
ou (phénylméthylène)heptanal C14H18O Aspect : Huile jaune ayant une
odeur rappelant celle du jasmin.. Masse molaire : 80°C Ebullition : 174°C (sous 20mm de
Hg) Densité : 0,9711 (à 20°C) Indice de réfraction : 1,5381 (à 20°C) N° CAS : 122-40-7 Solubilité : Soluble dans l'acétone ; insoluble dans l'eau. |
|
·
Cinnamomum
verum (famille des
lauracées) : Cannelier. Présent dans la cannelle. Utilisé dans les parfums et les cosmétiques. |
|
Anéthole ou Anéthol 4-propenylanisole ou trans-1-méthoxy-4-(1-propényl)benzène liquide huileux incolore à odeur anisée. Masse molaire: N° CAS : 4180-23-8 Solubilité : Miscible à l'éthanol, l'éther ; très soluble dans le benzène ;
soluble dans l'acétone ; légèrement soluble dans l'eau. |
|
·
Pimpinella anisum (famille des
apiacées) : anis vert (l'huile essentielle contient 90% environ d'anéthole). ·
Foeniculum vulgare (famille des
apiacées) : fenouil ·
Illicium verum (famille des
magnoliacées) : Badianier ou Anis étoilé ·
Artemisia dracunculus (famille des Composées) : Estragon Sous l'action d'un photon (lumière) cette molécule s'isomérise et l'on
obtient l'isomère cis qui a un "goût de foin" désagréable. Pour
éviter cet inconvénient, certaines boissons anisées sont conditionnées
en bouteilles en verre teinté. |
|
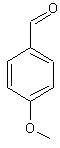
Ou p-anisaldéhyde ou 4-méthoxybenzaldéhyde C8H8O2 Masse molaire: N° CAS : 123-11-5 Solubilité : Miscible à l'éthanol,
l'éther ; très soluble dans l'acétone et le chloroforme ; soluble dans le
benzène ; insoluble dans l'eau. |
|
·
Pimpinella anisum (famille des
apiacées) : anis vert (l'huile essentielle contient 2% environ de 4-Anisaldéhyde). ·
Foeniculum vulgare (famille des
apiacées) : fenouil ·
Illicium verum (famille des
magnoliacées) : Badianier ou Anis étoilé. |
|
ou 2-aminobenzoate de
méthyle C8H8O2 Masse molaire: 24,5°C Ebullition: N° CAS : 134-20-3 Solubilité : Très soluble dans
l'éthanol et l'éther ; légèrement soluble dans l'eau. |
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. ·
Citrus bergamia (Bergamotier) C'est un composant de
l'huile essentielle de bergamote. ·
Citrus sp.
(orangers et citronniers, agrumes d'une façon générale). ·
Canaga odorata
(Ylang ylang, la fleur des fleurs) de la
famille des annonacées. Cette molécule est un
agent d’aversion gustative connu pour les oiseaux ; on sait par exemple
qu’ils ne consomment pas le raisin Concord à cause du goût de l’anthranilate de méthyle que ce raisin contient
naturellement. |
|
C14H12O2 Cristaux en aiguilles ou en feuillets, incolore à blanc à odeur
aromatique. Masse molaire: 21°C Ebullition: N° CAS : 120-51-4 Solubilité : Soluble dans l'acétone, l'éthanol, l'éther, le benzène, le
méthanol, le chloroforme. |
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. Utilisé dans les parfums et cosmétiques. |
|
Cinnamaldéhyde ou ou (E)3-phénylpropan-2-ènal C9H8O Aspect : Liquide jaune Masse molaire: -7,5°C Ebullition: N° CAS : 14371-10-9 Solubilité : Soluble dans
l'éthanol, l'éther, le chloroforme ; légèrement soluble dans l'eau. |
Cinnamal
Préparation à partir du
benzaldéhyde. |
·
Cinnamomum verum (famille des
Lauracées) : Cannelier Présent dans la cannelle. On peut le préparer en mélangeant en solution aqueuse alcaline, du
benzaldéhyde et de l'éthanal. Par condensation de Claisen-Schmidt
il se forme de l'aldéhyde cinnamique à condition d'optimiser les conditions
initiales pour n'obtenir que le
mono-adduit (ne pas mettre de benzaldéhyde en excès). |
|
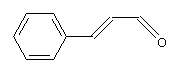
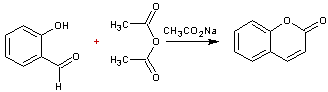
ou Benzo-α-pyrone ou 2H-1-benzopyrane-2-one C9H6O2 Aspect : Cristaux pyramidaux
orthorhombiques lorsque recristallisé dans l'éther. Masse molaire : 71°C Ebullition : 301,7°C Densité : 0,935 (à 20°C) N° CAS : 91-64-5 Solubilité : Très soluble dans l'éther, le chloroforme ; soluble dans l'eau
et l'éthanol. |
Coumarine
Sa synthèse peut être réalisée à partir de l'aldéhyde
salicylique et l'anhydride acétique (Condensation de Perkin). Ses dérivés peuvent aussi être synthétisés par condensation de Pechmann :
|
·
Dipteryx odorata (fève tonka) de la famille des fabacées. ·
Cinnamomum aromaticum (cannelle de chine). ·
Galium odoratum (Aspérule odorante) ·
Lavandula augustifolia vera (Lavande vraie). ·
Apium graveolens (céleri) ·
Trifolium sp. (trèfle) Agréable odeur de foin
coupé, elle est présente à l'état naturel dans le trèfle. Largement utilisée
comme parfum et agent de sapidité. Sa biosynthèse se fait
à partir de l'acide shikimique dans les végétaux
supérieurs. |
|
ou Liquide Masse molaire : 164,201 g.mol-1 -7,5 °C 253,2 °C Densité : 1,0652 à 20 °C 1,5405 à 20 °C N° CAS : 97-53-0 Solubilité : |
|
·
Syzygium aromaticum (famille des myrtacées) : Giroflier. Phénol présent dans les clous de girofle ; constituant de certains
désinfectants utilisés pour les soins dentaires. |
|
ou Pipéronal ou 1,3-benzodioxole-5-carboxaldéhyde C8H6O3 N° CAS : 120-57-00 Solubilité : Miscible à l'éther ; très soluble dans l'éthanol ; soluble dans l'acétone
et le chloroforme ; légèrement soluble dans l'eau. Risques : |
|
Molécule à odeur douce,
fleurie, légèrement épicée, présente à l'état naturel dans vanilla tahitensis (vanille
de Tahiti). Elle a été synthétisée par Eijkmann et Poleck en 1885-1886. Elle est incorporée dans des parfums "ambrés orientaux" comme
Shalimar * de Guerlain (1925). * Shalimar ("temple
d'amour") fait référence aux jardins de Shalimar à Lahore, au Pakistan. |
|
ou 2-(phénylméthylidène)octanal C15H20O Masse molaire : 216,32 g.mol-1 175 °C (sous 15 mm de Hg) Densité : 0,95 1,55 N° CAS : 101-86-0 Risques : R 34 S 26-36/37/39-45 |
|
·
Chamaemelum nobile (famille des
composées) : Camomille romaine. ·
Matricaria recutita
(famille des composées) : Camomille allemande. On trouve l'hexylcinnamal dans les huiles
essentielles de ces plantes. |
|
ou Cis-2-méthoxy-4-prop-1-énylphénol ou Cis-1-(4-hydroxy-3-méthoxyphényl)prop-1-ène. C10H12O2 Masse molaire : 164,201 g.mol-1 134 °C (sous 13 mm de Hg) Densité : 1,0837 ( à 20°C) 1,5726 (Raie D du sodium et 20°C) Risques : Trans-Isoeugénol ou Trans-2-méthoxy-4-prop-1-énylphénol ou Trans-1-(4-hydroxy-3-méthoxyphényl)prop-1-ène. C10H12O2 Masse molaire : 164,201 g.mol-1 33,5°C Ebullition : 141 °C (sous 13 mm de Hg) Densité : 1,0837 ( à 20°C) 1,5784 (Raie D du sodium et 20°C) Solubilité : Soluble dans l'éthanol, l'éther, le chloroforme ; légèrement soluble dans
l'eau. Risques : |
On peut à partir de
cette molécule
synthétiser la
vanilline en trois étapes:
Cis Isoeugénol
Trans Isoeugénol |
·
Syzygium aromaticum (famille des myrtacées) : Girolflier. Phénol présent dans les clous de girofle ; constituant de certains
désinfectants utilisés pour les soins dentaires. Utilisé dans les parfums et
les cosmétiques. |
|
ou 5-(2-propènyl)-1,3-benzodioxole C10H10O2 Aspect : Cristaux
monocliniques. Masse molaire : 11,2°C Ebullition : 234,5°C Densité : 1,1000 (à 20°C) Indice de réfraction : 1,5381 (à 20°C) N° CAS : 94-59-7 Solubilité : Très soluble dans l'éthanol ; miscible au chloroforme, à l'éther
; insoluble dans l'eau. |
|
·
Sassafras albidum On extrait le safrole
de l'écorce du tronc et du fruit de cet arbre qui pousse au nord-est de
l'Amérique. ·
Ocotea pretiosa On peut extraire le safrole
de l'huile obtenue à partir de cette plante qui pousse au Brésil. Cette molécule a longtemps été utilisée en
parfumerie. Elle est aujourd'hui interdite. |
|
ou 2-isopropyl-5-méthylphénol C10H14O Aspect : Cristaux incolores. Masse molaire : 49,5°C Ebullition : 232,5°C Densité : 0,970 (à 25°C) Indice de réfraction : 1,5227 (à 20°C) N° CAS : 89-83-8 Solubilité : Très soluble dans l'éthanol, l'éther, le chloroforme, l'acétate
d'éthyle ; insoluble dans l'eau. Risques :
|
Thymus vulgaris |
·
Thymus vulgaris (Thym) Phénol présent notamment dans l'huile
essentielle de thym. |
|
ou Vanilline ou 4-hydroxy-3-méthoxyphénylméthanal 152,148 g.mol-1 81,5 °C 285°C ; 170 °C (sous 15 mm de mercure) Densité : 1,056 à 25°C. Solubilité : Très soluble dans l'éthanol, l'éther, l'acétone ; soluble dans
le benzène ; légèrement soluble dans l'eau. N° CAS : 121-33-5 |
Vanillal : c'est
un aldéhyde phénolique.
Fleur du vanillier
|
·
Vanilla planifolia de la famille des Orchidacées (orchidée charnue qui porte au
printemps des fleurs cireuses pâles, parfumées, puis des gousses pendantes). Parfum alimentaire que l’on peut extraire du fruit du vanillier
sous forme d'une essence par macération des gousses dans l'éthanol. La pollinisation de la fleur de vanille est
impossible sans intervention extérieure. Il existe en effet une fine
languette qui empêche le contact entre étamines et pistil donc la
fécondation. Les photographies
ci-contre montrent respectivement la fleur du vanillier et comment l’homme
assure manuellement sa fécondation à la Réunion. |
Annexe 3 :
|
MOLECULES ODORANTES |
FORMULE
CHIMIQUE |
DES ORIGINES NATURELLES |
||||||||
|
C10H10O3 Aspect : Poudre blanche ou blanc cassé Masse molaire : 178,1846 g.mol-1 Fusion : 38°C N° CAS : 28940-11-6 Solubilité : Soluble dans l'éthanol ; insoluble dans l'eau. |
|
Molécule utilisée en parfumerie pour donner une note
marine au parfum (odeur fraîche, marine,légèrement
anisée et iodée, de melon et de pastèque). Elle a été crée
artificiellement en 1966 par les laboratoires Pfizer. |
||||||||
|
ou 3-(m-cuményl)butanal ou 3-(3-propan-2-ylphényl)butanal C13H18O Aspect : Liquide incolore ou légèrement
jaune. Masse molaire : 190,2814 g.mol-1 Ebullition : 251,3°C Densité : 0,935 N°CAS : 125109-85-5 |
|
Composé utilisé en parfumerie. Il possède une odeur très
florale (muguet, jacinthe) ; il est également utilisé dans les parfums pour
des produits de blanchisserie où une odeur résiduelle fraîche est désirée. |
||||||||
|
C'est un mélange de deux isomères: Dihydrojasmonate de méthyle (cis) et Dihydrojasmonate
de méthyle (trans) C13H22O3 Aspect : Liquide huileux transparent jaune. Masse molaire : 226,35 g.mol-1 307,8°C Densité : 0,984 à 25°C. N° CAS : 24851-98-7 Sécurité : |
Stéréo-isomérie du dihydrojasmonate
de méthyle Les 4 stéréo-isomères du dihydrojasmonate
de méthyle sont les suivants :
On peut les grouper de la manière suivantes :
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. Les dihydrojasmonates de méthyle ont été étudiés, isolés,
synthétisés entre 1962 et 1965 par Demole et la
société Firmenich. |
||||||||
|
3-méthyl-2-(2pentényl)-2- Aspect : Huile jaune à odeur de céleri rappelant le jasmin lorsqu'elle est diluée. 164,244 g.mol-1 258°C ou 134-135°C
(sous 12 mm de Hg) 0,943722/4 1,4979 (à 22°C) N° CAS : 488-10-8 Risques : |
|
·
Jasminum
officinale (Jasmin) L'huile essentielle tirée de cet arbuste à feuilles caduques et
fleurs blanches très parfumées en contient. Cette cétone peut-être synthétisée ; elle contient alors
également l'isomère trans (ou E). Seul l'isomère cis (ou Z) existe dans la nature. |
||||||||
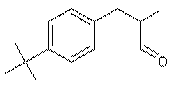
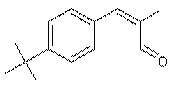
|
Ou Lily aldéhyde Ou Butylphénylméthylpropional Ou 2-méthyl-3-(4-tertiobutylphényl)propanal C14H20O Aspect : Liquide clair ou légèrement jaune. 204,30 g.mol-1 279°C 0,946 1,505 N° CAS : 80-54-6 Risques :
|
|
Produit de synthèse souvent présent comme parfums des produits
de nettoyage. Cette synthèse peut être conduite à partir du composé suivant :
C'est l'une des 26 substances allergènes
dont la présence doit être mentionnée dès lors que leurs concentrations
dépassent 0,001% pour les produits à ne pas enlever (crèmes....) et 0,01%
pour les produits à enlever par rinçage. (Directive européenne, JO du 11 mars
2003). |
||||||||
|
ou Méthyl octyne "carbonate" C10H16O2 Masse molaire : 168,26 g.mol-1 Densité : 0,932 N° CAS : 111-80-8 |
|
Molécule synthétique à
odeur fine de violette, très utilisée en parfumerie pour donner une note
florale ; c'est aussi un agent de saveur. |
||||||||
|
C12H24O Aspect : Liquide incolore ou légèrement pâle à odeur se rapprochant de celle de
l'orange et de l'ambre
gris. 184,318 g.mol-1 119°C (sous 16 mm de
Hg) ; 114°C (sous 10 mm de Hg). 0,83215/4 1,4321 (à 20°C) N° CAS : 110-41-8 Solubilité : |
|
·
Fortunella sp. Arbres originaires de Chine subtropicale, de hauteur 3 à 4m à
croissance assez forte, ayant un feuillage vert sombre, dense, pratiquement
sans épine, de très nombreuses petites fleurs en mai/juin/juillet donnant de
nombreux petits fruits (agrumes) ovales ou ronds, les kumquats. On extrait de
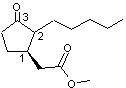
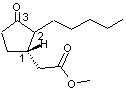
leur peau de l'huile essentielle renfermant du 2-méthylundécanal. C'est le produit de synthèse qui est utilisé en parfumerie.
C'est un des premiers aldéhydes synthétiques introduits dans un grand parfum
en 1921 : N°5 de Chanel. |
||||||||
|
ou Arborone C16H26O Aspect : Liquide incolore ou jaune pâle. Masse molaire : 234,377 g.mol-1 312,2°C (sous 760 mm de Hg). 0,965 N° CAS : 54464-57-2 Solubilité : Insoluble dans l'eau ; soluble dans l'éthanol, l'éther, l'acétone. |
|
L’iso E Super ® est un
mélange odorant d’origine synthétique qui a été utilisé dans la fabrication
de plusieurs parfums très connus, comme « Trésor », « Dolce Vita » ou encore
« Féminité du Bois ». Il apporte aux créations parfumées une sensation boisée
inédite, qui est en fait principalement due à une molécule bicyclique appelée
arborone -du latin arbor
- qui possède une odeur très intense. C’est ce qu’ont prouvé des chercheurs
de l’entreprise Givaudan-Roure en effectuant la
première synthèse de l’arborone. En 2006, E. J.
Corey, prix Nobel de chimie 1990, a montré en synthétisant les deux antipodes
de l’arborone, qu’uniquement l’un deux (la (+)-arborone), est capté par l’odorat humain à des seuils
inférieurs à 1 pg·L −1. Extrait du sujet de
chimie du concours d'entrée à l'Ecole Polytechnique 2007. Molécule obtenue par synthèse à odeur suave,
boisée, rappelant la violette et l'ambre gris. Elle est utilisée dans l'industrie des parfums
comme note de cœur et de fond. |
Annexe 4 :
Quelques muscs
|
Musc
xylol |
2,4,6-trinitro-1,3-diméthyl-5-tertiobutylbenzène |
|
|
Musc
cétone |
4'-tertiobutyl-2',6'-diméthyl-3',5'-dinitroacétophénone |
|
|
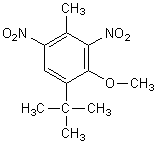
4-tertiobutyl-2,6-dinitro-3-méthoxytoluène |
|
|
|
5-tertiobutyl-1,2,3-triméthyl-4,6-dinitrobenzène |
|
|
|
2,3-dihydro-1,1,3,3,5-pentaméthyl-4,6-dinitro-1H-Indène |
|
|
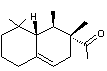
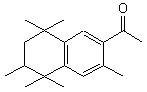
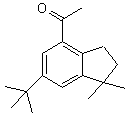
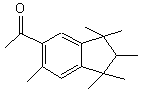
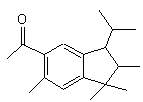
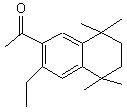
C18H26O N° CAS : 1506-02-1 |
1-(5,6,7,8-tétrahydro-3,5,5,6,8,8-hexaméthyl- |
|
|
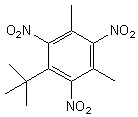
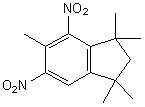
C17H24O Aspect : Solide blanc. 244,37186 g.mol-1 Fusion : 69°C 309,1°C 0,83215/4 1,508 N° CAS : 13171-00-1 |
4-acétyl-6-tertiobutyl-1,1,diméthylindane |
|
|
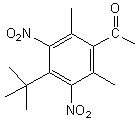
C17H24O Aspect : Solide cristallisé blanc. 244,37186 g.mol-1 Densité : 0,928 Ebullition : 336,6°C N° CAS : 15323-35-0 |
5-acétyl-1,1,2,3,3,6-hexaméthylindane |
|
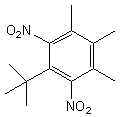
|
C18H26O Masse molaire : 258,3984 g.mol-1 Densité : 0,933 Ebullition : 350°C N° CAS : 68140-48-7 |
5-acétyl-3-isopropyl-1,1,2,6-tétraméthylindane |
|
|
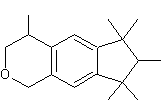
C18H26O Aspect : Liquide visqueux incolore. Masse molaire : 258,4 g.mol-1 N° CAS : 1222-05-5 Solubilité : Pratiquement insoluble dans l'eau (1,75 mg/L) |
1,3,4,6,7,8-hexahydro-4,6,6,7,8,8-hexaméthylcyclopenta-g- 2-benzopyrane. C'est une substance à
odeur de musc, florale, boisée, à longue persistance, utilisée dans les
parfums, mais aussi dans la cosmétique (savons, sels de douche, déodorants,
crèmes, lotions, shampooings, après-rasage) et les lessives et produits de
nettoyage. |
|
|
1,1,4,4-tétraméthyl-6-éthyl-7-acétyl-1,2,3,4- |
|
|
|
2,4-Diméthyl-2- |
|
|
3-méthylcyclopentadécanone |
|
|
|
Cyclopentadécanone |
|
|
|
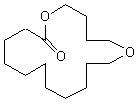
1,6-dioxacycloheptadécan-7-one |
|
|
|
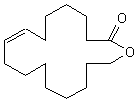
(Z)-Oxacycloheptadéc-8-én-2-one |
|
|
|
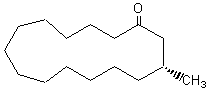
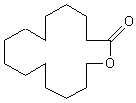
ou Oxacyclohexadécan-2-one C15H28O2 Masse molaire : 240,382 g.mol-1 Aspect : Huile épaisse Ebullition : 176°C (sous 15 mm de Hg) Densité : 0,9549 (à 20°C) Indice de réfraction : 1,4708 (à 20°C) |
Oxacyclohexadécan-2-one |
|
|
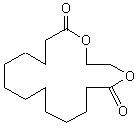
ou Brassylate d'éthylène C15H26O4 270,37 g.mol-1 Fusion : 140°C Densité : 1,042 1,47 N° CAS : 105-95-3 Risques :
|
1,4-dioxacycloheptadécan-5,17-dione |
|
|
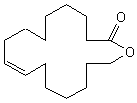
Oxacycloheptadéc-10-én-2-one |
|
|
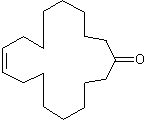
|
(Z)-9-cycloheptadecén-1-one |
|
|
|
5-cyclohexadécénone |
|
|
|
1,4-dioxacyclohexadécane-5,16-dione |
|
Annexe 5 :
Huile essentielle de
lavande : L'huile essentielle
extraite de ses fleurs est utilisée en parfumerie, mais aussi comme
antiseptique, sédatif, antalgique sur les piqûres d'insectes. Le tableau
ci-dessous donne la composition obtenue par CPV de trois échantillons : Lavandula augustifolia
ou officinalis
: c'est la lavande fine ; Lavandula hybrida
: c'est le lavandin ; Lavandula latifolia ou spica : c'est la lavande aspic.
|
Lavande fine |
Lavandin |
Lavande aspic |
|
|
Nom latin |
Lavandula augustifolia |
Lavandula
hybrida |
Lavandula latifolia |
|
Densité (20°C) |
0,8794 |
0,8887 |
0,9091 |
|
Pouvoir rotatoire
(20°C) |
-9° |
-4,90° |
+3,40° |
|
Indice de réfraction nD20 |
1,4618 |
1,4621 |
1,4662 |
|
Composition (%) : |
|||
|
35,90 |
30,76 |
2,3 |
|
|
25,20 |
31,57 |
27,3 |
|
|
7,20 |
0,73 |
- |
|
|
5,00 |
2,28 |
1,55 |
|
|
Acétate de lavandulyle |
4,00 |
1,10 |
0,30 |
|
3,50 |
3,10 |
0,65 |
|
|
3,30 |
0,29 |
- |
|
|
0,90 |
<0,05 |
- |
|
|
0,70 |
0,55 |
0,25 |
|
|
0,60 |
2,34 |
2,50 |
|
|
Acétate de néryle |
0,60 |
0,43 |
- |
|
0,40 |
4,30 |
25,50 |
|
|
0,35 |
0,44 |
0,6 |
|
|
0,25 |
0,63 |
1,8 |
|
|
0,18 |
0,22 |
1,0 |
|
|
0,18 |
0,30 |
- |
|
|
0,18 |
6,45 |
18,5 |
|
|
0,16 |
0,08 |
- |
|
|
Acétate de géranyle |
0,16 |
0,36 |
- |
|
0,16 |
0,79 |
0,30 |
|
|
0,09 |
0,37 |
0,80 |
|
|
0,09 |
0,14 |
- |
|
|
0,08 |
0,37 |
1,95 |
|
|
0,04 |
0,14 |
0,60 |
Les composants les plus
abondants de chacun des trois échantillons ont été surlignés. On s'aperçoit que
le linalol est présent en grande quantité dans les trois types de lavande.
C'est le constituant principal ; ceci est renforcé par le fait que sous forme
d'ester (acétate de linalyle) il apparaît aussi en
grande quantité dans deux des trois échantillons : la lavande fine et le
lavandin. Cette composition varie en fonction des sols et du climat. On peut
cependant donner les intervalles entre lesquels ces compositions varient pour
les principaux constituants ; l'odeur de la lavande fine est beaucoup plus
légère, fine, agréable que celle du lavandin et de la lavande aspic ; ceci est
principalement dû à l'absence de camphre.
|
Caractéristiques |
Compositions en masse
(en %) |
|||
|
Constituant |
Température
d'ébullition |
Lavande fine |
Lavandin |
Lavande aspic |
|
220°C |
25-45 |
28-38 |
Traces-3 |
|
|
198°C |
25-38 |
24-35 |
25-50 |
|
|
176,4°C |
Traces-1 |
4-7 |
20-35 |
|
|
207,4°C |
Traces-0,5 |
6-8 |
8-20 |
|
|
177°C |
4-10 |
0,5-1,5 |
- |
|
|
177°C |
1,5-6 |
Traces-1 |
- |
|
Huile essentielle de
thym :
Composition de l'huile
essentielle de Thymus vulgaris L (Analyse par chromatographie en phase vapeur)
:
|
26,20% |
1,24% |
Trans-sabinène hydraté |
0,43% |
||
|
25,40% |
Thymol méthyl éther |
1,10% |
0,36% |
||
|
12,00% |
0,98% |
0,30% |
|||
|
11,30% |
0,73% |
0,27% |
|||
|
Thymoquinone |
10,42% |
0,72% |
0,20% |
||
|
2,70% |
0,60% |
|
|
||
|
2,33% |
g-Murolène |
0,46% |
Total |
99,69% |
|
|
1,50% |
0,45% |
Composés indéterminés |
0,31% |
Huile essentielle de Patchouli : Extraite des feuilles de Pogostemon cablin (famille des lamiacées) que l'on
trouve en Indonésie, à Java, Sumatra (nom local Pucha-put)
et en Chine. La distillation est menée pendant 20 à 24 heures. Le Pogostemon cablin est
une plante à tiges quadrangulaires dressées aux feuilles molles ovales à odeur
pénétrante de cèdre due à plusieurs molécules dont le patchoulol.
Huile essentielle de Vétiver : Le vétiver (Chrysopogon zizanioides ou Vetiveria zizanioides de la famille des poacées ) est une plante vivace à grosses tiges
et longues feuilles formant des touffes denses et originaire de l'Inde et du
Népal (nom local khus khus).
L'huile essentielle obtenue par hydrodistillation des rhizomes est un liquide
épais marron à verdâtre et à odeur terreuse, douce, herbacée. Cette huile
contient de nombreuses molécules dont un acide indésirable en parfumerie, l'acide zizanoïque et des
alcools dont deux sont des critères de qualité : l'isovalencénol et le khusimol ; on note aussi l'α-vétivone, la β-vétivone, l'α-vétivérone….Le vétiver bourbon est recherché en
parfumerie.
![IMG_1814 [Résolution de l'écran].JPG](PARFUMS_fichiers/image286.jpg)
Huile essentielle de
petit grain : huile essentielle
obtenue à partir des jeunes rameaux de bigaradier (Citrus aurantium "l'oranger
amer") ; par extension on appelle huile essentielle de petit grain des
huiles essentielles obtenues par hydrodistillation des feuilles d'oranger, de
citronnier, de mandarinier, de bergamotier.
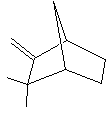
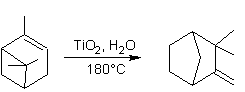
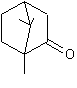
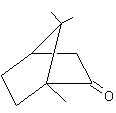
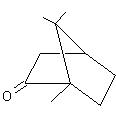
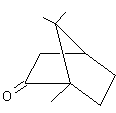
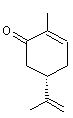
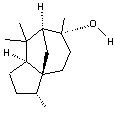
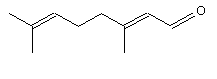
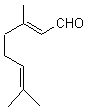
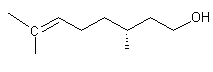
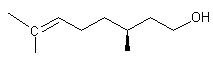
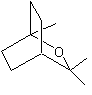
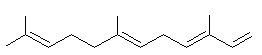
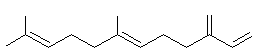
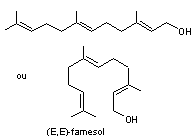
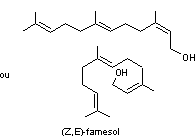
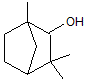
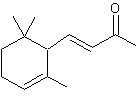
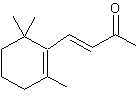
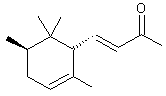
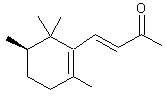
![IMG_1800 [Résolution de l'écran].JPG](PARFUMS_fichiers/image103.jpg)