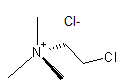AMMONIUMS QUATERNAIRES
Gérard GOMEZ
Plan de
l'étude
1) Définitions
1-1) L'ion
ammonium
1-2) Les ions ammoniums
primaires, secondaires et tertiaires
1-3) Les
ammoniums quaternaires
2) Propriétés chimiques des ammoniums
quaternaires
3) Utilisations
4) Quelques ammoniums quaternaires
1) Définitions :
1-1) L'ion ammonium
:
L'ion
ammonium est le cation NH4+qui se forme lorsqu'on place
l'ammoniac en présence d'un acide protonique :
![]()
1-2) Les ions
ammoniums primaires, secondaires et tertiaires :
Un ion
ammonium substitué est le cation qui se forme lorsqu'on place une amine
primaire (I), secondaire (II) ou tertiaire (III) en milieu acide :
- amine (I) :
![]()
R- étant un
radical alkyle ou aryle.
L'ion obtenu
est alors qualifié d'ion ammonium primaire.
- amine (II) :
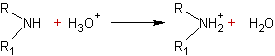
C'est un
ammonium secondaire.
- amine (III) :
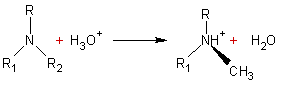
C'est un
ammonium tertiaire.
1-3) Les
ammoniums quaternaires :
Si on fait
réagir une amine tertiaire sur un composé halogéné on obtient un sel d'ammonium
quaternaire :
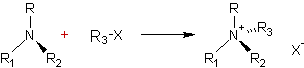
Une telle
réaction correspond à une quaternarisation de l'amine (III).
Remarque 1 :
Dans le
cation obtenu que l'on appelle ammonium quaternaire, les groupes R, R1,
R2, R3 peuvent être identiques ou différents ; ils
peuvent être des groupes alkyles ou aryles ou des groupements plus complexes.
Remarque 2 :
Alors que si
l'on traite les ammoniums (I), (II) ou (III) par une base on retrouve les
amines qui leur ont donné naissance, rien de tel ne se produit en traitant un
ammonium quaternaire par une base.
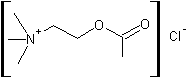
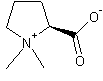
Un exemple
d'ammonium quaternaire :
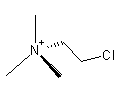
Chlormequat
2) Propriétés chimiques des ammoniums quaternaires :
Les
ammoniums quaternaires que l'on désigne
parfois par "quats" se présentent sous forme de sels neutres ; ce
sont des solides cristallins généralement hygroscopiques.
Leur
réaction principale est la suivante :
En présence
d'une base forte les ammoniums quaternaires se décomposent pour donner un
alcène :
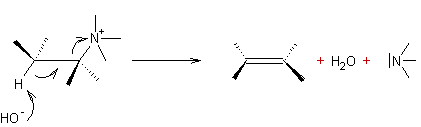
Exemple 1 :
![]()
Exemple 2 :
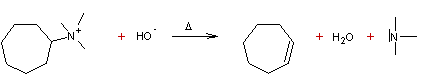
C'est
l'élimination d'Hofmann.
Cette
réaction a souvent été utilisée pour déterminer la structure de composés azotés
naturels, les alcaloïdes notamment.
On procède
préalablement à une méthylation complète de l'amine par un excès d'iodométhane,
puis on traite l'ammonium quaternaire obtenu par Ag2O en présence
d'eau (qui produit HO-) ; cela conduit à l'hydroxyde d'ammonium
quaternaire. On chauffe enfin :
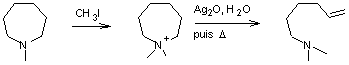
On peut
ensuite continuer :
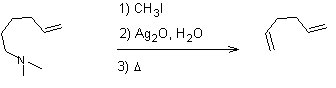
Remarque 1 :
Cette
réaction ne peut pas, bien sûr, s'appliquer à (CH3)4N+.
Remarque 2 :
Comme le montre
le mécanisme de cette réaction, un des carbones en β de l'azote de
l'ammonium quaternaire doit être lié à au moins un atome d'hydrogène.
3) Utilisations :
On utilise
les ammoniums quaternaires comme tensioactifs, agents antistatiques et
adoucissants pour machines à laver et comme désinfectants,.
Ce sont des
désinfectants ayant un bon pouvoir mouillant, une très grande stabilité ; ils
ne sont pas corrosifs et peuvent être utilisés dans une grande plage de pH.
Leur
efficacité comme désinfectants résulte de l'association de leurs propriétés
tensioactives (abaissement de la tension superficielle ; ce sont des
tensioactifs cationiques) et de leur polarité. Ils induisent des lésions
membranaires des cellules. L'absorption des ammoniums quaternaires à la surface
des cellules perturbe la perméabilité de la paroi ; cette paroi finit par être
détruite et conduit à la destruction de la cellule. Ils ont un large spectre
d'activité : bactéricide, fongicide, virulicide, sporicide. A noter qu' ils ont
une activité insuffisante contre Mycobacterium tuberculosis.
Ils
détruisent plus facilement les Gram + c'est-à-dire les bactéries à paroi
cellulaire simple.
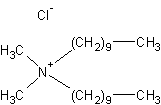
Ils sont
interdits dans l'industrie laitière car ils sont difficiles à rincer, sauf le
chlorure de didécyl-diméthyl-ammonium.
4) Quelques
ammoniums quaternaires :
|
|
|
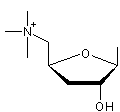
Acétylcholine (chlorure d') C7H16
ClNO2 181,661
g.mol-1 150°C N° CAS : 60-31-1 Solubilité : Soluble
dans l'eau et l'éthanol ; insoluble dans l'éther. |
|
Un des
premiers neurotransmetteurs identifié dans le cerveau. |
|
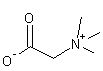
ou N,N,N-triméthylglycine C5H11NO2 Aspect : Cristaux
en prismes ou en feuilles (lorsque recristallisés dans l'éthanol). Masse
molaire : 117,147
g.mol-1 Fusion : 293°C
(décomposition) Solubilité : Très soluble
dans l'eau et le méthanol ; soluble dans l'éthanol ; légèrement soluble dans
l'éther et le chloroforme. N° CAS : 107-43-7 |
|
Acide
aminé, sous forme de zwittérion que l'on trouve en particulier dans les
racines de betterave (Beta vulgaris). C'est par
perméthylation de la glycine
que se forme la bétaïne ; L'oxydation de la choline
conduit aussi à la bétaïne. Remarque : Plus
généralement on donne le nom de bétaïnes aux composés du type
|
|
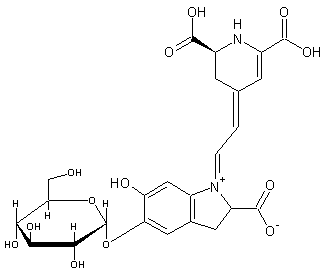
Bétanine Rouge de betterave ou Bétacyanine C24H26N2O13 Masse molaire : 550,48 g.mol-1 N° CAS : 7659-95-2 |
|
Hétéroside du D-glucose (sa partie aglycone c’est-à-dire sans le
glucose étant la bétanidine). Constitue environ 90% du colorant rouge de la
betterave (Beta vulgaris L.var.rubra).
Un des rares colorants rouges naturels qui n’est pas anthocyane. On trouve également ce
colorant dans la figue de barbarie. C’est un colorant alimentaire noté E162, qui est parfaitement toléré
par l’organisme (non toxique) et partiellement rejeté dans les urines. |
|
|
Colorant alimentaire répertorié sous le code E131,de couleur bleu cyan
utilisé dans les boissons. |
|
|
C21H30NO4+
Br- Aspect : Solide cristallisé blanc Masse molaire : 440,37 g.mol-1 Fusion : 143°C N° CAS : 149-64-4 Solubilité : 50g/L dans l'eau Risques : |
|
Anticholinergique, c'est-à-dire que cette molécule réduit les effets de
l'acétylcholine lorsque celle-ci joue le rôle de médiateur dans le système
nerveux central et le système nerveux périphérique. Elle est un dérivé semi-synthétique de la scopolamine. |
|
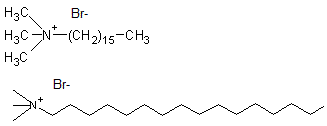
Cétyltriméthylammonium
(bromure de) ou Bromure d'hexadécyltriméthylammonium C19H42BrN Aspect : Poudre blanche Masse molaire : 364,45 g.mol-1 Fusion : 240°C N° CAS : 57-09-0 |
|
C'est un tensioactif cationique, utilisé comme agent antiseptique
contre les bactéries et les champignons. Il est aussi utilisé comme produit conditionneur de cheveux. |
|
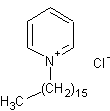
Cétylpyridinium
(chlorure) ou Chlorure de 1-Hexadécylpyridinium C21H38NCl Aspect : Poudre blanche à odeur semblable à celle de la pyridine. Masse molaire : 399,987 g.mol-1 Fusion : 80°C Solubilité : Très soluble dans l’eau et le chloroforme. N° CAS : 123-03-5 Solubilité : Insoluble dans l’acétone, l’acide acétique, l’éthanol. |
|
Molécule utilisée aussi sous forme monohydratée. Antiseptique associé au lysozyme en traitement local d’appoint
antibactérien des affections de la gorge. Le lysozyme est un agent de défense
naturel de l’organisme ; c'est une protéine existant dans le blanc d’œuf, qui
détruit les parois des cellules des bactéries en hydrolysant les liaisons
β(1->4) des unités glucose. |
|
Chlormequat (chlorure de) ou Chlorure de 2-chloroéthyltriméthylammonium C5H13Cl2N Masse molaire : 158,069 g.mol-1 Fusion : 239°C (se décompose) N° CAS : 999-81-5 |
|
Régulateur de croissance végétale utilisé pour inhiber l'allongement
des plantes ornementales et du blé d'hiver. |
|
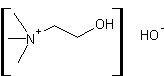
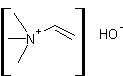
Hydroxyde de triméthyl(2-hydroxyéthyl)ammonium . |
|
Base forte très soluble dans l'eau. Elle entre dans la composition des lécithines. |
|
C18H36N2O2 Masse molaire : 311 g.mol-1 |
|
Molécule (ayant une fonction amide et une fonction ammonium
quaternaire) isolée d'Eurythoe complanata, qui produit une
inflammation de la peau et des muqueuses lorsque celles-ci entrent en contact
avec elle. Eurythoe complanata est un ver polychète encore appelé ver de
feu, de couleur rose à orange et gris, de quelques centimètres en général,
assez commun et qui peut se retrouver dans un aquarium d'eau de mer. |
|
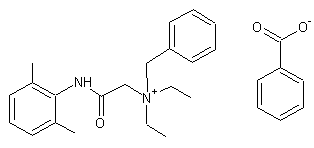
C28H34N2O3 Aspect : Solide blanc inodore Masse molaire : 446,5812 g.mol-1 Fusion : 168°C N° CAS : 3734-33-6 Solubilité : Très soluble dans l'eau ; soluble dans l'éthanol, le méthanol, le
butanol, l'isopropanol, le chloroforme. Risques :
|
|
Substance obtenue par synthèse, de structure voisine de celle de la lidocaïne (cette
molécule a un groupement benzyle supplémentaire sur l'atome d'azote de la
fonction amine de la lidocaïne). A été découverte en 1958 lors de recherches sur les anesthésiques. Son
goût très amer fait qu'on l'utilise pour prévenir l'ingestion des produits
ménagers et des antigels. On l'utilise aussi en vernis à ongles contre
l'onychophagie (habitude compulsive de se ronger les ongles) et pour
dénaturer l'éthanol (d'où son nom "dénatonium"). Ce corps est aussi amer que la quassine composé
naturel le plus amer connu à ce jour. |
|
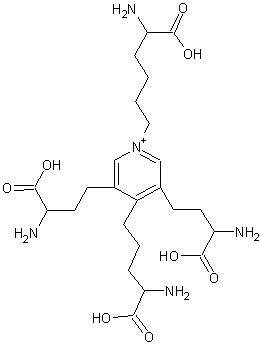
C24H40N5O8 Masse molaire : 526,6031 g.mol-1 N°CAS : 11003-57-9 |
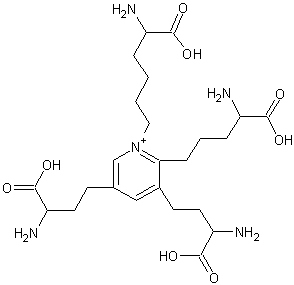
Isodesmosine
|
Acide aminé rare trouvé dans l'élastine, constitué de 4 molécules de lysine condensées en un anneau
pyridinium. La desmosine contribue à l'élasticité de l'élastine en formant des
connexions entre les différentes fibres. |
|
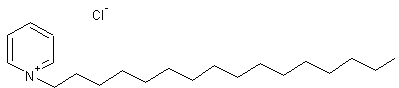
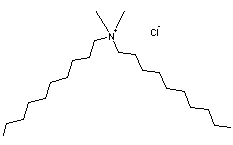
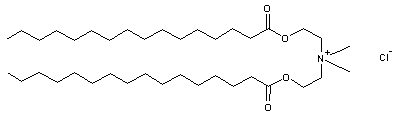
(chlorure de) C22H48ClN Masse molaire : 362,076 g.mol-1 Densité : 0,95 N° CAS : 7173-51-5 Risques :
|
|
Biocide à large spectre utilisé comme désinfectant, antiseptique,
antibactérien, antifongique, algicide…. |
|
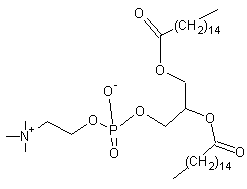
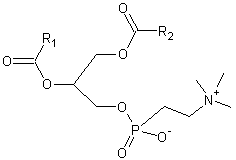
Dipalmitoylphosphatidylcholine ou DPPC C40H80NO8P Masse molaire : 734,039 g.mol-1 N° CAS : 2644-64-6 |
|
C'est un phospholipide ; il permet en jouant son rôle de tensioactif la
formation d'un film superficiel revêtant toute la surface alvéolaire des poumons
; il facilite ainsi l'expansion des alvéoles à l'inspiration et les maintient
ouvertes pendant l'expiration. Il joue aussi un rôle dans la perméabilité
alvéolaire et dans le mécanisme de défense contre les microorganismes. |
|
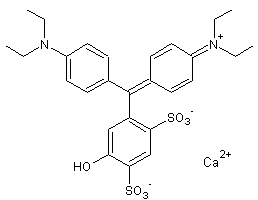
ou Acide blue 9 ou Brilliant blue FCF C37H34N2O9S3
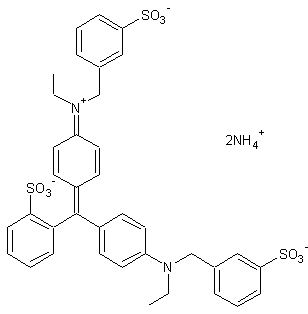
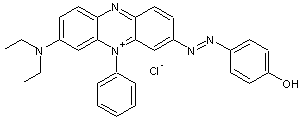
(NH4)2 Aspect : Poudre d'un bleu violine (λmax = 630 nm). Masse molaire : 782,96 g.mol-1 Fusion : 283°C (se décompose) N° CAS : 2650-18-2 Solubilité : Soluble dans l'eau. Remarque : Cette molécule existe aussi avec le sodium comme cation. |
|
Cette molécule est utilisée comme colorant alimentaire (E133) dans les
produits laitiers, les glaces, mais aussi en cosmétique (savons,
schampooings….). C'est un composé synthétique d'un bleu intense (C.I. 42090). Il est aussi employé en agriculture ; pour optimiser (c'est-à-dire pour
ne pas mettre en excès) les phytocides (désherbants, débroussaillants,
défanants, anti- germes) répandus, on ajoute une solution à 50%
d'érioglaucine au phytocide ce qui permet aux opérateurs de repérer
rapidement, grâce à la couleur bleue, la zone où a eu lieu l'application ; le
colorant sert alors de marqueur. Lors de la préparation de la solution
d'érioglaucine on a ajouté du peroxyde d'hydrogène (H2O2)
et sous l'action combinée de cette substance et des U.V. de la lumière solaire,
quand le phytocide a été répandu, l'érioglaucine se décompose et la couleur
disparaît. |
|
C10H16ClNO Aspect : Cristaux. Masse molaire : 201,693 g.mol-1 Fusion : 162°C Solubilité : Très soluble dans l'eau ; soluble dans l'éthanol ; insoluble dans
l'éther. le chloroforme. N° CAS : 116-38-1 |
|
C'est un inhibiteur de l'acétylcholinestérase, d'action rapide (30 à 60
s) et de courte durée d'action (5 à 10 minutes). Il prolonge l'action de
l'acétylcholine en évitant sa dégradation. On l'utilise pour réaliser un test visant à déceler une myasthénie. Principe actif de divers médicaments dont Tensilon®. |
|
C38H76O4ClN |
|
Tensioactif cationique utilisé comme adoucissant et ajouté aux
détergents. |
|
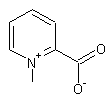
ou Acide N-méthylbétaïnepicolinique ou Acide 1-méthylpyridine-6-carboxylique C7H7NO2 N° CAS : 445-30-7 |
|
Présent dans l’encre de seiche. |
|
|
Phospholipides (Dérivés du glycérol dont deux fonctions alcool sont
estérifiées par des acides gras et la troisième par de l'acide phosphorique.
Celui-ci a une seconde fonction acide estérifiée par un aminoalcool dont la
fonction amine est quaternaire comme par exemple la choline).Les
phospholipides représentent une classe importante de lipides membranaires. |
|
|
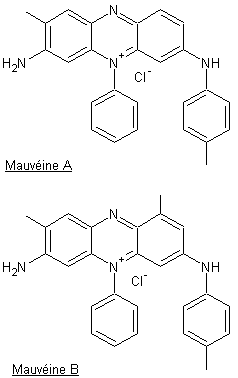
Mauvéine A C26H23ClN4 Masse molaire : 426,941 g.mol-1 N° CAS : 6373-22-4 Mauvéine B C27H25ClN4 |
Safranine C20H19ClN4 Masse molaire : 350,85 g.mol-1 N° CAS : 477-73-6 |
En 1856 William Henry Perkin senior oxyde de la toluidine contenue à
l'état de traces dans de l'aniline et obtient un colorant violet. Il s'agit
en fait d'un composé se formant à partir des trois molécules : aniline,
ortho-toluidine et para-toluidine oxydées en milieu sulfurique par du
dichromate de potassium. Il se forme d'ailleurs deux molécules, la mauvéine A
et la mauvéine B qui comporte un groupement méthyle en plus. Perkin convertit ensuite (1878) la mauvéine A en safranine en
enlevant le groupement tolyle fixé sur l'azote en 7 et en ajoutant un
groupement méthyle en 8 . La safranine est un colorant rose utilisé en histologie et en cytologie
; c'est aussi un indicateur d'oxydo-réduction utilisé en chimie analytique. A l'état solide c'est une poudre brun-rouge. |
|
C9H20NO2 Masse molaire : 174,2606 g.mol-1 N° CAS : 300-54-9 |
|
Alcaloïde toxique, présent dans des champignons du type Clitocybe et
Inocybe ; il provoque une importante sudation pour celui qui l'ingère ; l'intoxication
par cet alcaloïde peut-être grave, voire mortelle (enfants, personnes âgées). La muscarine a été découverte la première fois en 1869 dans l'amanite
tue-mouches (Amanita muscaria) où
elle existe en petites quantités dans le chapeau. |
|
|
Composé très toxique provenant de la déshydratation de la choline. |
|
|
Noir basique 2 Masse molaire : 484,01g.mol-1 200°C (se décompose) |
|
Colorant azoïque λmax = 584 nm |
|
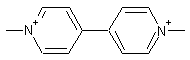
Paraquat (cation) ou 1-1'-diméthyl-4,4'-dipyridine C12H14N2 Masse molaire : 186,252 g.mol-1 N° CAS : 4685-14-7 Risques : R 24/25, 26, 36/37/38,
48/25, 50/53
|
|
Herbicide non sélectif à action rapide dont la commercialisation et
l'utilisation sont interdits dans l'Union Européenne, à cause de sa forte
toxicité (atteintes digestives, rénales..) ; il induit également des lésions
dégénératives du système nerveux (comme la maladie de Parkinson) chez les
rats. |
|
ou N,N-diméthylproline ou proline bétaïne C7H13NO2 Aspect : Cristaux (lorsque recristallisé dans l'eau). Masse molaire : Fusion : 235°C N° CAS : 471-87-4 Solubilité : Très soluble dans l'eau et l'éthanol. |
|
Cette molécule se trouve dans la luzerne cultivée (Medicago sativa) ou alfalfa, l'espèce Chrysanthemum et les citrus. |
|
Succinylcholine nom systématique: |
|
Médicament aux propriétés curarisantes, utilisé en anesthésie pour provoquer
un relâchement musculaire (curare dépolarisant). C'est une poudre blanche
sans odeur, légèrement amère et très soluble dans l'eau. Remarque:Le curare est un mélange de substances extraites de lianes d'Amazonie et
provoquant une paralysie des muscles. Il est utilisé par les Amérindiens qui
en enduisent l'extrémité de leurs flèches. |
|
Triméthylammonium- tétradécane (bromure de 1-) ou Cétrimide ou Bromure de triméthylammonium myristile C17H38N+ Br- Masse molaire : 336,40 g.mol-1 Fusion : 245-250°C Solubilité : Solubilité dans l’eau : 560 g.L-1 Soluble dans l’éthanol et le chloroforme : insoluble dans l’éther. N° CAS : 1119-97-7 Risques :
|
|
Antiseptique local ; empêche le développement des bactéries en cas de
lésions infectées de la peau. |