PHENOLS, POLYPHENOLS,
FLAVONOÏDES, TANINS.
Gérard Gomez
Plan de
l'étude
A -Les
phénols
A-2) Données sur quelques phénols
B - Les
polyphénols
B3) Les lignanes
C - Les
Flavonoïdes
C-1) Les flavonoïdes
C-1-1) Flavones et flavonols
C-1-1-1) Les
Flavones
C-1-1-2)
Les Flavonols (et les flavanonols)
C-1-2)
Les flavanols et les flavanones
C-1-2-1)
Les flavanols
C-1-2-2)
Les flavanones
C-1-3)
Les anthocyanidines (ou anthocyanidols)
C-2)
Les isoflavonoïdes
C-2-1)
Les isoflavones
C-2-2)
Les isoflavanones
C-3)
Les néoflavonoïdes
C-4)
D'autres types structurels de flavonoïdes
C-4-1)
Les chalcones
C-4-2)
Les aurones
D- Les tanins
D-1)
Introduction
D-2)
Structure chimique
D-2-1)
Les tanins hydrolysables
D-2-1-1)
Tanins de l'acide gallique ou gallotanins
D-2-1-2)
Tanins de l'acide ellagique ou ellagitanins
D-2-2)
Les tanins condensés
D-2-3)
Les tanins complexes
D-2-4)
Les phlorotanins
D-3) Formation
des complexes tanins-protéines
D-3-1) Astringence
- Amertume
D-3-2) Le
tannage des peaux
D-3-3) Autres
domaines où les tanins ont de l'importance
Annexe 1 Formules de la glycine, de la proline, de l'hydroxyproline
Annexe 2 Flavonoïdes sous forme d'hétérosides
Annexe 3 Encre métallo-gallique
Annexe 4 Les prolamines
Annexe 5 La mucine
Annexe 6 Vieillissement d'un vin
Annexe 7 Tanins
Annexe 8 Le collagène
Annexe 9 Les acides chlorogéniques
Annexe 10 Acide cinnamique et stilbène
Annexe 11 Monolignols
Annexe 12 Voies de biosynthèse des entérolignanes
A-1) Définition-Nomenclature
:
Un phénol est une molécule aromatique, possédant un groupe hydroxyle OH fixé
sur un carbone d'un cycle benzénique.
Formule générale : Ar-OH
Exemples :
|
|
|
|
Le phénol ou benzophénol C'est le plus simple
de la famille |
Le
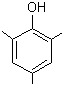
2,4,6-triméthylphénol |
Nomenclature : Lorsque plusieurs fonctions existent sur le cycle
benzénique on utilise le suffixe phénol si la fonction est prioritaire, ou le
préfixe hydroxy si elle ne l'est pas ; (Voir priorités dans les
composés polyfonctionnels).
Exemples :
|
|
|
|
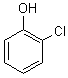
2-Chlorophénol car OH est prioritaire
par rapport à Cl. |
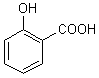
Acide
2-hydroxybenzoïque car OH n'est pas
prioritaire par rapport à COOH. |
Remarque: Si le groupe hydroxyle
n'est pas fixé directement sur le carbone du cycle benzénique, ce n'est pas un
phénol mais un alcool aromatique;
exemple:

Alcool benzylique.
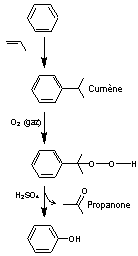
A-2) Données sur quelques phénols :
Il existe de très
nombreux phénols dans la nature, qu'ils soient d'origine végétale ou animale.
Les phénols ont diverses fonctions biologiques et peuvent avoir des propriétés
antioxydantes, antimicrobiennes…
Nous allons donner
quelques exemples de phénols naturels simples, c'est-à-dire ne contenant qu'un
seul noyau aromatique substitué par des groupes simples :
|
ou Hydroxybenzène
C6H6O Masse molaire : Ebullition : Fusion : Densité: Indice de réfraction : Solubilité: N° CAS : 108-95-2 |
Sources : Les goudrons de
houille renferment du phénol que l'on peut extraire, mais l'essentiel est
obtenu par oxydation du cumène.
Utilisations : - Principalement
utilisé comme intermédiaire de synthèse dans l'industrie : Synthèse du bisphénol
A (résines phénoliques), des plastifiants, des adhésifs, des durcisseurs … - Dans l'industrie
pharmaceutique : désinfectant, antiprurigineux, anesthésique local. - C'est une kairomone de Toxorhynchites
amboinensis le moustique éléphant, appelé ainsi
car de grande taille ; il ne pique pas, est nectarivore et se trouve dans les
régions tropicales et subtropicales. |
|
Paracétamol ou N-(4-hydroxyphényl)-éthanamide ou N-(4-hydroxyphényl)-acétamide ou acétaminophène 151,17 g.mol-1
170 °C |
Antipyrétique et
analgésique (il fait baisser la fièvre), principe actif du Dafalgan®, du
Doliprane®, notamment, concurrent de l'aspirine mais avec moins d'effets
secondaires. |
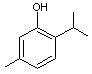
|
ou 2-isopropyl-5-méthylphénol
C10H14O Aspect : Cristaux incolores. Masse molaire : 49,5°C Ebullition : 232,5°C Densité : 0,970 (à 25°C) Indice de réfraction : 1,5227 (à 20°C) N° CAS : 89-83-8 Solubilité : Très soluble dans
l'éthanol, l'éther, le chloroforme, l'acétate d'éthyle ; insoluble dans
l'eau. |
Sources : Molécule présente
notamment dans les huiles essentielles de thym (Thymus vulgaris) et d'origan (Origanum
vulgare). Utilisations : Le thymol a des
propriétés antiseptiques et antifongiques ; il a une odeur agréable. On l'utilise : - En pharmacie, comme
antiseptique pour la gorge. - En parfumerie, il
donne des notes aromatiques à certains parfums. - Comme additif
alimentaire : il donne une saveur de thym aux aliments et aux boissons. - Produits de
nettoyage : il désinfecte grâce à ses propriétés antimicrobiennes. - Comme pesticide
naturel : C'est un antifongique. |
|
ou
Liquide Masse molaire : 164,201 g.mol-1
-7,5 °C 253,2 °C Densité : 1,0652 à 20 °C 1,5405 à 20 °C N° CAS : 97-53-0 Solubilité : |
Sources : Présent dans le giroflier, Syzygium aromaticum (famille des myrtacées) : Phénol présent dans
les clous de girofle ; constituant de certains désinfectants utilisés pour
les soins dentaires. Utilisations : - En aromathérapie, du
fait de son odeur agréable et de ses propriétés apaisantes. - En parfumerie : il
donne une note épicée et boisée aux parfums. Utilisé dans les cosmétiques. - En dentisterie :
C'est un antiseptique qui possède aussi des propriétés analgésiques. - En cuisine : Le clou
de girofle et la cannelle en contiennent. - C'est un répulsif
contre les moustiques. |
|
Capsaïcine
C18H27NO3
|
Alcaloïde à azote extracyclique, naturel, présent en particulier dans le
piment (genre capsicum) ; il a été découvert et isolé en 1816. C’est le
principe aromatisant majeur de l’oléorésine du paprika. Il constitue (à raison
de 20%) avec d'autres alcaloïdes voisins la famille des capsaïcinoïdes. Ces composés activent les récepteurs vanilloïdes (nocirécepteurs) VR1 de la peau, de la
langue, de la vessie, par exemple, qui sont aussi activés par la chaleur
(45°C) et par l'acidité. Les capsaïcinoïdes
provoquent donc une douleur (sensation de piquant sur la langue, de brûlure
sur la peau) au début, mais par contact prolongé, ils désensibilisent ces
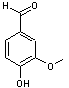
récepteurs entraînant un effet analgésique. Remarque : La vanilline (3-méthoxy-4-hydroxybenzaldéhyde)
donne son parfum aux gousses de vanille :
|
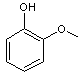
|
ou 2-méthoxyphénol
C7H8O2 Aspect : Cristaux (prismes
hexagonaux) incolores à odeur forte. Masse molaire : 124,138 g.mol-1 Fusion : 32°C Ebullition : 205°C Densité : 1,1287 (à 21°C) Indice de réfraction : 1,5429 (à 20°C) N° CAS : 90-05-1 Solubilité : Soluble dans
l'éthanol, l'éther, le chloroforme ; légèrement soluble dans l'eau (1,9g.L-1). |
Sources : On l'extrayait
autrefois de l'acacia catechu Willd (famille des fabiacées) arbre de
12m de haut environ à fleurs jaune pâle, originaire du grand désert indien de
Thar. Le guaiacol
existe aussi dans le bois de guaiac ; le guaiac est un arbuste (Bulnesia sarmienti) d'Amérique du sud
(Paraguay) dont le bois est un des plus denses des bois tropicaux. Utilisations : - Intermédiaire de
synthèse dans divers domaines (parfumerie, arômes, colorants). - En parfumerie : en
raison de son odeur agréable. - Arômes et saveurs
alimentaires : il donne un goût fumé à la viande). -Utilisé comme
antiseptique et mucolytique en médecine. - En biochimie il
permet de mettre en évidence les phénoloxydases
avec lesquelles il donne une coloration rouge. |
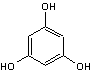
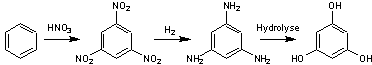
|
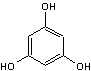
ou Benzène-1,3,5-triol
C6H6O3 Aspect : Cristaux en feuilles ou en plaques lorsque recristallisé
dans l'eau. Masse molaire : 126,110 g.mol-1 Fusion : 218,5°C Ebullition : Se sublime Densité : 1,46 (à 25°C). Solubilité : Très soluble dans l'éthanol, l'éther, le benzène, la
pyridine ; soluble dans l'acétone ; légèrement soluble dans l'eau.
|
Sources : Triphénol présent dans l'écorce de certains arbres
fruitiers, dans certaines fougères, ainsi que dans certaines algues marines. On peut le synthétiser par exemple à partir du benzène
traité par l'acide nitrique pour obtenir du trinitrate de benzène, un
explosif. Par réduction catalytique par l'hydrogène, on obtient le
1,3,5 triaminobenzène qui traité par une base donne le phloroglucinol. Utilisations : - Le phloroglucinol, diminue les spasmes des fibres
musculaires lisses et calme donc la douleur liée à ces spasmes. C'est le principe actif (en association avec le
1,3,5-triméthoxybenzène *) du médicament Spasfon. - C'est un intermédiaire de synthèse. - C'est un agent de coloration en histologie. Existe sous deux
formes tautomériques :
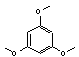
*
1,3,5-triméthoxybenzène |
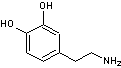
|
ou 4-(2-aminoéthyl)benzène-1,2-diol
C8H11NO2 N° CAS : 51-61-6 C'est un précurseur de l'adrénaline et de la
noradrénaline. |
On retrouve de la
dopamine à la fois dans le règne végétal et dans le règne animal. C'est une
catécholamine (présence de 2 groupements OH phénoliques en ortho comme dans
le pyrocatéchol). - Dans le règne
animal, c'est un neurotransmetteur (messager chimique entre les neurones)
jouant un rôle important dans le fonctionnement du cerveau. Le manque de
dopamine dans le système nerveux central provoque la maladie de Parkinson. - Dans le règne
végétal elle peut être impliquée dans divers processus biologiques
(régulation de la croissance, défense contre les herbivores et les pathogènes
…). |
Comme on le voit, les
phénols sont courants dans les essences végétales.
On peut également citer
: les crésols (méthylphénols) dans les goudrons de houilles ; l'anol
dans l'anis, le fenouil ; le carvacrol dans
le thym, avec le thymol ; le chavicol dans le
bétel….
Il existe par ailleurs
des phénols appartenant à des familles importantes et qu'on peut classer dans
les phénols simples ; ce sont les acides phénoliques de type hydroxybenzoïque et les acides phénoliques de type
cinnamique :
- Acides phénoliques du type hydroxybenzoïque
:
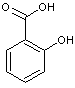
|
ou Acide
2-hydroxybenzoïque
C7H6O3
Aspect : Aiguilles (si
recristallisé dans l'eau) ; primes monocliniques (si recristallisé dans
l'éthanol. Masse molaire : 159°C Ebullition : 211 (sous 20 mm de
Hg) Densité : 1,443 (à 20°C) Indice de réfraction : 1,565 N° CAS : 69-72-7 Solubilité : Très soluble dans
l'éthanol, l'acétone, et l'éther ; légèrement soluble dans l'eau, le benzène,
le chloroforme. |
Sources : - Salix
alba
(Saule blanc) Arbre poussant au bord de l'eau à écorce gris foncé
profondément fissuré de la famille des salicacées. C'est dans son écorce que
l'on trouve l'acide salicylique. - Filipendula
ulmaria (Reine des près) de la famille des Rosacées.
C'était une plante sacrée pour les druides. Ses boutons floraux contiennent
de l'acide salicylique. Utilisations : Il a été préparé dès 1859 par H.KOLBE ; fut introduit en 1876
par STRICKER comme médicament contre le rhumatisme. Il est utilisé notamment - comme analgésique et anti-inflammatoire,
c'est un précurseur de l'acide acétylsalicylique (Aspirine). - En association avec d'autres molécules il
permet de traiter les verrues, l'acné. - On l'utilise aussi en association avec
d'autres molécules pour traiter l'hyperhidrose (sudation excessive). - Pour la conservation des aliments (il
empêche la croissance de moisissures et des levures). - En horticulture, on l'utilise comme
pesticide naturel (antifongique). |
|
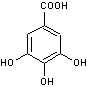
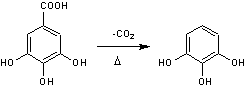
Acide gallique
C7H6O5 |
Cet acide peut être
obtenu par dégradation des tanins par des
microorganismes. La décarboxylation de
l'acide gallique par la chaleur conduit au pyrogallol
(c'est le principe de la préparation industrielle de ce produit). |
|
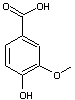
Acide
vanillique ou Acide
4-hydroxy-3-méthoxybenzoïque
C8H8O4 Masse molaire 168,147 g.mol-1 Fusion 209°C pKa 4,53 à 25°C Solubilité : Légèrement soluble
dans l'eau. N° CAS 121-34-6 |
On le trouve
naturellement dans Angelica sinensis, plante
originaire de Chine et utilisée dans la médecine traditionnelle chinoise. Cette molécule a des
propriétés anti-microbiennes. On peut l'obtenir par
oxydation de la vanilline. |
|
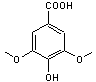
Acide syringique
|
Présent dans divers
végétaux (érable, arganier à l'état de traces). Malvidine-3-O-glucoside |
- Acides phénoliques du type cinnamique :
Ils ont la structure de
l'acide cinnamique (voir annexe 10)
|
ou ou Acide 3-(3,4-dihydroxyphényl)- prop-2-énoïque
Cristaux jaunes Masse molaire : 180,158 g.mol-1 225°C (se décompose) N° CAS : 331-39-5 Solubilité : Très soluble dans l'éthanol. |
Acide présent dans le café et de nombreuses
plantes. Il présente deux fonctions phénol. L'acide caféique se forme naturellement dans
les végétaux par hydroxylation de l'acide 4-hydroxy (trans) cinnamique et se
transforme en acide férulique. |
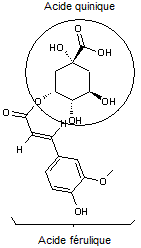
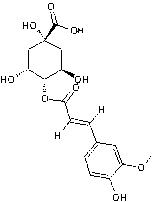
|
Acide férulique
|
Il résulte du métabolisme de la phénylalanine et de la tyrosine.Il est très répandu dans les végétaux (riz, blé, orge,
avoine...). Il possède un pouvoir antioxydant et absorbe les U.V. |
|
ou Acide sinapinique Ou Acide 3-(4-hydroxy-3,5-diméthoxyphényl)-2-propènoïque
C11H12O5 Aspect : Poudre blanche Masse molaire : 224,210 g.mol-1 Fusion : 199°C (se décompose) Solubilité : Soluble dans le méthanol et l'acétone ; insoluble dans
l'eau. N° CAS : 530-59-6 |
Molécule que l'on trouve dans des plantes
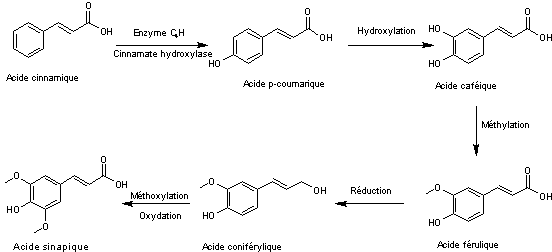
oléagineuses (Crucifères – Brassicacées) notamment le colza. Biosynthèse de l'acide sinapique
|
|
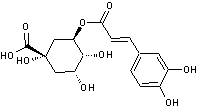
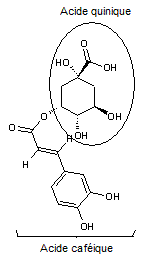
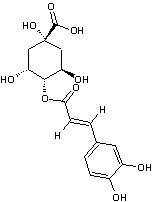
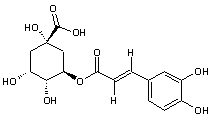
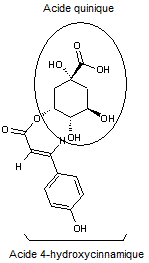
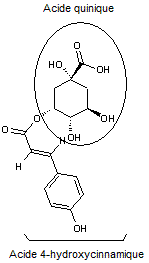
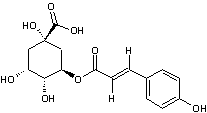
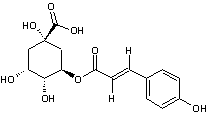
Acide chlorogénique
C16H18O9 |
Acide phénolique, présent notamment dans le
café (grains et boisson) ; il représente environ 3% de la matière sèche d'un
grain de café avec des variations selon qu'il s'agit d'un arabica ou d'un
robusta. Il est responsable en partie de l'arôme du café. On en trouve
également dans des légumes courants (carotte, pomme de terre..).
Remarque : il existe une famille d'acides
chlorogéniques (voir annexe 9) |
- B - Les polyphénols
Les polyphénols
constituent un sous-ensemble de la famille des phénols ; les molécules
constituant ce sous-ensemble renferment plusieurs noyaux aromatiques ayant des
substituants hydroxyles (-OH), c'est-à-dire plusieurs fonctions phénol dans
leur structure.
On distingue 5 familles
:
Les flavonoïdes, les
acides phénoliques, les hydroxystilbénoïdes, les lignanes et les tanins.
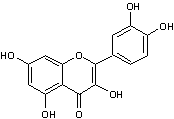
Les polyphénols les
plus nombreux sont les flavonoïdes avec comme exemple la quercétine.
Les molécules sont donc
en général plus complexes que celles qui ont été citées dans le précédent
paragraphe.
Remarque :
Cependant quelques
molécules qui ne répondent pas à la définition qui vient d'être donnée sont
considérées abusivement comme des polyphénols.
C'est le cas de
composés comme ceux ci-dessous qu'on qualifie de diphénol ou de triphénol et qui correspondent à un seul noyau aromatique
portant plusieurs groupes hydroxyles :
|
|
|
|
|
|
|
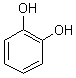
Pyrocatéchol ou catéchol |
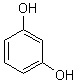
Résorcinol |
Hydroquinone |
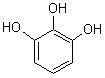
Pyrogallol |
Phloroglucinol |
Alors que
![]() est un bisphénol
est un bisphénol
Remarque : Les flavonoïdes et
les tanins feront l'objet d'une étude séparée ; nous allons donner des exemples
des autres familles citées.
En voici deux exemples
:
|
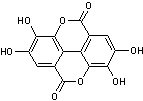
Acide Ellagique
Ebullition : 796,5°C Densité : 2,066 |
C'est une substance
présente dans les tanins (ellagitanins) présents
dans de nombreux fruits : ·
Vaccinium myrtillus (Canneberge) ·
Punica granatum
(grenadier) ·
Fragaria vesca
(fraisier) famille des rosacées. ·
Juglans regia
(noyer commun) famille des juglandacées. C'est un composé
soluble dans l'eau. |
|
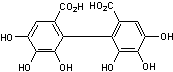
Acide digallique ou Acide
3,4-Dihydroxy-5-[(3,4,5-trihydroxybenzoyl)oxy]benzoïque
C14H10O9 Aspect : Feuilles (si
recristallisé dans l'éthanol dilué). 322,224 g.mol-1
N° CAS : 536-08-3 Solubilité : Trés soluble dans
l'acétone et l'ethanol. |
C'est une substance
présente dans les tanins. |
B2) Les hydroxystilbénoïdes
Ce sont des composés
qui ont la structure du trans-stilbène (voie annexe 10)
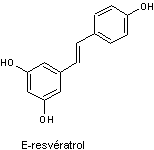
Un des plus importants
est le resvératrol :
|
Resvératrol
C14H12O3 Masse molaire : 228,243 g.mol-1 Fusion : 254°C N° CAS : 501-36-0 Solubilité : Soluble dans
l’éthanol, peu soluble dans l’eau. |
Polyphénol de la
famille des stilbènes,
possédant comme tous les polyphénols des propriétés réductrices ; ils
empêchent l'oxydation par le dioxygène ; c'est donc un antioxydant (on lui
attribue de ce fait des propriétés "anti-vieillissement"),
antiagrégant plaquettaire, anti-inflammatoire et vasodilatateur. On le trouve
notamment dans la peau de certains raisins rouges (dans le cépage "pinot
noir" on en retrouve par exemple de 1 à 8 mg/L). Par action de la
lumière UV, il se transforme en son isomère Z (cis) 7 fois moins actif comme
anti oxydant. Le resvératrol est une
phytoalexine,
métabolite secondaire des végétaux en réponse à une attaque de parasite (Champignon….) ou à un stress hydrique par exemple. |
Nombre de composés ont
des structures voisines de celles du resvératrol :
|
|
R1 = R2
= R3= H c'est le
trans-resvératrol R1 = R2
= H R3=
OH c'est le trans-picéatannol R1 = R2
= CH3 R3=
H c'est le trans-ptérostilbène R1 = Glc R2 = R3= H c'est le trans-picéide (Glc = Glucose) |
On peut également citer
la ε-viniférine qui est un dimère du resvératrol
:
|
C28H22O6 Masse molaire : 454,471 g.mol-1 N° CAS : 62218-08-0 |
Composé naturel que
l'on trouve dans les vignes (Vitis vinifera)
dans des vins et dans l'écorce de la tige de Dryobalanops aromatica, une espèce d'arbres originaires de Sumatra
et de Bornéo ; ils ont la particularité de laisser entre
eux des "fentes de timidité". |
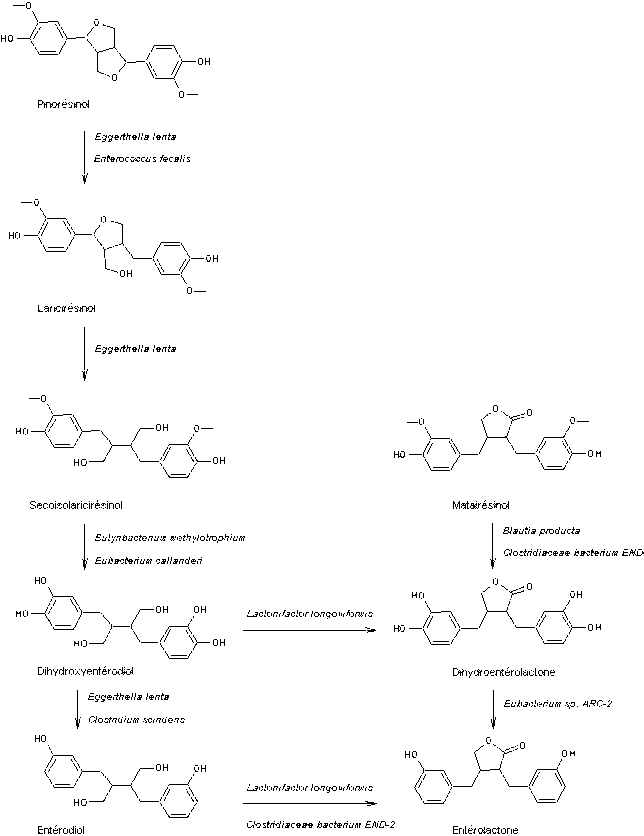
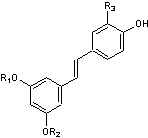
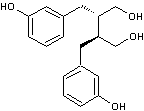
B3) Les lignanes
Ce sont des composés
naturels dont la molécule dérive de deux unités monolignols
(voir annexe 11).
C'est Haworth qui
introduit le premier en 1936 le terme de lignane pour
désigner un ensemble de deux molécules ayant un squelette phénylpropane,
liées par leurs carbones 8 et 8'.
|
|
|
Phénylpropane |
Ce terme a été étendu
par la suite (Otto Richard Gottlieb 1972) aux groupes de deux molécules ayant
un squelette phénylpropane mais non liées par leurs
carbones 8 et 8' ; il les a qualifiées de néolignanes.
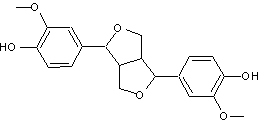
Prenons comme exemple
le pinorésinol (C20H22O6)
qui dérive de deux molécules d'alcool coniférylique
(voir annexe 11) :
Les lignanes
sont assez répandus mais ce sont les graines de sésame et de lin qui en
contiennent le plus :
|
Sésame |
1000 à 2000 µg/g |
|
Lin |
347 à 1140 µg/g |
|
Carotte |
29,3 µg/g |
|
Lentille |
19,6 µg/g |
|
Chou-fleur |
16,2 µg/g |
|
Ail |
10,5 µg/g |
|
Oignon |
10,3 µg/g |
Voici quelques
molécules qui correspondent à cette grande famille :
|
|
|
|
|
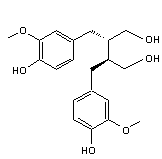
Entérodiol ((C18H22O4) Un lignane
qui se forme dans l'intestin (d'où son nom) ; on le qualifie aussi de lignane mammalien car se formant dans l'organisme des
mammifères. C'est un catabolite produit par la flore intestinale à partir de lignanes présents dans la nourriture |
Secoisolaricirésinol (C20H26O6) Son diglucoside, un anti-oxydant isolé des graines de lin,
est métabolisé dans le corps humain, en secoisolaricirésinol,
mais aussi en entérodiol et en entérolactone,
des lignanes dits mammaliens, ayant des propriétés
de phytoestrogènes |
L'entérolactone
est un phytoestrogène c'est-à-dire un nutriment
d'origine végétale (puisque formé à partir de lignanes
végétaux) de structure non stéroïdienne capable de se fixer sur le récepteur
des oestrogènes. |
|
|
|
|
|
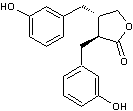
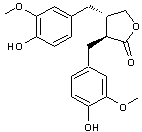
Matairésinol (C20H22O6) Lignane assez fréquent ; on
en trouve dans les graines de lin et de sésame, dans divers légumes et
fruits. C'est un précurseur
des lignanes mammaliens |
Un lignane
de structure aryltétraline. Le 9'-rhamnopyranoside
de ce lignane est l'aviculine. |
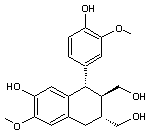
Lignane de structure arylnaphtalène présent dans Eucalyptus globoidea un arbre originaire d'Australie. Cette molécule inhibe
l'action de l'enzyme HIV intégrase responsable de l'introduction de l'ADN
viral dans l'ADN d'une cellule hôte. |
On trouvera en annexe 12, les voies de biosynthèse des entérolignanes.
On
dit d'un très grand nombre de substances naturelles qu'elles sont des
flavonoïdes ; ce sont toutes des composés appartenant à la famille des
polyphénols dont elles constituent un sous-ensemble ; la coloration des
feuilles, des fleurs, des fruits est la plupart du temps due à des flavonoïdes.
A l'état naturel on peut trouver ces
polyphénols à l'état libre (on les désigne alors comme aglycones ou génines),
mais très souvent les flavonoïdes sont sous forme d'hétérosides (voir annexe 2), une ou plusieurs de leurs fonctions phénols sont
alors glycosylées (les oses étant le glucose, le galactose, le rhamnose ou
l'arabinose). Sous forme hétéroside ils sont plus nettement hydrosolubles que
sous forme aglycone.
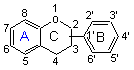
Flavonoïde est un terme générique qu'on peut décrire par
la structure phénylbenzopyrane (deux cycles
aromatiques à 6 carbones, A et B, reliés par un hétérocycle oxygéné à 5
carbones C),
Selon la position du cycle
aromatique B sur le benzopyrane on obtient trois
groupes :
- Position 2 : ce sont les
flavonoïdes,
- Position 3 : ce sont les isoflavonoïdes,
- Position 4 : ce sont les néoflavonoïdes
On classe les flavonoïdes selon leur
structure :
Structures générales de base :
|
2-phénylchromone (ou flavone)
|
2-phénylchromane (ou flavane)
|
|
Ils constituent les flavonoïdes au
sens strict |
Ils constituent les flavonoïdes au
sens large |
Ils sont divisés en plusieurs
classes qui se différencient par le degré de saturation de l'hétérocycle de
l'aglycone, son oxydation et sa conformation spatiale :
On distingue :
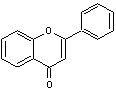
-
les flavones et les flavonols qui ont le noyau
flavone en commun et qui sont donc des flavonoïdes au sens strict.
-
les anthocyanidines (ou anthocyanidols)
qui ont le noyau ion flavylium en commun et
qui sont donc des flavonoïdes au sens large.
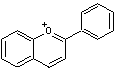
-
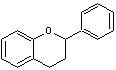
les flavanols qui ont le noyau flavane en commun et
qui sont donc des flavonoïdes au sens large.
Remarque :
Les anthocyanidines
peuvent être obtenues soit à partir des flavonols
(par réduction), ou par oxydation des flavanols :
![]()
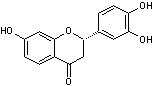
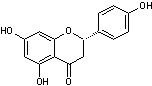
C-1-1) Flavones et flavonols :
Ce sont des pigments jaunes présents
notamment dans la pellicule des raisins et dans les feuilles de vigne.
Les flavones et les flavonols ont pour structure de base le noyau flavone, du
latin flavus = jaune (adjectif) :
Ils ont une structure commune polyhydroxylée ou méthoxylée ; la
forme aglycone des flavones est stable et dans l'hétéroside, l'ose est fixé
soit sur le carbone C7, soit sur le carbone C8 :
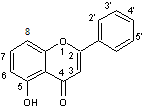
Voici quatre exemples de flavones
naturelles :
|
Flavone
C5H10O2 Aspect : Cristaux incolores. Masse molaire : 222,239 g.mol-1 Fusion : 95°C N° CAS : 525-82-6 Solubilité : Cristaux solubles dans l'eau. C'est une molécule que l'on
retrouve dans plusieurs fruits et notamment les mandarines. Comme tous les polyphénols elle a
des propriétés antioxydantes (neutralisation des radicaux libres dans
l'organisme). A l'instar des isoflavonoÏdes,
la flavone est un phyto- oestrogène ; elle possède
des analogies structurales avec l'oestradiol ou l'oestrone, des stéroïdes endocriniens endogènes, ce qui
lui confère des propriétés agonistes/antagonistes envers les récepteurs
oestrogéniques. |
ou Apigénol ou 4’,5,7-trihydroxyflavone ou 5,7-dihydroxy-2-(4-hydroxyphényl)-4H-1-benzopyran-4-one
C15H10O5 Aspect : Cristaux en aiguilles, jaunes. Masse molaire : 270,237 g.mol-1 Fusion : 347,5°C N° CAS : 520-36-5 Solubilité : Très soluble dans l’ammoniaque
dilué ; soluble dans l’éthanol, la pyridine ; insoluble dans l’eau. Flavone ayant des propriétés
anti-inflammatoires et anti tumorales. On trouve cette molécule dans le
persil, le romarin… Un des glucosides ayant comme
aglycone l'apigénine s'appelle la vitexine, le
glucose étant fixé sur le carbone C8 ; on trouve cette molécule
dans plusieurs végétaux : l'arbre à poivre (ou gattilier vitex
agnus-castus), la Passiflore, l'Aubépine …. |
|
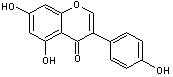
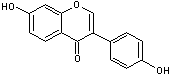
Lutéoline
C15H10O6 Aspect : Aiguilles jaunes Masse molaire : 286,236 g.mol-1 Fusion : 329°C (se décompose) Solubilité : Soluble dans l’éthanol, l’éther,
le benzène, l’ammoniaque, l’acide sulfurique concentré ; légèrement soluble
dans l’eau. N° CAS : 491-70-3 Son nom vient du latin luteum = jaune
(nom). C’est une substance commune présente dans de nombreuses plantes ; c’est
elle qui donne leur belle couleur jaune aux fleurs du genêt (Genista tinctoria). Elle a été utilisée pour fabriquer
de la teinture jaune. Elle a été isolée du réséda jaunâtre (Reseda luteola) ou
réséda des teinturiers, par Michel
Eugène Chevreul un spécialiste, à son époque, des colorants. Présente dans l'artichaut (cynara scolymus)
on lui prête des vertus hypocholestérolémiantes (elle inhiberait la synthèse
du cholestérol). Un des glucosides ayant comme
aglycone la lutéoline, s'appelle la cynaroside , le glucose étant fixé sur le carbone C7. |
C20H20O7 Masse molaire : 372,4 g.mol-1 Fusion : 153°C N° CAS : 481-53-8 Flavone polyméthoxylée
qui a montré des effets antiprolifératifs et antioxydants. On la trouve dans la peau des
fruits du genre Citrus. Son nom vient de la ville de
Tanger (Maroc) par laquelle transitait les tangérines,
agrume proche de la mandarine. Un des glucosides ayant comme
aglycone la tangérétine, s'appelle la
tangérétine-4'-O-β-D-glucoside, le glucose étant fixé sur le carbone C4'. |
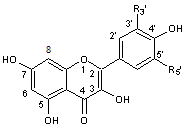
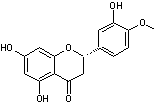
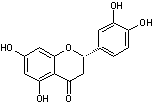
C-1-1-2) Les Flavonols (et les flavanonols) :
Ils ont une structure
commune polyhydroxylée ; leur forme aglycone est très
stable et dans l'hétéroside, l'ose est fixé sur l'oxygène du OH placé en
position 3 :
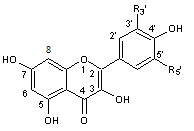
Le tableau ci-dessous
complète la formule de quatre flavonols naturels :
FORME
AGLYCONE DES PRINCIPAUX FLAVONOLS
|
R3' |
R5' |
|
|
H |
H |
|
|
OH |
H |
|
|
OH |
OH |
|
|
OCH3 |
H |
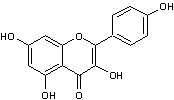
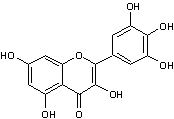
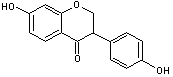
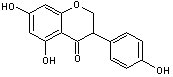
* La quercétine (hétéroside) représente 80% des flavonols totaux.
Remarque : Les couleurs des flavonols
que nous allons donner dans le tableau ci-dessous et celles qu'ils communiquent
aux plantes qui en contiennent peuvent varier en fonction de la concentration,
du pH et de la présence d'autres composés dans le mélange.
|
ou
solide jaune cristallisé Masse molaire : 286,23 g.mol-1
277 °C Solubilité Soluble dans l'éthanol
chaud et l'éther diéthylique. N° CAS 520-18-3 Comme tous les
polyphénols c'est un antioxydant. On le trouve dans de
nombreux aliments : fruits (fraises notamment), légumes (poireaux épinards…),
vin touge, thé. Il est souvent associé
aux tons jaunes de certains fruits et légumes. |
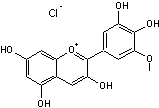
Quercétine
Puissant antioxydant,
agissant en synergie avec les vitamines C,E et les caroténoïdes. Donne une couleur
allant du jaune au jaune vert aux fleurs ou fruits qui en contiennent. |
|
Myricétine
C15H1008 Masse molaire : 318,2351 g.mol-1 Fusion 357°C N° CAS 529-44-2 On le trouve dans de nombreux aliments : fruits
(raisins, noix), légumes. Il a été montré que l'association myricétine et quercétine que l'on trouve dans le jus des baies de
canneberge empêche la corrosion dentaire (la canneberge (Vaccinium
macrocarpon) est un arbuste des tourbières des régions froides, notamment
les marécages du nord-est des Etats-Unis, dont les baies comestibles sont
rouges et ont un goût acidulé). Elle donne aux fruits et légumes qui en contiennent des
couleurs allant du jaune au jaune vert. |
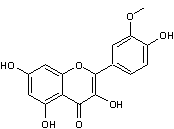
Isorhamnétine C16H1207 Masse molaire : 316,26 g.mol-1 Fusion 307°C N° CAS 480-19-3 On en trouve dans les feuilles de navet, les feuilles de
moutarde et dans d'autres végétaux tel que par exemple le ginkgo biloba. Des
études in vitro et chez l'animal, ont montré que cette molécule et ses
dérivés avaient une action sur la concentration du glucose sanguin
(diminution), une action antioxydante et une action dans le sens d'une
réduction de l'activité d'enzymes liés au développement des cellules
cancéreuses. Comme la myricétine et la quercétine, elle donne une
couleur allant du jaune au jaune vert aux fleurs ou fruits qui en
contiennent. |
Remarque :
Le dérivé dihydrogéné de la quercétine en 2,3
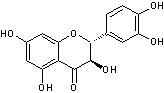
Le dérivé dihydrogéné en 2,3 du kaempférol
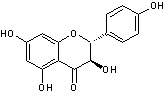
s'appelle l'aromadédrine.
Ces deux composés sont
des flavonols dihydrogénés
en 2,3 ; ils appartiennent à un groupe dérivé des flavonols
que l'on appelle les Flavanonols.
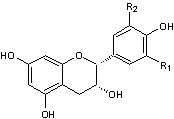
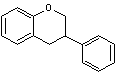
C1-2) Les flavanols
et les flavanones :
Les flavanols et les flavanones ont pour structure de
base le noyau flavane qui correspond au
2-phénylchromane

C-1-2-1) Les
flavanols :
Ils ont une structure
commune polyhydroxylée.
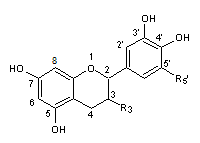
Dans cette famille
nombreuse, il y a une majorité de flavan-3-ols c'est-à-dire de composés pour
lesquels R3 est le groupe hydroxy –OH :
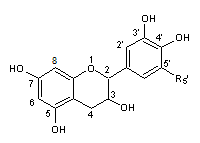
C'est à ces composés
que nous allons nous intéresser.
On remarque dans la
structure commune, deux centres chiraux, en C2 et C3.
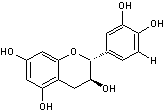
La catéchine correspond
à 2 liaisons trans en C2 et C3 et l'épicatéchine à 2 liaisons cis.
Il y a donc 4
stéréoisomères :
- La (+)-catéchine et la (-)-catéchine
- La (+)-épicatéchine et la (-)-épicatéchine
Le tableau ci-dessous
complète la formule de six flavanols que l'on désigne couramment par le terme
général de catéchines:
PRINCIPAUX FLAVAN-3-OLS
|
R5' |
|
|
H |
(+) Catéchine |
|
H |
(-) Catéchine |
|
H |
(+) Epicatéchine |
|
H |
(-) Epicatéchine |
|
OH |
(+) Gallocatéchine |
|
OH |
|
(+)
Catéchine
(2R,3S)
C15H14O6
290,268 g.mol-1 212-214°C (se décompose) Ethanol, acétone. Risques : N° CAS : 154-23-4 On voit deux liaisons
trans en C2 et C3. Cette molécule
inhiberait l'histidine décarboxylase, réduisant ainsi la conversion de la L-histidine en histamine. |
(-)
Catéchine
(2S,3R)
C15H14O6 Masse molaire 290,268 g.mol-1 Le racémique (dl-cis) : 212-214°C (se décompose) Ethanol, acétone. Risques : N° CAS : 154-23-4 On voit deux liaisons
trans en C2 et C3. |
||
|
(+)
Epicatéchine
(2S,3S)
C15H14O6
290,268 g.mol-1 243°C (se décompose) |
(-)Epicatéchine
C15H14O6
290,268 g.mol-1 243°C (se décompose) Pouvoir rotatoire [α]20
= -54° (c=1 dans l'eau + l'acétone 1:1) Solubilité : Ethanol, acétone 490-46-0 |
||
|
(+)Gallocatéchine (2R,3S)
C15H14O7 Masse molaire 306,267 g.mol-1 170 °C N° CAS (dl) 1617-55-6 |
(-)Epigallocatéchine
C15H14O7 Masse molaire 306,267 g.mol-1 170 °C N° CAS (dl) 1617-55-6 |
- Propriétés des catéchines
- Les catéchines les plus
fréquentes dans la nature sont la (+) Catéchine et la (-)Epicatéchine
- Les catéchines sont présentes
dans beaucoup de végétaux en particulier les feuilles de thé vert, le cacao et
des fruits (pomme ou raisin par exemple) ou dans des produits transformés comme
le vin et le chocolat. On trouve également dans l'alimentation les catéchines
qui ont été citées, galloylées, c'est-à-dire
estérifiées au niveau de l'hydroxyle en C3 par l'acide gallique
comme par exemple le (-)-gallate d'épigallocatéchine
ou EGCG qui est la principale catéchine du thé vert :
On trouve aussi surtout
dans le thé noir, un dimère de l'épigallocatéchine :
Le théasinensine
A
ainsi que le diester avec
l'acide gallique des OH portés par les carbones C3 :
Le théasinensine
B
- Comme tous les phénols qui
contiennent des fonctions orthodiphénoliques, les
catéchines sont capables de chélater les cations métalliques trivalents comme
le Fe(III).
Les complexes formés
sont stables dans l'intestin et de ce fait limitent l'absorption du fer non
associé à l'hème (fer non hémique), ce qui
entraînerait une absorption de fer moindre chez les buveurs réguliers de thé.
- Astringence : la présence de
catéchines dans les aliments induit une sensation dans la bouche, une
sécheresse avec l'impression de contraction de la muqueuse buccale. C'est une
des principales propriétés des tanins que nous étudierons plus loin dans cet
article.
C-1-2-2) Les flavanones:
On va donner quelques
représentants de la famille :
|
Butine ou 3',4',7-trihydroxyflavanone
C15H1205 Masse molaire : 272,253 g.mol-1
N° CAS 492-14-8 |
Hespérétine ou 3',5,7-trihydroxy-4'-méthoxyflavanone
C16H14O6 Aspect : Plaques légèrement
jaunes (lorsque recristallisé dans l'éthanol dilué au demi dans l'eau) Masse molaire : 302,278 g.mol-1
Fusion : 227,5°C Ebullition : Se sublime à 205°C N° CAS : 520-33-2 Solubilité : Très soluble dans
l'éther et l'éthanol. C'est une flavanone ; on la trouve principalement dans les écorces
d'agrumes (oranges, citrons, pamplemousses…). Possède des propriétés
vasculoprotectrice, veinotonique et à ce titre
entre dans la composition de plusieurs médicaments (Daflon
®…). C'est aussi un anti-hémorroïdaire. |
ou (S)-3',4',5,7-tétrahydroxyflavanone
C15H12O6 Aspect : Cristaux en plaques ou en aiguilles (lorsque la
recristallisation a eu lieu dans l'éthanol). Masse molaire : N° CAS : 552-58-9 Très soluble dans l'éthanol et l'acide éthanoïque. Cette flavanone réduit
l'amertume des composés amers (caféine, quassine, …) ; on trouve cette
molécule dans l'Herba Santa (Eriodictyon californicum) plante
d'Amérique du nord, mais aussi dans le citron (Citrus lemon) sous forme d'hétéroside. |
Naringénine ou 4',5,7-tétrahydroxyflavanone
C15H12O5
Aiguilles (lorsque
recristallisé dans l'éthanol dilué) Masse molaire : 272,253 g.mol-1
N° CAS : 480-41-1 Solubilité : Très soluble dans le
benzène, l'éther, l'éthanol. Flavanone extraite de l'écorce
de pamplemousse et autres citrus, elle sert à rendre amers, en particulier
les "toniques". La naringénine est
responsable d'interactions avec certains médicaments. |
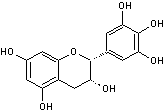
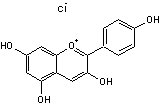
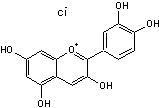
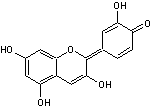
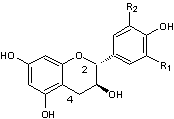
C-1-3) Les anthocyanidines
(ou anthocyanidols) :
Ils constituent la partie aglycone des anthocyanes.
Les anthocyanidines ont pour structure de base l'ion flavylium
:
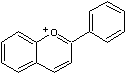
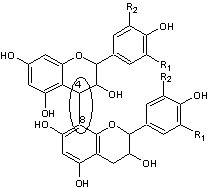
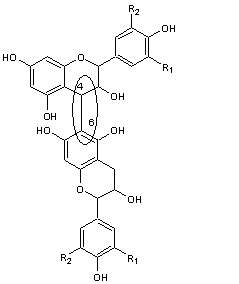
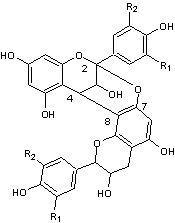
Ils ont une structure commune polyhydroxylée; le tableau ci-dessous complète la formule de six
anthocyanidines :
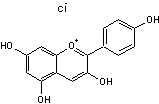
PRINCIPAUX ANTHOCYANIDOLS
|
R3' |
R5' |
|
|
H |
H |
|
|
OH |
H |
|
|
OCH3 |
H |
|
|
OH |
OH |
|
|
OCH3 |
OCH3 |
|
|
OH |
OCH3 |
|
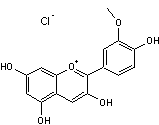
ou
306,745 g.mol-1
Pigment de couleur
rouge brun. Fusion : F> 350°C Soluble dans l'eau ;
très soluble dans l'éthanol. N° CAS : 134-04-3 Anthocyanidine,
obtenue par hydrolyse en présence d'acide chlorhydrique d'anthocyanes (pigments donnant leur très belles couleurs et très variées aux fleurs,
fruits et baies). On en trouve en
grande quantité dans les géraniums (nom latin Pelargonium
d'où son nom).Elle est à l'origine des couleurs
roses, rouges, violettes dans les fleurs. |
(Chlorure de) ou chlorure de
3,3',4',5,7-pentahydroxyflavylium
Forme rouge (pH <3)
Forme violet rouge (pH proche de 7)
Forme bleu-vert (pH> 7) C15H11O6Cl 322,745 g.mol-1
Suivant le pH la
couleur varie du rouge au bleu-vert en passant par le violet rouge (voir plus
haut). N° CAS : 528-58-5 Elle est responsable
du coloris rouge violet des oeillets par exemple
(avec ceux de la pélargonidine), ainsi que de la couleur rouge du
chou. |
|
Paeonidine C16H13Cl06
Masse molaire : 336,723 g.mol-1
- rouge à pH<1 - rouge violacé à pH
5 - bleu profond à pH 8 N° CAS : 134-01-0 On la trouve dans
certaines variétés de pivoines (genre Paeonia)
; elle est responsable de la coloration rose, rouge clair ou rouge foncé des
pétales de ces fleurs. |
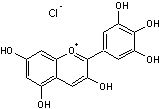
ou
338,70 g.mol-1
> 350 °C Eau, éthanol. Ce composé est violet
à pH<1. N° CAS : 528-53- 0 Le nom delphinidine est dérivé de "delphinium" qui est
le nom d'un genre de plantes à fleurs, notamment connues sous le nom de
"dauphinelles" ; ce nom est à son tour tiré du nom grec "delphis" signifiant "dauphin", en raison
de la forme des boutons floraux qui ressemblent à un dauphin. La molécule de delphinide est présente dans diverses plantes
et est généralement associée aux couleurs bleu-violet ou violet foncé de
celles-ci. Sa structure assez
proche de certaines hormones œstrogènes (phyto-oestrogènes)
lui permet d’utiliser l’un des récepteurs de ces hormones (ERα) et
d’avoir le même effet vasodilatateur sur les vaisseaux sanguins qu’elles. Ce
polyphénol présent dans le vin rouge aurait donc une action protectrice sur
nos vaisseaux sanguins. |
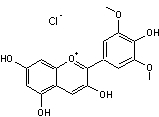
|
Malvidine
366,76 g.mol-1
> 300 °C Ethanol. Aspect : N° CAS : 528-39-2 Présente dans de
nombreuses plantes (par exemple les primevères et les rhododendrons) ; elle
participe à la coloration des pétales et des fruits. Elle donne aux
raisins rouges leur couleur pourpre et aux myrtilles leur couleur bleue. Notons que c'est elle
qui est responsable de la couleur violette de la chair des pommes de terre de
la variété "vitelotte". |
(Chlorure de)
C16H13ClO7 Masse molaire : 352,770 g.mol-1
Généralement soluble
dans des solvants polaires comme l'eau ou des mélanges eau et éthanol. Aspect : Composé généralement
rouge à violet 1429-30-7 Présente dans
certaines baies (groseilles) et certains pétales de fleurs, par exemple la
fleur de pétunia (d'où son nom) ; elle contribue avec la cyanidine,
la malvidine et la paeonidine aux couleurs de cette
fleur. |
C-2) Les isoflavonoïdes
Ils sont moins répandus
dans le règne végétal ; ils prédominent par exemple dans les fèves de soja et
d'autres légumineuses. On a rapporté la présence d'isoflavonoïdes
dans certains microbes.
Structure générale de
base :
3-phénylchromane (ou isoflavane)
Ces molécules forment
une classe de composés appelés isoflavonoïdes.
La plupart sont
biologiquement actives et souvent considérées comme des phytoestrogènes.
Comme les flavonoïdes,
la famille est très grande et on peut les classer en
- Isoflavones
- Isoflavanones
- Isoflavanes
Essentiellement
présentes dans des légumineuses, graines de soja surtout, mais aussi lentilles
et pois.
On leur prête un rôle
important comme précurseurs dans le développement des phytoalexines lors d'une
interaction plante microbe.
Le nom de cette famille
vient de ce que le squelette commun à tous les membres est le noyau isoflavone
:
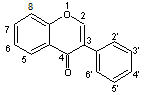
Les trois principales
isoflavones sont :
|
Génistéine |
Daidzéine |
Glycitéine |
|
|
|
|
On peut récapituler
l'ensemble des molécules d'isoflavones (aglycones et glucosides) qui
correspondent aux trois citées dans le tableau précédent :
|
|
R1 |
R'1 |
R''1 |
R2 |
R3 |
|
Daidzéine |
H |
- |
- |
H |
H |
|
Glycitéine |
H |
- |
- |
O-CH3 |
H |
|
Génistéine |
H |
- |
- |
H |
OH |
|
Daidzine |
différent de H |
H |
- |
H |
H |
|
Glycitine |
différent de H |
H |
- |
O-CH3 |
H |
|
Génistine |
différent de H |
H |
- |
H |
OH |
|
Acétyldaidzine |
différent de H |
différent de H |
H |
H |
H |
|
Acétylglycitine |
différent de H |
différent de H |
H |
O-CH3 |
H |
|
Acétylgénistine |
différent de H |
différent de H |
H |
H |
OH |
|
Malonyldaidzine |
différent de H |
différent de H |
différent de H |
H |
H |
|
Malonylglycitine |
différent de H |
différent de H |
différent de H |
O-CH3 |
H |
|
Malonylgénistine |
différent de H |
différent de H |
différent de H |
H |
OH |
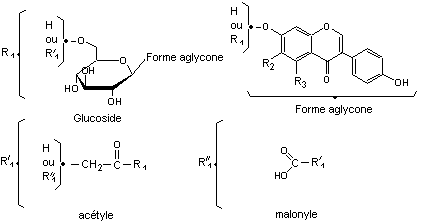
C-2-2) Les isoflavanones.
Le squelette commun à
tous les membres de cette famille est le noyau isoflavone dihydrogéné
en C2C3,
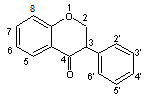
Nous donnerons trois
représentants d'isoflavanones
|
Dihydrodaidzéine |
Dihydrogénistéine |
Dihydroglycitéine |
|
|
|
|
C-3) Les néoflavonoïdes
Structure générale de
base :
4-phénylchromane (ou néoflavane) :
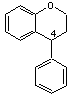
Nous donnerons quatre
représentants de néoflavonoïdes :
On remarquera que dans
ces molécules la fonction cétone n'est plus sur le carbone n°4 comme cela était
le cas pour les isoflavonoïdes,mais
sur le carbone n°2.
On remarquera aussi que
le Dalbergichromane ne porte pas de fonction cétone,
c'est un néoflavène.
C-4) D'autres types structurels de
flavonoïdes :
On peut aussi
considérer que d'autres structures peuvent être désignées par le terme
flavonoïdes ; ce sont :
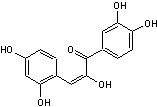
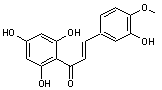
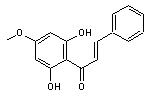
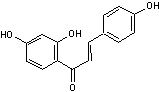
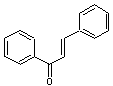
C-4-1) Les chalcones
Ce sont des pigments
jaunes de structure phénolique que l'on trouve dans les végétaux supérieurs
sous forme libre et sous forme d'hétérosides.
Elles dérivent des flavanones par ouverture de l'hétérocycle et elles
possèdent une fonction cétone α,β-éthylénique.
Comme les flavonoïdes,
les chalcones ont une activité vitaminique P sur la
résistance vasculaire.
La chalcone
correspond à la molécule suivante qui n'est pas un flavonoïde :
Les chalcones
flavonoïdes correspondent à la chalcone portant un ou
plusieurs groupes hydroxy sur les noyaux benzéniques.
Exemples :
|
Naringénine chalcone
C15H12O5 Masse molaire : 272,253 g.mol-1
N° CAS 480-41-1 Elle est présente dans
l'écorce de certains agrumes, par exemple le pamplemousse et dans la peau des
tomates. Elle est faiblement
hydrosoluble et s'isomérise spontanément en naringénine qui est une flavanone. |
Hespérétine chalcone
C16H14O6 Masse molaire : 302,279 g.mol-1
N° CAS 75679-30-0 On la trouve dans
l'écorce de certains agrumes comme les oranges, les citrons, les
pamplemousses, ainsi que dans certains types de thé. Comme de nombreux
flavonoïdes elle présente une activité antioxydante (neutralisation des
radicaux libres dans l'organisme, contribuant ainsi à la protection de
celui-ci contre le stress oxydatif). Des travaux lui attribuent des effets
anti-inflammatoires. |
|
ou 2',6'-dihydroxy-4'-métoxychalcone
C16H14O4 Masse molaire : 270,280 g.mol-1
Aspect : Poudre jaune Solubilité : Chloroforme,
dichlorométhane, DMSO, Acétone. N° CAS 18956-15-5 Extrait des graines de
Piper aduncum (poivriers à épis crochus) et
de Cajanus cajan
(Pois d'Angole). C'est un inhibiteur
puissant de l'accumulation des triglycérides (adipogénèse). |
ou 2',4,4'-trihydroxychalcone
C15H12O4 Masse molaire : 256,253 g.mol-1
N° CAS 961-29-5 Chalcone présente dans la
réglisse ; elle est utilisée pour lutter contre la dépendance à la cocaïne. |
|
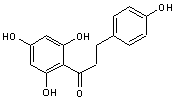
Phlorétine
C15H14O5
Cristaux en aiguilles
(lorsque recristallisé dans l'éthanol dilué). Masse molaire : 274,269 g.mol-1
N° CAS : 60-82-2 C'est une dihydrochalcone partie aglycone d'un hétéroside la phloridzine dont la partie glucidique est le
β-D-glucose qui est une substance à saveur sucrée intense, présente dans
l'écorce de plusieurs arbres fruitiers, pommiers, poiriers, cerisiers.
L'INRA a mis au point à partir de la phloridzine un
colorant jaune appelé jaune POP (pour Produit d'Oxydation de la Phloridzine) destiné à remplacer la tartrazine (colorant
alimentaire E 102). |
|
Structurellement elles
dérivent des chalcones avec formation d'un cycle
central à 5 atomes de carbone au lieu de 6 pour les autres flavonoïdes :
Structure générale
d'une aurone :
Elles sont impliquées
dans la coloration jaune intense de nombreuses astéracées, comme le dahlia (Dahlia
variabilis)
Comme la plupart des
autres flavonoïdes elles sont considérées comme des agents pharmacologiques de
premier ordre.
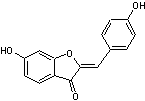
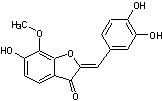
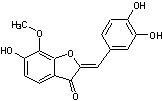
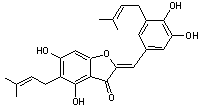
Quelques aurones
naturelles et leurs familles végétales associées :
|
|
|
|
(Astéracées,
Anacardiacées) |
(Légumineuses) |
|
|
|
|
(Légumineuses) |
(Moracées) |
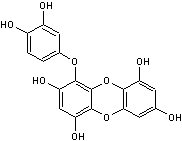
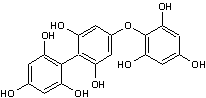
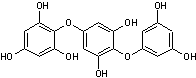
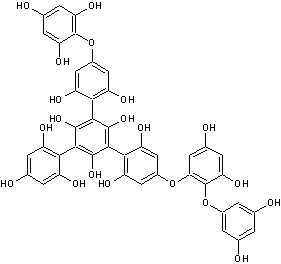
-D- Les tanins
Les tanins sont des
composés polyphénoliques présents dans de nombreuses
plantes (disposés dans les vacuoles et les parois, ils représentent de 15 à 25%
du poids sec de la plante (jusqu’à 40% dans l’écorce et 50% dans certaines
galles)), y compris les fruits et dans des substances dérivées des plantes,
thé, vin. On en trouve aussi dans le bois.
Ils représentent un des
quatre groupes de métabolites secondaires des plantes supérieures avec les
saponines, les huiles essentielles et les alcaloïdes ; ils sont utilisés par
les végétaux comme moyen de défense chimique contre les microbes pathogènes et
les herbivores et on les trouve donc dans les parties externes de ces plantes :
écorce, racines, feuilles, fruits …..(voir annexe 7).
Ils sont responsables
de la saveur astringente (propriété d'une substance à resserrer les tissus) de
certaines boissons et de certains aliments.
Ils sont utilisés dans
diverses industries notamment en œnologie (en formant des complexes avec des
protéines, ils participent au processus de clarification des vins), dans la
fabrication des cuirs (ils rendent les peaux imputrescibles) et dans certains additifs
alimentaires ; Ils entrent aussi dans la fabrication des encres et des
adhésifs.
Les tanins sont
généralement amorphes ; ils se dissolvent dans l'eau sous forme de solutions
colloïdales. Ils sont aussi solubles dans l'éthanol, l'acétone ; ils sont par
contre insolubles dans les solvants apolaires.
Ils sont précipités par
de nombreux réactifs et en particulier certains sels métalliques (Fe,Pb,Zn,Cu ..)
Avec les sels ferriques
ils donnent des précipités colorés :
- Bleu-noir avec des tanins hydrolysables.
- Brun vert avec des tanins condensés.
Ils sont constitués de
sous-unités flavonoïdes et de phénols.
Ils se caractérisent
par la capacité à se lier aux protéines et aux polysaccharides et de les faire précipiter..
Il existe plusieurs
types de tanins :
D-2-1) Les tanins
hydrolysables
Ce sont des
combinaisons complexes de glucose et d'acides polyphénoliques
comme l'acide gallique, l'acide digallique, l'acide
ellagique, l'acide hexahydrodiphénique.
Par hydrolyse acide,
ces tanins se décomposent en glucose et en acides galliques ou ellagiques.
|
|
|
|
|
|
Acide
gallique |
Acide
digallique |
Acide
ellagique |
Acide
hexahydrodiphénique |
D-2-1-1) Tanins
de l'acide gallique ou gallotanins
- Le plus simple est le 1-O-galloyl-β-D-glucopyranose
ou β-Glucogallin
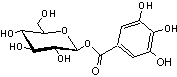
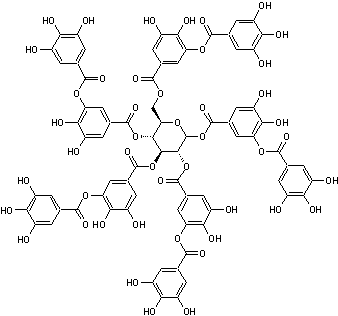
- Le β-PGG est le β-1,2,3,4,6-penta-O-galloyl-β-D-glucose
est le prototype des gallotanins.
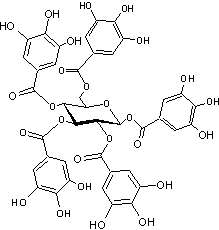
- Avec l'acide digallique, par
exemple, que l'on trouve dans l'écorce de chêne, l'écorce de châtaigner et dans
les noix de galle et qui estérifie l'ensemble des groupes hydroxyle du glucose,
on obtient :
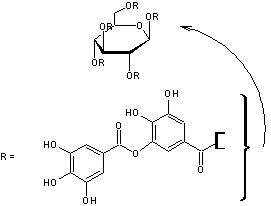
- L'acide tannique qu'on trouve aussi dans l'écorce de
chêne, l'écorce de châtaigner et dans les noix de galle pour fabriquer des
encres (encre métallo-gallique qu'on utilisait au Moyen-âge) (voir annexe 3), comme colorant alimentaire(E181) et pour traiter
certains ulcères cutanés ainsi que comme antidiarrhéique sous forme de
lavements en médecine vétérinaire, ces usages étant liés à ses propriétés
astringentes ; on s'en sert aussi pour passiver la corrosion du fer.
L'hydrolyse acide de
ces molécules libère le glucose et l'acide gallique.
Ces gallotanins
simples se trouvent dans la nature dans des espèces botaniques comme Acer
(érables), Quercus (chênes), Rhus
(sumacs), Pelargoniums Acacia
(mimosas), mais ils sont relativement rares.
D-2-1-2) Tanins
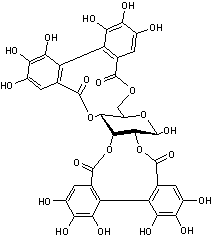
de l'acide ellagique ou ellagitanins
C'est le plus grand
groupe de tanins hydrolysables connu.
Il s'agit d'esters de
l'acide hexahydrodiphénique (HHDP) avec généralement
le β-D-glucose.
Par hydrolyse, les ellagitanins libèrent des acides diphéniques
qui se réarrangent spontanément en acide ellagique.
Trois exemples :
|
|
|
|
|
Pedunculagine La pédunculagine est un ellagitannin. Elle est formée à
partir de la casuarictine par la perte d'un groupe gallate. On la trouve dans
le péricarpe des grenades (Punica granatum)
ainsi que dans les noix. C'est
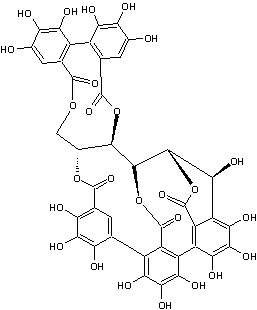
l'un des principaux ellagitanins du bois de chêne avec la castalagine, la
vescalagine, la grandinine et les roburines A-E. On le trouve également dans
la groseille à maquereau indienne (Phyllanthus emblica). La galloylpédunculagine se trouve dans Platycarya
strobilacea. |
Casuarictine La casuarictine est un ellagitannin. On la trouve dans
les espèces Casuarina et Stachyurus. Elle est formée de deux unités d'acide
hexahydroxydiphénique et d'une unité d'acide gallique liées à une molécule de
glucose. La molécule est formée à partir de la tellimagrandine
II, elle-même formée à partir du pentagalloyl glucose par oxydation. La
casuarictine est transformée en pédunculagine par la perte d'un groupe
gallate, puis en castalagine par l'ouverture du cycle pyranose du glucose. |
Vescalagine Ellagitanin que l'on trouve dans le bois de chêne (par
exemples Quercus robur, ou Quercus petraea, ou Quercus pyrenaica) avec lequel on
confectionne les tonneaux destinés à contenir le vin. La vescalagine peut agir contre les ostéoclastes,
cellules naturellement chargées de dégrader les os afin qu'ils puissent se
renouveler ; elle agit contre l'actine protéine importante pour
l'architecture des cellules ; elle dégrade le réseau d'actine la transformant
en pelotes amorphes. |
Ils peuvent être sous
forme de monomère ou d'oligomères.
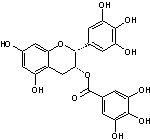
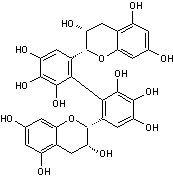
Encore appelés proanthocyanidines les tanins condensés sont formés par la
polymérisation d'unités flavan-3-ols en dimères, oligomères (entre 2 et 10
monomères) ou polymères (> 10 monomères).
Les flavan-3-ols que
l'on trouve le plus couramment dans les tanins condensés sont la catéchine,
l'épicatéchine, la gallocatéchine et l'épigallocatéchine.
Ces tanins se
distinguent les uns des autres par la nature des flavan-3-ols qui les
composent, mais aussi par les positions et et les types de liaisons
inter-flavonoïdes.
On distingue 2 types de
liaisons inter-flavonoïdes :
- Liaisons carbone-carbone
Ces liaisons se forment
entre le carbone C4 de l'unité supérieure et le carbone C8 de l'unité
inférieure (et plus rarement C6) :
|
|
|
|
Liaison
C-C entre C4 et C8 |
Liaison
C-C entre C4 et C6 |
- Liaisons aryle-aryle :
Plus rares, elles se
forment à l'intérieur d'une même unité monomère lors de la polymérisation des tanins
condensés.
|
|
|
Liaisons : C2-O (lié à C7) et C-C entre
C4-C8 |
Remarque : les groupes R1
et R2 correspondent à H ou OH suivant les composés, ce qui est
explicité ci-dessous :
|
|
Composés |
R1 |
R2 |
|
|
- Catéchine - Gallocatéchine |
H OH |
OH OH |
|
|
- Epicatechine - Epigallocatechine |
H OH |
OH OH |
Remarque : une nouvelle famille
de tanins condensés a été découverte, les tanins couronnes (Zeng, L. "Etude
de la composition macromoléculaire du raisin et des vins : Impact sur la
qualité sensorielle" Thèse de doctorat, Université de Bordeaux,
2015)

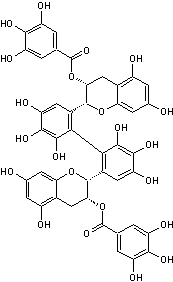
L'exemple ci-dessus est
un tétramère couronne composé de quatre unités de base
d'épicatéchine.
Il s'agit d'une
condensation entre une unité de tannin hydrolysable et une unité de tannin
condensé ou une molécule de flavanol ; Il s'est établi une liaison C-C entre C1
du glucose du tannin hydrolysable et C6 ou C8 de la
molécule de flavanol ou du tannin condensé.
Deux exemples :
|
|
|
|
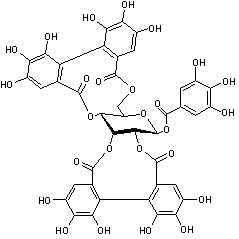
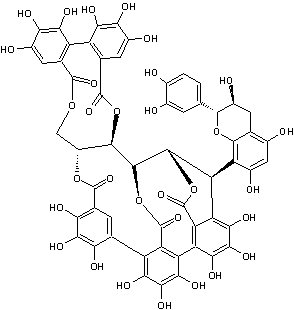
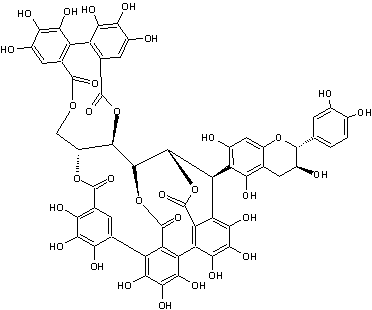
Acutissimine B |
Tanins complexes
présents dans l'écorce des chênes asiatiques (Quercus acutissima et Quercus miyagii)
mais aussi dans Quercus petraea.
Il s'agit d'une unité ellagitanin C-glycosidique identique à la vescalagine connectée une unité flavan-3-ol, la catéchine.
Le bois de cœur de Quercus petraea
étant utilisé pour fabriquer des barriques destinées à contenir du vin, il
n'est pas anormal de trouver dans le vin de l'acutissimine
A ou B.
Par ailleurs, les deux
unités isolées, catéchine d'une part et vescalagine
d'autre part existent la première dans le vin et la seconde dans le bois de
chêne ; il n'est donc pas non plus anormal de penser qu'une réaction se produit
dans le vin lorsqu'il est élevé en fûts de chêne, conduisant à l'acutissimine A ou B.
On prête à ces
molécules des propriétés anti-cancéreuses ; elles inhiberaient l'action d'une
enzyme la topoisomérase II, impliquée dans le développement des cellules
cancéreuses.
D-2-4) Les phlorotanins
Ce sont des tanins que
l'on trouve principalement dans les algues hétérocontes
(algues brunes telles que le fucus vesiculosus,
les diatomées) mais aussi dans l'algue kombu et l'algue wakamé (consommées au
Japon), courantes dans les environnements marins.
Du point de vue
structurel, ce sont des oligomères du phloroglucinol
; en voici quatre exemples :
|
|
|
|
Eckol |
Fucophloréthol |
|
|
|
|
Tétrafucol A |
Trifucotriphloréthol |
D-3) Formation des complexes
tanins-protéines : (d'après "Influence des tanins sur la valeur
nutritive des aliments des ruminants" N.Zimmer, R. Cordesse INRA, ENSA Montpellier).
Des liaisons hydrogène
peuvent se former entre les fonctions hydroxyles des groupements phénols des tanins
et les groupements amine libres des protéines, les groupements carboxyliques ou
le groupement aminé des liaisons peptidiques. Toutes ces liaisons sont
réversibles. Seule l'oxydation des groupements phénols ou la présence de
groupements aldéhydes sur le corps du tanin (comme le sucre des tanins
hydrolysables) peuvent engendrer des liaisons covalentes, c'est-à-dire une
situation irréversible.
Les tanins se fixent de
préférence aux protéines, mais aussi à des polyosides telles les celluloses,
les hémicelluloses ou les pectines.
Les tanins ont une
grande affinité pour les prolamines (voir annexe 4), le
collagène et la gélatine.
Ces protéines
contiennent toutes une forte proportion de proline, un acide aminé
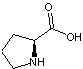
responsable de la structure
tridimensionnelle ouverte et flexible de la protéine, favorisant la fixation
des tanins sur divers groupements. De plus le résidu proline se lie fortement
avec les tanins.
Plusieurs conséquences
et applications découlent de cette propriété des tanins à former des complexes
avec les protéines.
D-3-1) Astringence -
Amertume
- L'astringence en bouche est une
sensation de sécheresse, de rugosité, et de constriction au niveau des tissus buccaux,
provoqués par les tanins. Lorsqu'elle est trop prononcée elle devient
désagréable. Elle joue donc un rôle
important dans le goût des
aliments et des boissons. (d'après"Les dessous de
l'astringence" INRAE). Cependant l'astringence ne doit pas être confondue avec
un goût, elle est en réalité une sensation tactile.
Le mécanisme exact de
ce phénomène n'est pas parfaitement maîtrisé, mais on peut dire qu'il met en
jeu des protéines qui participent au pouvoir lubrifiant de la salive, comme la
mucine (voir annexe 5).
La réaction entre ces
protéines et les tanins qu'apportent les vins un peu jeunes ou le chocolat noir
ou le thé ou les artichauts crus entraîne une neutralisation des protéines
salivaires qui a pour conséquence une diminution de l'effet lubrificateur d'où
une augmentation des frottements.
Parmi les domaines où
cette astringence joue un rôle important, on peut citer l'œnologie :
Elle est un aspect clé
en œnologie car elle influence la texture, le goût et la structure d'un vin.
Voici son importance :
- Texture :
L'astringence est souvent associée à la sensation de sécheresse en bouche due
aux tanins présents dans le vin. Cette texture contribue à l'équilibre en
contrant la douceur du vin, ce qui est essentiel, surtout dans les vins rouges.
- Vieillissement : Les
tanins qui causent l'astringence évoluent avec le temps, contribuant à la
complexité et à la structure des vins qui vieillissent bien (voir annexe 6).
- Accords mets-vins :
L'astringence peut influencer les accords mets-vins, en complétant ou
contrastant avec la texture des plats. Par exemple, un vin tannique peut bien
accompagner une viande riche. Les complexes protéine-tanin ont deux effets importants.
D'abord, ils précipitent les protéines de la viande, ce qui peut réduire la
perception de la rugosité de la texture. Deuxièmement, ces complexes peuvent
lier les molécules de graisse de la viande, ce qui peut atténuer la sensation
de lourdeur due aux graisses.
- Qualité :
L'astringence équilibrée contribue à la qualité globale du vin. Un excès
d'astringence peut rendre un vin désagréable, tandis qu'une astringence bien
maîtrisée peut améliorer son attrait.
En résumé, l'astringence est un élément fondamental de l'œnologie, car elle
influe sur l'expérience sensorielle et la qualité des vins, en particulier dans
le cas des vins rouges.
- L'amertume
Contrairement à
l'astringence qui est une sensation tactile, l'amertume est un goût car il
résulte d'une interaction entre les tanins et des récepteurs localisés en
bouche. La sensation d'amertume dépend de plusieurs facteurs : masse
moléculaire du tannin, son degré de polymérisation, sa stéréochimie.
L'amertume est
importante pour les flavonoïdes monomériques tels que la catéchine ou
l'épicatéchine, mais sera faible pour les tanins du vin dont la masse molaire
dépasse 500g/mol.
Un milieu riche en
éthanol va augmenter l'amertume ressentie alors que la présence de sucre tend à
la diminuer.
Le tannage des peaux
est un processus utilisé pour transformer les peaux d'animaux en cuir ; la
richesse en proline des protéines de ces peaux les rend plus sensibles au
tannage.
Le tannage implique
généralement l'utilisation de tanins pour stabiliser les protéines du cuir et
améliorer ses propriétés physiques ; il nécessite beaucoup d'étapes ;
chimiquement parlant cela revient à former des complexes tanins-protéines en
quantités suffisantes pour rigidifier la structure d'une façon optimale.
Il existe plusieurs
méthodes de tannage, dont celle aux tanins naturels qui est appelé tannage
végétal (qui correspond à environ 20% de la production mondiale) et celle
utilisant des métaux et en particulier le chrome (III) qui est dit tannage
minéral (correspondant à environ 70% de la production mondiale), les 10%
restants correspondent à des tannages par des tanins artificiels.
C'est le derme des
peaux, une matière riche en collagène qui intervient dans ce processus (voir annexe 8).
- Le tannage minéral au chrome(III) est le plus utilisé, il est rapide (24h)
économique et donne au cuir souplesse et élasticité ; il est surtout utilisé
pour les peaux qui manquent de densité ; en effet il "remplit" la
structure fibreuse.
Ce tannage commence par
une imprégnation des peaux par une solution de sulfate de chrome(III)
à pH 2,0-2,5 puis se termine en accroissant le pH à 3,5-4,0.
Le chrome établit des
liaisons de coordination avec les radicaux contenant la fonction carboxylique
ionisée sur le collagène. Cela met en jeu les acides aspartique et glutamique
dont les pKa sont très proches de 4. Seulement 50% des radicaux
aspartiques et glutamiques
réagissent. Néanmoins des pontages mettant en jeu deux ou trois
atomes de chrome se forment entre les chaînes protéiniques. (https://new.societechimiquedefrance.fr/wp-content/uploads/2019/12/2006-293-janv-Degache-p.3.pdf).
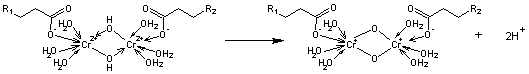
La formation de ponts
Cr-O-Cr entre les chaînes peptidiques à l'intérieur et à l'extérieur de la
triple hélice a été établie.
A ce stade les peaux de
bovins sont généralement sciées dans l'épaisseur.
On obtient deux parties
donc sensiblement deux fois la surface d'origine, la fleur à l'extérieur et la
croûte, plus grossière, à l'intérieur.
Ce tannage est beaucoup
utilisé dans l'industrie de la chaussure et des articles de maroquinerie.
- Le tannage aux tanins
naturels
Utilisé bien avant le
tannage au chrome, il met en jeu aussi bien des tanins hydrolysables que des tanins
condensés. L'opération dure beaucoup plus longtemps (plusieurs jours, voire
plusieurs semaines).
- Avec les tanins
hydrolysables,
on imbibe les peaux avec ces tanins puis on hydrolyse ; il se forme du
glucose qui remplit les espaces entre les fibres de collagène et de
l'acide gallique, le plus souvent, qui établit des liaisons entre les
chaînes peptidiques.
- Avec les tanins
condensés ;
ils ne peuvent être hydrolysés ; ils se fixent par liaisons hydrogène sur
le collagène ; ces liaisons sont moins stables que celles mises en jeu
dans le tannage au chrome ce qui rend ces cuirs moins résistants à la
chaleur.
Ce tannage est surtout
utilisé pour les vêtements, la sellerie, les ceintures et les produits
artisanaux.
- Le tannage aux tanins de
synthèse
Deux exemples de tanins
de synthèse :
- Les aromatiques
qui résultent de la condensation d'aromatiques avec le formaldéhyde ; ils
forment des liaisons hydrogène ou des liaisons ioniques grâce à la
présence de groupes –SO3H et de groupes –OH.
- Le glutaral qui est un agent de réticulation des
protéines
![]()
Principe de
réticulation par le glutaral (les groupes amino, proviennent des radicaux lysine et arginine du
collagène).
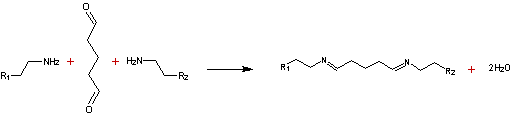
Les liaisons formées
sont dans ce cas irréversibles.
Dans la pratique le glutaral étant très réactif on préfère le modifier en
formant un dihémiacétal avec un alcool gras ; dans le
bain de tannage cet acétal s'hydrolyse en libérant le glutaral
qui réagit.
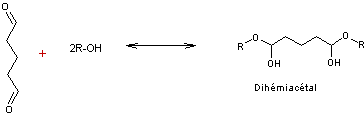
Ces types de tannage
sont réservés aux cuirs de haute qualité et à ceux utilisés dans la haute
technologie ; en effet ils confèrent au cuir des propriétés de résistance à
l'eau, de durabilité et de stabilité dimensionnelle.
D-3-3) Autres domaines
où les tanins ont de l'importance :
Les tanins ont de
l'importance dans plusieurs domaines en raison de leurs propriétés chimiques et
de leurs effets sur la texture, le goût et d'autres caractéristiques. Voici
quelques domaines où les tanins sont importants :
- Pharmacologie : Les tanins
ont été utilisés en médecine traditionnelle pour leurs propriétés astringentes.
Ils sont parfois utilisés pour traiter des affections mineures telles que les
maux de gorge.
- Industrie alimentaire
: Outre l'œnologie, les tanins peuvent être utilisés comme additifs
alimentaires pour leur capacité à stabiliser les couleurs, à améliorer la
clarté des jus de fruits et à agir comme antioxydants.
- Phytoremédiation :
Les tanins peuvent être utilisés pour dépolluer les sols contaminés par des
métaux lourds, en liant ces métaux et en les rendant moins toxiques.
- Produits de beauté et
de soins de la peau : Les tanins peuvent être présents dans des produits de
soins de la peau pour leurs propriétés astringentes, qui peuvent aider à
resserrer les pores de la peau.
- Protection des plantes
: Les tanins naturels peuvent être utilisés pour la protection des cultures
contre les ravageurs, en agissant comme des agents antialimentaires
pour les insectes nuisibles.
- Teinture : Dans l'art
de la teinture, les tanins peuvent être utilisés pour fixer les colorants sur
les fibres textiles, améliorant ainsi la durabilité de la teinture.
Formules de
la glycine, de la proline, de l'hydroxyproline :
|
|
|
|
|
Glycine |
Proline |
Hydroxyproline |
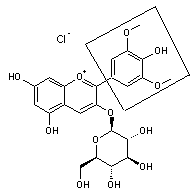
Flavonoïdes
sous forme d'hétérosides.
Nous allons
donner un exemple de flavonoïde sous forme de glycoside, en l'occurrence de
glucoside :
Le malvoside un pigment anthocyanique, diglucoside de la malvidine.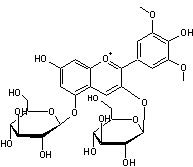
Annexe 3 Encre métallo-gallique
Une recette
d'encre des années 1790-1800
M. André Margarit me
fait parvenir cette recette (qu'il en soit remercié) avec le commentaire
suivant :
"Dans
un document très ancien 1790 / 1800, un notaire donnait ses recettes pour
fabriquer l’encre. L’écriture n’a pas pâli, il savait que les documents ne
devaient pas disparaître au cours des ans.
J’ai copié
le texte en conservant l’orthographe de l’époque."
Annexe 4 Les
prolamines
Une prolamine est une
protéine que l'on trouve principalement dans les graines de céréales, en
particulier dans les grains de blé, d'orge, de seigle et de maïs. Les
prolamines sont riches en acides aminés proline, ce qui leur confère des
propriétés particulières, notamment la capacité à former des réseaux de
liaisons chimiques robustes, ce qui les rend responsables de l'élasticité de la
pâte dans la préparation de produits de boulangerie.
Chaque type de céréale a sa propre prolamine spécifique : par exemple, la
gliadine est la prolamine du blé, la sécaline est
celle du seigle, et la zeine est celle du maïs. Les
prolamines peuvent causer des problèmes chez les personnes atteintes de
maladies liées au gluten, comme la maladie cœliaque, car elles sont souvent
impliquées dans les réactions immunitaires déclenchées par la consommation de
gluten.
Annexe 5 La mucine
La mucine est une
glycoprotéine produite par diverses cellules du corps, y compris les cellules
épithéliales des muqueuses. Elle est présente dans de nombreuses parties du
corps, y compris les voies respiratoires, le système gastro-intestinal, les
glandes salivaires, les glandes mammaires, et d'autres endroits où une barrière
protectrice est nécessaire.
La mucine est un
composant clé du système de défense du corps et de la protection des muqueuses,
jouant un rôle crucial dans la santé et la fonction de divers organes et
systèmes.
Quelques points à
savoir sur la mucine :
- Protection des
muqueuses : La mucine a un rôle essentiel dans la protection des muqueuses
des organes et des voies du corps. Elle forme une couche visqueuse qui piège
les particules étrangères, les bactéries et les virus, aidant ainsi à prévenir
les infections et à maintenir la santé des tissus.
- Composition complexe
: Les mucines sont des protéines complexes contenant de nombreuses chaînes
glucidiques (sucres) liées aux chaînes protéiques. Cette composition complexe
leur confère leurs propriétés visqueuses et adhésives.
- Fonction dans la
lubrification : Dans certaines parties du corps, comme les articulations,
la salive et le tractus digestif, la mucine joue un rôle dans la lubrification
des surfaces, facilitant ainsi les mouvements et les processus de digestion.
- Implication dans
certaines maladies : Des anomalies dans la production ou la composition de
la mucine peuvent contribuer à des maladies, y compris des troubles
gastro-intestinaux et respiratoires.
Annexe 6
Vieillissement d'un vin
Le
vieillissement d'un vin rouge est un processus complexe qui implique de
nombreuses réactions chimiques. En voici quelques-unes qui se produisent
pendant le vieillissement d'un vin rouge :
- oxydation :
lorsque le vin est exposé à de très petites quantités d'oxygène à travers le
bouchon de liège, il subit une oxydation controlée.
Cela peut assouplir les tanins du vin et contribuer a l'évolution de la couleur et de la saveur.
- réduction : dans les premieres étapes du vieillissement, le vin peut passer par
des phases de réduction, ou des composés soufrés reagissent
avec d'autres composés chimiques, créant des arômes et des saveurs distincts.
- polymérisation des tanins
: les tanins du vin, qui peuvent être astringents dans leur forme initiale, ont
tendance à se polymériser pendant le vieillissement, ce qui signifie qu'ils
forment de plus grosses molécules. Cela peut adoucir la sensation en bouche et
améliorer la structure du vin.
- évolution des arômes :
les réactions chimiques entre les composés volatils du vin conduisent à une
évolution des arômes. Les arômes primaires, comme les fruits frais, peuvent
évoluer vers des arômes plus complexes, tels que les épices, les fruits secs et
le cuir.
- évolution de la
couleur : les anthocyanes, les pigments responsables de la couleur des vins
rouges, évoluent au fil du temps, passant d'une teinte violette ou rubis à une
couleur plus orangée. Ces anthocyanes sont extraites très rapidement pendant la
vinification et leur concentration évolue au cours du vieillissement passant de
100 à 3500 mg/L à la fin de la vinification à quelques dizaines de mg/L après
quelques années ; Elles se combinent aux tanins du vin pour former une autre
classe de molécules, les pigments polymérisés, qui sont responsables de la
couleur des vins vieux.
- clarification :
les particules en suspension dans le vin, comme les levures et les sédiments,
ont tendance à se déposer au fond de la bouteille pendant le vieillissement, ce
qui clarifie le vin.
- évolution de la
structure : l'acidité, l'alcool et les tanins s'intègrent et contribuent a la structure globale du vin, ce qui peut le rendre plus
équilibré et harmonieux.
- complexification
: le vieillissement peut ajouter des couches de complexité aux vins, les
rendant plus intéressants et sophistiqués a mesure
qu'ils évoluent.
Il est important de noter que le vieillissement ne convient pas à tous les vins
rouges. Seuls certains vins dotés de la structure et des caractéristiques
appropriées bénéficieront du vieillissement, tandis que d'autres vins destinés
à être consommés jeunes sont conçus pour conserver leur fraicheur et leurs
arômes primaires.
Annexe 7 Tanins
- origine naturelle et utilisations des principaux
tanins.
Tanin gallique : Trouvé
dans les noix, les châtaignes, le thé et diverses plantes.
Tanin catéchique : Présent dans le cacao, le thé
vert, les pommes et les raisins.
Tanin ellagique : Trouvé dans les fruits à coque, les baies, les grenades et
certaines herbes.
Tanin condensé : Trouvé dans les écorces de chêne, les pommes, les pépins de
raisin, le chocolat noir, le vin rouge et certaines boissons alcoolisées.
Tanin acide tannique : Présent dans l'écorce de chêne, le café, le cacao et
diverses plantes.
Tanin ellagitannin : Trouvé dans les grenades, les
fraises et les noix.
- Quelques tanins couramment utilisés pour le
tannage des peaux
Tanin d'écorce de chêne
Tanin d'écorce de mimosa
Tanin de quebracho
(trois espèces d'arbres originaires d'Amérique latine et qui sont riches en tanins)
Tanin de châtaignier
Tanin de chêne-liège
Tanin d'écorce de pin
Tanin d'acacia
Tanin de myrobalan (nom porté par différentes espèces d'arbres tels que Prunus
cerasifera.)
Tanin de sumac (une liane de la famille des anacardiacées de son nom
scientifique Toxicodendron radicans)
Tanin de saule
Tanin de rhubarbe
Tanin de bouleau
Tanin de gambir (ou gambier, une espèce de plante
grimpante ligneuse de la famille des rubiacées)
Tanin de mangrove
Tanin de tara, un arbuste du Pérou (Caesalpina
spinosa)
Tanin d'eucalyptus
Annexe 8 Le collagène
Le collagène est une
protéine essentielle que l'on trouve abondamment dans les tissus conjonctifs du
corps des animaux, y compris celui des hommes. Il joue un rôle crucial dans la
résistance et l'élasticité des tissus, tels que la peau, les tendons, les os et
les vaisseaux sanguins. Sa structure est complexe.
|
|
La structure
moléculaire du collagène Le collagène est
caractérisé par une triple hélice. Chaque chaîne de
collagène est constituée d'une séquence d'acides aminés répétitive,
principalement composée de glycine, de proline et d'hydroxyproline (voir annexe 1). Ces acides aminés forment une structure en
triple hélice grâce à des liaisons hydrogène entre les résidus. Cette triple hélice
est essentielle pour la stabilité du collagène ; elle confère une résistance
mécanique aux tissus, permettant aux tendons et aux ligaments de supporter
des charges importantes, grâce notamment à l'hydroxyproline qui permet la
formation de liaisons covalentes entre les chaînes peptidiques voisines par
des réactions d'aldolisation. |
Fonctions et
applications du collagène
En dehors de ses fonctions biologiques, le collagène a des applications
industrielles et médicales importantes. Il est couramment utilisé en médecine
esthétique pour le comblement des rides et la restauration du volume facial. De
plus, il est utilisé dans la fabrication de produits cosmétiques et de
suppléments alimentaires pour améliorer la santé de la peau, des cheveux et des
ongles.
C'est une protéine essentielle à la fois pour la biologie et l'industrie.
Annexe 9 Les acides
chlorogéniques
Les
acides chlorogéniques sont des composés phénoliques, esters des acides
caféique, férulique et 4-hydroxycinnamique (ou p.coumarique) avec les fonctions
alcool de l'acide quinique en 3,4 et 5.
Dans les végétaux, les
acides chlorogéniques sont généralement des composés de défense ou des
précurseurs de la synthèse de la lignine. Leur présence augmente à la suite
d'une blessure des végétaux. Leur nom vient du fait qu'ils deviennent verts par
oxydation.
On distingue les acides
* 3 ou 4 ou 5-caféylquiniques (3-ACQ,
4-ACQ, 5-ACQ)
Ils sont prépondérants
dans les cafés arabica et constituent 86% de l'ensemble des acides
chlorogéniques ; le plus abondant étant le 5-ACQ qui représente 61% des acides caféylquiniques.
|
|
|
|
|
3-ACQ |
4-ACQ |
5-ACQ |
* 3 ou 4 ou
5-ferulylquiniques (3afq, 4afq, 5-afq)
|
|
|
|
|
3-AFQ |
4-AFQ |
5-AFQ |
*3 ou 4 ou 5-parahydroxycinnamylquiniques
(3-ACoQ, 4-ACoQ, 5-ACoQ)
|
|
|
|
|
3-ACoQ |
4-ACoQ |
5-ACoQ |
Annexe 10 Acide
cinnamique et stilbène
|
|
|
|
Acide trans-cinnamique |
trans-Stilbène |
Annexe 11 Monolignols
Ce sont des
composés précurseurs de la lignine, un constituant important de la paroi
cellulaire des végétaux.
Ce sont des
dérivés de l'alcool cinnamique :
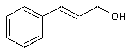
Les trois monolignols les plus importants sont :
- L'alcool p.coumarylique :
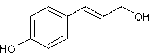
- L'alcool coniférylique
:
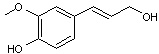
- L'alcool sinapylique
:
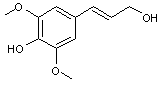
Annexe 12 Voies de
biosynthèse des entérolignanes
Les entérolignanes ou lignanes mammaliens (essentiellement l'entérodiol et
l'entérolactone), se forment dans l'organisme humain par dégradation de
lignanes d'origine végétale apportés par la nourriture, essentiellement le
pinorésinol et le matairésinol (que l'on désigne de ce fait par lignanes
précurseurs des entérolignanes), dans l'intestin, par action d'enzymes
bactériennes.
Parmi les voies de biosynthèse connues on trouve celles répertoriées
ci-dessous ; les principales enzymes qui interviennent sont citées près des
flèches des réactions :