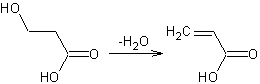MEDICAMENTS ET
MOLECULES PARTICULIERES (21)
|
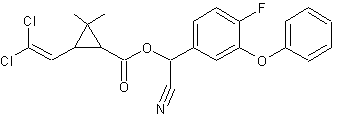
C22H18Cl2FNO3 Masse molaire : 434,287 g.mol-1 Fusion : 60°C Densité : 1,27 N° CAS : 68359-37-5 Sécurité :
|
|
Pyréthrinoïde de synthèse ayant une meilleure
stabilité à la lumière que les pyréthrines
naturelles. Son effet insecticide consiste à perturber le
transport du sodium dans les cellules bloquant ainsi la transmission de
l'influx nerveux et provoquant la mort par paralysie notamment chez les poux,
les mites et autres arthropodes. Cette molécule est toxique pour les abeilles et
très toxique pour les poissons. |
||
|
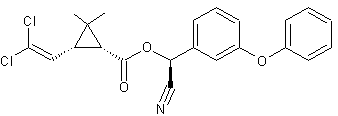
C22H19Cl2NO3 Masse molaire : 416,297 g.mol-1 Fusion : 70°C Densité : 1,25 (à 20°C) N° CAS : 52315-07-8 Sécurité :
|
|
Pyréthrinoïde de synthèse ayant une meilleure
stabilité à la lumière que les pyréthrines
naturelles. Son effet insecticide consiste à perturber le
transport du sodium dans les cellules bloquant ainsi la transmission de
l'influx nerveux et provoquant la mort par paralysie notamment chez les poux,
les mites et autres arthropodes. Cette molécule est toxique pour les abeilles et
très toxique pour les poissons. |
||
|
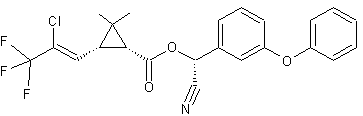
C23H19ClF3NO3 Masse molaire : 449,850 g.mol-1 Fusion : 49,2°C Ebullition : 188°C Densité : 1,344 N° CAS : 91465-08-6 Sécurité : S 1/2-28-36/37/39-38-45-60-61-13
|
|
Pyréthrinoïde de synthèse ayant une meilleure
stabilité à la lumière que les pyréthrines
naturelles. Son effet insecticide consiste à perturber le
transport du sodium dans les cellules bloquant ainsi la transmission de
l'influx nerveux et provoquant la mort par paralysie notamment chez les poux,
les mites et autres arthropodes. Cette molécule est toxique pour les abeilles et
très toxique pour les poissons. |
||
|
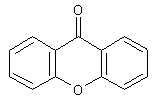
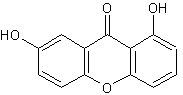
C13H8O2 Aspect : Cristaux en aiguilles lorsque recristallisé dans
l'éthanol. Masse molaire : 196,202 g.mol-1 Fusion : 174°C Ebullition : 351°C ; 146°C (sous 3 mm
de Hg) N° CAS : 90-47-1 Solubilité : Soluble dans l'éthanol, l'éther, le benzène, le
chloroforme ; légèrement solubles dans l'éther de pétrole ; insoluble dans
l'eau. |
La Xanthone Quelques xanthones :
L'euxanthone (voir ci-contre).
La gentisine (que l'on trouve dans les racines de la gentiane
jaune).
La mangiferitine (que l'on trouve sous forme d'hétéroside, la
mangiférine, dans les mangues).
L'alvaxanthone (un pigment présent dans l'écorce des racines de Muclura pomifera).
La mangostine (que l'on trouve dans le péricarpe des fruits du
mangoustanier…Voir ci-contre).
L'osajaxanthone
La jacareubine (présente dans Callophyllum
brasiliense).
La morelline (que l'on trouve dans le latex de Garcinia hanburyi).
La stérigmatocystine (une mycotoxine carcinogène produite dans certaines
conditions par Aspergillus versicolor). |
Cette molécule est le chef de file d'une série de
composés de couleur jaune,
polyhydroxylés appelés xanthones ( du grec xanthos = jaune) ayant des
propriétés antioxydantes. On en trouve dans la gentiane jaune (Gentiana lutea) appelée aussi grande
gentiane ou gentiane d'or que l'on trouve notamment en Auvergne et dont on
utilise la racine pour fabriquer des boissons alcoolisées (Suze, Avèze …..).
On en trouve aussi dans le péricarpe des fruits du mangoustanier (Garcinia mangostana), un arbre
tropical (Java, Bornéo….) pouvant atteindre 25m de haut. Les xanthones sont connues depuis très longtemps
; en 1844 le chimiste écossais Stenhouse (1809-1880) découvre l'euxanthone
dans le "jaune indien" un pigment de couleur jaune orangé utilisé
en Inde à partir du XVème siècle pour les miniatures ; il était obtenu après
évaporation de l'eau de l'urine des vaches nourries avec des feuilles de
manguiers. |
||
|
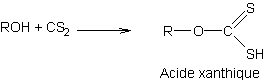
Acides xanthiques ou Acides xanthogéniques |
Réaction formelle conduisant à
un acide xanthique :
Un exemple de formation de xanthate :
|
Les sels de ces acides appelés xanthates ou
xanthogénates se forment lors de l'action d'un alcool en présence d'une base
alcaline sur le sulfure de carbone CS2. On peut formellement écrire une réaction de
formation de l'acide par réaction d'un alcool sur le sulfure de carbone, mais
les acides xanthiques sont très instables. |
||
|
ou 1,7-dihydroxy-3-méthoxy-9H-xanthen-9-one C14H10O5 Aspect : Cristaux orthorhombiques jaunes. Masse molaire : 258,226 g.mol-1 Fusion : 266,5°C N° CAS : 437-50-3 Solubilité : Très soluble dans l'éthanol ; soluble dans la
pyridine ; insoluble dans l'eau et l'acétone. |
|
Molécule polyhydroxylée (polyphénol) appartenant
à la famille des xanthones dont le chef de file est la xanthone. Ces produits
sont jaunes et possèdent des propriétés anti-oxydantes. On trouve de la gentisine dans les racines de la
gentiane jaune. |
||
|
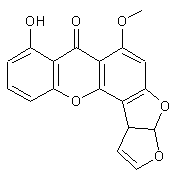
ou 1,3,6,7-tétrahydroxyxanthone C13H8O6 Masse molaire : 260,226 g.mol-1 Densité : 1,766 N° CAS : 3542-72-1 |
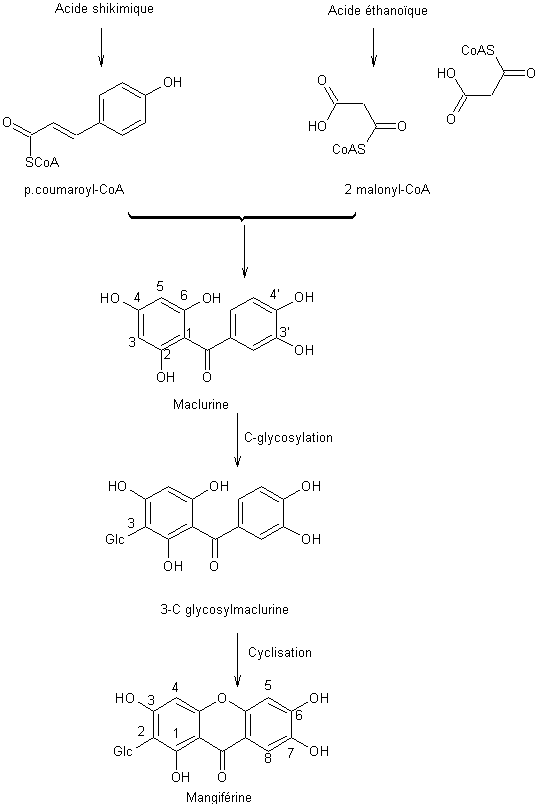
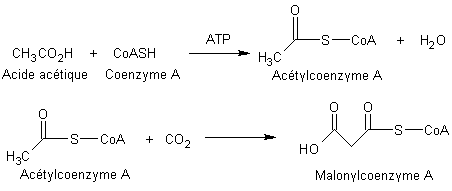
Mangiferitine Biosynthèse de la mangiférine :
On rappelle les étapes du passage de l'acide
éthanoïque (acide acétique) au malonyl-CoA :
|
Cette molécule est une xanthone, partie aglycone
d'un hétéroside la mangiférine que l'on trouve dans les mangues, mais aussi
dans une fougère (Cystopteris fragilis)
ainsi que dans Athyrium mesosorium, tripterospermum
lanceolatum, hypericum maculatum, Iris nigricans. |
||
|
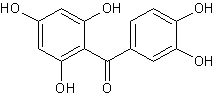
ou (3,4-dihydroxyphényl)(2,4,6-trihydroxyphényl)méthanone C13H10O6 Aspect : Cristaux jaunes en aiguilles (lorsque
recristallisé dans l'éthanol). Masse molaire : 262,214 g.mol-1 Fusion : 222,5°C N° CAS : Solubilité : Très soluble dans l'éthanol et l'éther. |
|
Colorant jaune utilisé comme teinture et extrait
du tronc de Morus tinctoria ("Bois
jaune") un arbre pouvant atteindre 60m de hauteur. Cette molécule est un intermédiaire dans la
biosynthèse de la mangiférine,
hétéroside ayant comme partie aglycone une xanthone la mangiferitine. |
||
|
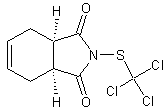
Captane ou N-(trichlorométhylthio)tétrahydro-1,2,3,6-phtalimide. C9H8Cl3NO2S Aspect : Cristaux blancs (lorsque recristallisé dans CCl4). Masse molaire : 300,590 g.mol-1 Fusion : 172,5°C N° CAS : 133-06-2 Densité : 1,74 (25°C) Solubilité : Très soluble dans le chloroforme. |
|
Fongicide de surface à large spectre utilisé pour
lutter contre les maladies des légumes, des fruits, du tabac, du gazon et des
plantes d'ornement. On peut l'utiliser pour traiter les semences de
maïs, de haricots, de pois et autres plantes cultivées ainsi que pour
maîtriser la moisissure des vinyles, laques, pâte à papier peint, caoutchoucs
et articles en polyéthylène. |
||
|
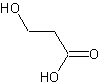
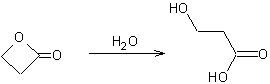
ou Acide 3-hydroxypropanoïque C3H6O3 Aspect : Liquide sirupeux Masse molaire : 90,078 g.mol-1 Ebullition : Se décompose N° CAS : 503-66-2 Densité : 1,4489 (20°C). Solubilité : Miscible à l'éther ; très soluble dans l'eau ;
soluble dans l'éthanol. |
Acide hydracrylique
Déshydratation de l'acide
hydracrylique qui conduit à l'acide acrylique.
La β-propiolactone réagit
lentement avec l'eau pour donner l'acide hydracrylique. |
Liquide visqueux qui se déshydrate en acide
acrylique et qui se forme lors de l'hydratation de la β-propiolactone.
Il est produit par certaines bactéries. Son pka est 4,5. |
||
|
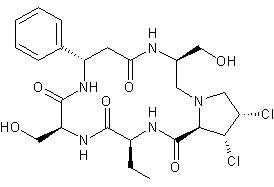
C24H31Cl2N5O7 Aspect : Cristaux en aiguilles (lorsque recristallisé dans
le méthanol). Masse molaire : 572,439 g.mol-1 Fusion : 255°C (se décompose) N° CAS : 12663-46-6 |
|
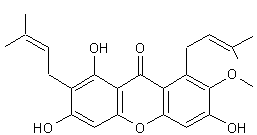
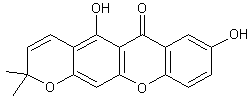
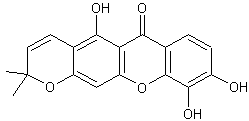
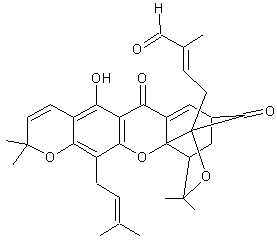
Métabolite secondaire d'un champignon, Penicillium islandicum ; cette toxine
provoque des nécroses hépatiques et a des propriétés cancérigènes. |
||
|
C23H22O6 Aspect : Cristaux blancs en aiguilles (si recristallisé
dans l'éthanol) ou en plaques (si recristallisé dans l'acétone dilué) Masse molaire : 394,417 g.mol-1 Fusion : 176°C Ebullition : 215°C (sous 0,5 mm de Hg) N° CAS : 83-79-4 Solubilité : Très soluble dans le chloroforme ; soluble dans
l'éthanol, l'acétone, le benzène ; légèrement soluble dans l'éther ;
insoluble dans l'eau |
|
Molécule isolée de plantes tropicales (Derris elliptica, Lonchocarpus nicou,
Tephrosia vogelii ….). Ses propriétés ichtyotoxiques (toxiques vis-à-vis
des poissons) sont connues depuis très longtemps ; ses propriétés
insecticides (animaux à sang froid) ont été découvertes plus récemment et ont
été utilisées en agriculture biologique pour les fruits. Depuis 2009 il est interdit de l'utiliser à ces
fins, à cause de sa neurotoxicité. Si cette molécule parvient au cerveau,
elle induit la maladie de Parkinson. |
||
|
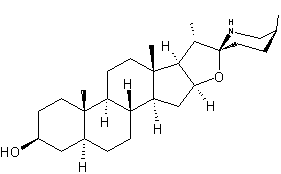
ou Spirosolan-3-ol, (3β,5α,22β,25S) C27H45NO2 Aspect : Cristaux en plaques. Masse molaire : 415,652 g.mol-1 Fusion : 210,5°C Ebullition : 527,2°C Densité : 1,1 Indice de réfraction : 1,56 N° CAS : 77-59-8 Solubilité : Soluble dans l'éthanol et l'éther. |
|
Partie aglycone d'un glycoalcaloïde, la tomatine, que l'on trouve dans les
extraits de racines des plants de tomate sauvage. La tomatine inhibe la croissance de divers
champignons et bactéries. La tomatine est un agent de précipitation des
stéroïdes. La tomatidine est un alcaloïde de structure semblable à celle
de la cyclopamine, mais qui
n'est pas tératogène. |
||
|
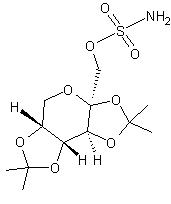
C12H21NO8
S Aspect : Cristaux blancs. Masse molaire : 339,36 g.mol-1 Fusion : 125°C Ebullition : 438,7°C Densité : 1,336 N° CAS : 97240-79-4 Solubilité : Soluble dans le DMSO. Risques : |
|
Substance active d'un médicament (Epitomax®)
servant à traiter des épilepsies généralisées (crises cloniques, toniques ou
tonico-cloniques) et des épilepsies partielles (crises partielles avec ou
sans généralisation). On l'utilise aussi comme traitement de fond des
migraines sévères. A noter que l'utilisation de ce médicament
entraîne une acidose métabolique hyperchlorémique à trou non anionique
(diminution du taux sérique de bicarbonate). |
||
|
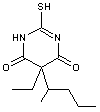
C11H18N2O2 S Masse molaire : 242,37 g.mol-1 Fusion : 159°C N° CAS : 76-75-5 |
|
Barbiturique utilisé sous sa forme sodique (S-
Na+ au lieu de SH) qui est soluble, pour induire et
entretenir une anesthésie générale intraveineuse (Pentothal®). A été utilisé parfois comme "sérum de
vérité". Molécule ayant servi pour les injections létales
(condamnés à mort). On appelle barbituriques, des dérivés dialcoylés
ou arylés au carbone de l'acide barbiturique ;
Ils ont été utilisés comme calmants somnifères et hypnotiques. |
||
|
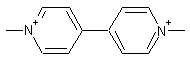
Paraquat (cation) C12H14N2 Masse molaire : 186,252 g.mol-1 N° CAS : 4685-14-7 Risques : R 24/25, 26, 36/37/38, 48/25,
50/53
|
|
Herbicide non sélectif à action rapide dont la
commercialisation et l'utilisation sont interdits dans l'union européenne, à
cause de sa forte toxicité (atteintes digestives, rénales..) ; il induit
également des lésions dégénératives du système nerveux (comme la maladie de
Parkinson) chez les rats. |
||
|
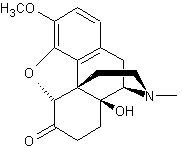
ou 7,8-dihydromorphin-6-one C17H19NO3 Aspect : Cristaux (recristallisée dans l'éthanol). Masse molaire : 285,338 g.mol-1 Fusion : 266,5°C N° CAS : 466-99-9 |
Hydromorphone Isomère de la morphine ; cette
molécule diffère de celle de la morphine par la présence sur le carbone 6
d'une fonction cétone au lieu d'une fonction alcool et par l'absence de
double liaison entre les carbones 7 et 8. C'est un composé
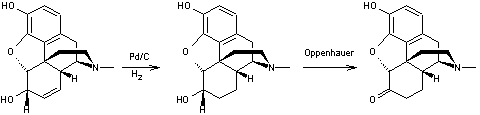
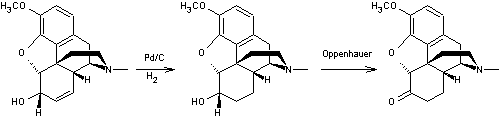
semi-synthétique obtenu à partir de la morphine : - soit par chauffage à reflux d'une solution
alcoolique ou d'une solution aqueuse (acide) de morphine en présence de
catalyseur (Pd ou Pt), il s'ensuit un réarrangement ; - soit par réduction
(hydrogénation catalytique) de la double liaison en 7-8 de la molécule de
morphine suivie par une oxydation par la benzophénone en présence de tertiobutylate
d'aluminium (oxydation d'Oppenauer).
Morphine Passage de la morphine à
l'hydromorphone
|
L'effet narcotique de cet opioïde est environ
cinq à sept fois supérieur à celui de la morphine à poids égal. Il sert
d'analgésique et c'est le plus puissant antitussif connu. L'efficacité de l'hydrocodéine comme antitussif
est due au fait que le foie transforme cette molécule en hydromorphine. Ce médicament découvert et étudié en Allemagne
entre 1924 et 1926 est commercialisé dans le monde sous les noms : Dilaudid®,
Palladone®, Opidol®, Hydromorphane®… |
||
|
ou Hydrocodone C18H21NO3 Masse molaire : 299,365 g.mol-1 Fusion : 198°C N° CAS : 125-29-1 Solubilité : Soluble dans l'éthanol ; insoluble dans l'eau. |
Dihydrocodéinone Isomère de la codéine ; cette
molécule diffère de celle de la codéine par la présence sur le carbone 6
d'une fonction cétone au lieu d'une fonction alcool et par l'absence de
double liaison entre les carbones 7 et 8. C'est un composé
semi-synthétique obtenu à partir de la codéine : - soit par chauffage à reflux d'une solution
alcoolique ou d'une solution aqueuse (acide) de codéine en présence de
catalyseur (Pd ou Pt), il s'ensuit un réarrangement ; - soit par réduction
(hydrogénation catalytique) de la double liaison en 7-8 de la molécule de
codéine suivie par une oxydation par la benzophénone en présence de tertiobutylate
d'aluminium (oxydation d'Oppenauer).
Codéine Passage de la codéine à la
dihydrocodéinone
|
Antitussif semi-synthétique et analgésique aux
actions semblables de façon qualitative à celles de la codéine ; son action
contre la toux est environ trois fois plus puissante à poids égal que celle
de la codéine. Le mécanisme d'action précis de la dihydrocodéine
et des autres opiacés n'est pas connu. |
||
|
ou 4,5-α-époxy-14-hydroxy-3-méthoxy-17-méthyl-morphinan-6-one ou Dihydro-14-hydroxycodéinone C18H21NO4 Aspect : Cristaux blancs. Masse molaire : 315,365 g.mol-1 Fusion : 219°C N° CAS : 76-42-6 Solubilité : Soluble dans l'éthanol, le chloroforme ;
insoluble dans l'eau et l'éther. |
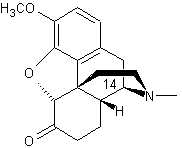
Oxycodone Cette molécule diffère de
l'hydrocodone par un groupement hydroxy en 14 présent dans la molécule
d'oxycodone et absent de la molécule d'hydrocodone.
Hydrocodone |
Opioïde dérivé de la codéine, à effet narcotique,
analgésique et antitussif. Son effet analgésique est environ deux fois
supérieur à celui de la morphine. On peut l’obtenir aussi à partir
de la thébaïne. C’est un agoniste
opioïde. C'est un stupéfiant. |
||
|
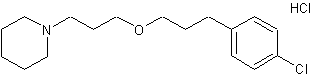
Pitolisant (chlorhydrate) ou 1-[3-[3-(4-chlorophényl)propoxy]propyl]-pipéridine. C17H26NOCl Masse molaire : 295,5 g.mol-1 N° CAS : 362665-56-3 |
|
Molécule permettant de lutter contre la
narcolepsie ; c'est aussi un antihistaminique H3. |
||
|
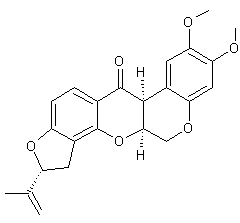
C21H24O5 Masse molaire : 356,412 g.mol-1 Densité : 1,18 Ebullition : 491,1°C N° CAS : 95851-37-9 |
|
Molécule existant dans un poivre chinois (Piper futokadsura) de la famille des
pipéracées ; elle présente une activité anti-inflammatoire, antihistaminique
par action sur les médiateurs de l'inflammation (facteur d’activation plaquettaire (PAF)). |
||
|
C8H15NO Masse molaire : 141,2108 g.mol-1 Densité : 0,918 Ebullition : 195°C N° CAS : 4396-01-4 |
|
Alcaloïde aux propriétés vermifuges, contenu dans
l'écorce des racines des grenadiers (punica
protopunica)d'où il a été extrait par Tanret (Charles-Joseph Tanret pharmacien
et chimiste français 1847-1917). Le nom de cette molécule a été donné en hommage à
Pelletier qui avec
Caventou a beaucoup travaillé sur les alcaloïdes. |
||
|
C46H56N4O9 Aspect : Cristaux Masse molaire : 808,959 g.mol-1 Fusion : 203°C N° CAS : 23360-92-1 Solubilité : Insoluble dans l'eau |
|
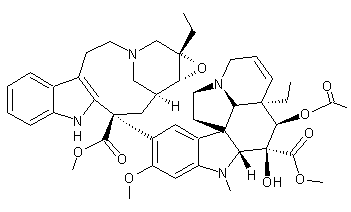
Molécule voisine de la vinblastine ; elle
présente chez les animaux une activité antitumorale mais ne peut être
utilisée avec succès dans la thérapie humaine à cause de sa toxicité
particulièrement élevée sur les organes hématopoïétiques. |
||
|
ou Claritine C22H23ClN2O2 Aspect : Cristaux Masse molaire : 382,883 g.mol-1 Fusion : 132°C N° CAS : 79794-75-5 |
|
Antihistaminique H1 sans effet sédatif ni
anticholinergique ; cette molécule est un médicament recommandé en
particulier pour soigner les rhinites allergiques et l'asthme ainsi que l'urticaire
chronique idiopathique. Les allergies sont des réponses immunitaires
excessives lorsque l'organisme entre en contact avec des substances
normalement inoffensives. L'histamine secrétée
alors par des cellules spécialisées est responsable des symptômes observés.
L'histamine se fixe sur les récepteurs H1. Les médicaments
antiallergiques vont avoir pour cibles
ces récepteurs histaminergiques. |
||
|
ou Kuromatsuène ou Junipène C15H24 Aspect : Liquide incolore à odeur d'essence de térébenthine. Masse molaire : 204,352 g.mol-1 Ebullition : 258,126°C (sous 18 mm de Hg) Densité : 0,9319 (à 18°C) Indice de réfraction : 1,5040 (à 20°C raie D du sodium) Pouvoir rotatoire : [α] = +42,73° Solubilité : Insoluble dans l'eau N° CAS : 475-20-7 |
|
Sesquiterpène
présent dans Pinus roxburghii (ex Pinus longifolia) un pin originaire de
l'Himalaya (altitude 500 à 2000m) mais qui pousse également au Népal et en
Inde. Sa structure a été établie par
le chimiste français Guy Ourisson (thèse obtenue en 1954 dans le laboratoire
de Georges Dupont à L'ENS). |
||
|
Hopane et Hopanes Les hopanes sont un groupe d'hydrocarbures ayant
la structure de base de l'hopane, un triterpène comportant cinq cycles :
quatre cyclohexanes et un cyclopentane. Des dérivés oxygénés existent
hopanetétrol par exemple. Des hopanes dépourvus d'oxygène ont été retrouvés
dans les pétroles, provenant des membranes cellulaires de bactéries
procaryotes (organismes unicellulaires dépourvus de noyau). On trouve aussi un hopène ou
diploptène dans les membranes de nombreuses bactéries. |
Hopane (C30H52)
; Masse molaire : 412,7339 g.mol-1 ; deux centres de
stéréoisomérie, les carbones 21 (α ou β) et 22 (R ou S), soit 4
stéréoisomères.
Hopanetétrol
(C35H62O4) |
Des hopanetétrols ont été retrouvés eux, dans les
membranes de certaines cyanobactéries unicellulaires (taille de 1 à 10 µm)
organismes capables de photosynthèse ; ces substances revêtent une importance
particulière car elles sont sans doute les précurseurs phylogénétiques des
stérols, molécules ubiquistes chez les eucaryotes (organismes vivants
possédant dans leurs cellules un noyau isolé du cytoplasme par une membrane
qui contient de l'ADN, s'opposant aux procaryotes). L'hopanetétrols a des propriétés
anti-inflammatoires dues au fait qu'il est capable d'inhiber la
transformation de l'acide arachidonique en lipoxines et prostaglandines. |
||
|
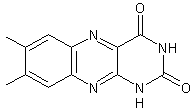
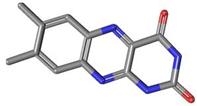
ou 7,8-diméthylbenzo[g]ptéridine-2,4(1H, 3H)-dione. C12H10N4O2 Aspect : Cristaux jaunes (lorsque le produit est
recristallisé dans le chloroforme). Masse molaire : 242,2334 g.mol-1 Fusion : 300°C N° CAS : 1086-80-2 Solubilité : Légèrement soluble dans l'eau, l'éthanol, le
chloroforme. |
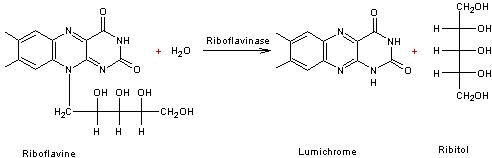
Lumichrome
|
La riboflavine
réagit sur l'eau, réaction catalysée par une enzyme la riboflavinase pour
donner du ribitol
et le lumichrome. |
||
|
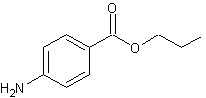
ou 4-aminobenzoate de propyle C10H13NO2 Aspect : Cristaux prismatiques. Masse molaire : 179,216 g.mol-1 Fusion : 75°C pKa : 2,49 N° CAS : 94-12-2 Solubilité : Très soluble dans le benzène, l'éther, l'éthanol,
le chloroforme. Sa solubilité dans l'eau est 842 mg/L à 37°C |
|
Ester de l'acide aminobenzoïque utilisé
comme anesthésique local comme la tétracaïne, la procaïne, la benzocaïne. |
||
|
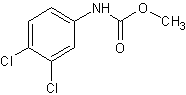
ou 3,4-dichlorophénylcarbamate de méthyle C8H7Cl2NO2 Aspect : Cristaux en aiguilles. Masse molaire : 220,054 g.mol-1 Fusion : 114°C N° CAS : 1918-18-9 Solubilité : Insoluble dans l'eau. |
|
Molécule utilisée comme herbicide. |
||
|
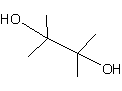
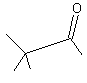
ou 2,3-diméthylbutane-2,3-diol C6H14O2 Aspect : Cristaux en aiguilles blanches lorsque
recristallisé dans l'éthanol ou l'éther. Masse molaire : 18,174 g.mol-1 Fusion : 43,32°C Ebullition : 174,4°C N° CAS : 76-09-5 Solubilité : Très soluble dans l'éthanol et l'éther ;
légèrement soluble dans l'eau et le sulfure de carbone. |
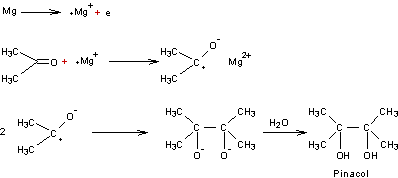
Pinacol
Réduction de la propanone par le magnésium en milieu acide.
Transposition pinacolique conduisant à la pinacolone |
Composé qui se forme lorsque l'on réduit la
propanone par un métal en milieu acide. C'est un α-diol (glycol) et sa déshydratation
s'accompagne d'un réarrangement moléculaire connu sous le nom de
"transposition pinacolique" et conduit à une cétone, la pinacolone. |
||
|
ou 3,3-diméthylbutane-2-one C6H12O Aspect : Liquide à odeur de menthe poivrée. Masse molaire : 100,158 g.mol-1 Fusion : -52,5°C Ebullition : 106,1°C Densité : 0,7229 (25°C) Indice de réfraction : 1,3952 (20°C raie D du sodium) N° CAS : 75-97-8 Solubilité : Soluble dans l'éthanol, l'éther et l'acétone ;
légèrement soluble dans l'eau. |
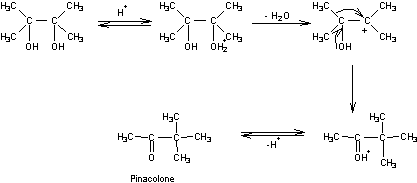
Pinacolone
Obtention de la pinacolone à partir du pinacol par
déshydratation suivie d'une transposition. |
C'est une cétone obtenue par déshydratation du
pinacol, un α-diol (glycol) ; au cours de cette réaction se produit une
transposition de la molécule appelée transposition pinacolique. La pinacolone est un intermédiaire de synthèse
(fongicide – herbicide). La molécule a une légère odeur de menthe poivrée.
|
||
|
C20H22O8 Aspect : Cristaux en aiguilles (si recristallisé dans
l'eau ; prismatiques si recristallisé dans l'éthanol). Masse molaire : 390,384 g.mol-1 Fusion : 180°C N° CAS : 99-17-2 |
|
Matière cristallisable trouvée dans les feuilles
et l'écorce du peuplier tremble (Populus
tremula,famille des salicacées), un arbre qui atteint 20m de haut et dont
la feuille tremble au moindre vent. C'est Braconnot qui l'a le premier extraite ;
voir la relation de Jöns Jakob Berzélius
dans son traité de chimie. |
||
|
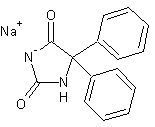
ou 5,5-Diphényl-2,4-imidazolidinedione, sel de
sodium ou Phénantoïne ou Phénytoïne C15H11N2NaO2 Masse molaire : 274,27 g.mpl-1 Fusion : 296°C Ebullition : 428,2°C N° CAS : 630-93-3 Solubilité : Soluble dans l'eau Risques :
|
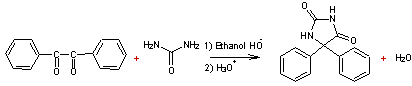
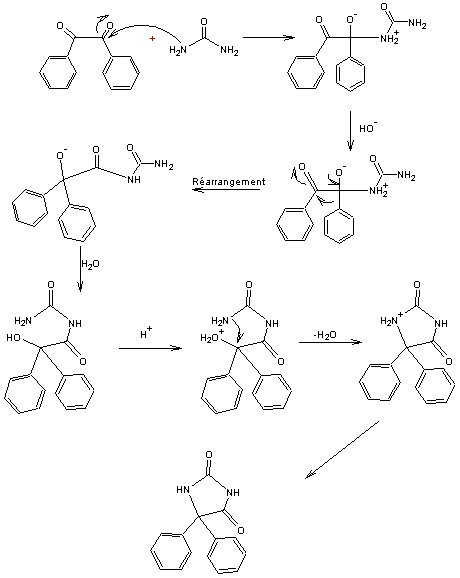
5,5-Diphénylhydantoïne On peut synthétiser
la phénantoïne par action de l'urée sur le benzile :
Le mécanisme de cette réaction est le suivant :
|
Cette molécule possède des propriétés
anticonvulsivantes. Cette activité anti-épileptique est vraisemblablement due
au blocage des canaux sodiques voltage-dépendant. La phénantoïne a aussi une action
antiarythmisante. |
||
|
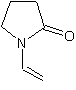
ou N-vinylpyrrolidone C6H9NO Masse molaire : 111,141 g.mol-1 Fusion : 13,5°C Ebullition : 193°C (sous 400 mm de Hg) 93°C (sous 11 mm de Hg) Densité : 1,04 (20°C) N° CAS : 88-12-0 |
|
Monomère conduisant au PVP (polyvinylpyrrolidone
ou povidone) par polymérisation. |