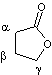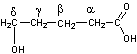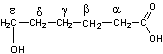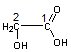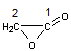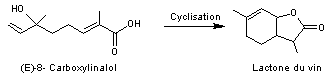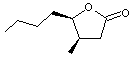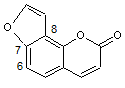DES
LACTONES
ou Olides
Gérard Gomez
Plan de l'étude
1) Définition –
Origine du nom
2) Quelques généralités
sur les lactones
2-1)
Nomenclature
2-2)
Propriétés organoleptiques de quelques lactones simples
3-1)
Lactones dans quelques boissons alcoolisées
3-2)
Les lactones et les plantes
3-3)
Diverses autres lactones relativement simples
4) Des lactones un
peu plus complexes
4-1)
Des lactones agissant sur la coagulation sanguine
4-2)
Des lactones à squelette stéroïdique
5-1)
Des antibiotiques
5-2)
D'autres macrolides
6) Lactones et
polymérisations par ouverture de cycle
6-1)
Le poly(glycolide) ou poly(acide glycolique) PGA
6-3)
Le poly(ε-caprolactone) ou PCL
6-4)
Le poly(3-hydroxybutyrate) ou PHB
7-1)
A partir des acides insaturés
7-2)
A partir de γ- ou d-hydroxy acides
8) Biosynthèse de
deux lactones dans les végétaux supérieurs
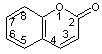
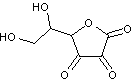
1) Définition – Origine du nom
Une
lactone est un ester cyclique.
Exemple
:
La
santonine
On peut
considérer les lactones comme des cycles formés par l'estérification interne
d'un hydroxyacide,
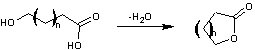
même si
pour nombre d'entre eux ce n'est pas ainsi qu'ils ont été formés.
Le nom
a été forgé à partir de celui d'un des premiers termes des hydroxyacides (acide
lactique)
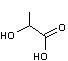
et du
suffixe "one" qui indique la présence du groupement cétone.
On se
sert aussi pour les désigner du suffixe "olide" bien qu'il soit
souvent utilisé pour les grands cycles (macrolides) ; nous en présentons un
certain nombre au paragraphe 5.
Les lactones
constituent une famille très nombreuse ; on en trouve beaucoup dans la nature
aussi bien dans la flore que dans la faune. Leur étude peut difficilement être
exhaustive.
On
partira des lactone dites simples, ce qui nous permettra d'envisager leur nomenclature
puis on citera quelques lactones à structure plus complexe ; on s'attachera
enfin à décrire leurs propriétés les plus marquantes.
2) Quelques généralités sur les lactones
2-1) Nomenclature
:
Envisageons
quelques hydroxyacides et les lactones correspondantes :
Remarque
1 :
La
façon la plus courante de nommer les lactones est celle donnée en premier dans
le tableau ci-dessous :
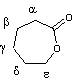
- Les positions
α,β,γ,d,ε,
correspondent à la position du groupe hydroxy par rapport au groupe carboxyle
dans l'hydroxyacide correspondant.
|
|
|
Le
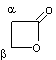
cycle contient
2 carbones c'est une α-lactone. |
|
Acide
2-hydroxyéthanoïque ou Acide
α-hydroxyacétique |
α-acétolactone |
|
|
|
|
Le
cycle contient
3 carbones c'est une β-lactone. |
|
Acide
3-hydroxypropanoïque ou Acide
β-hydroxypropanoïque ou acide hydracrylique |
β-Propiolactone ou 3-propanolide |
|
|
|
|
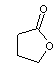
Le
cycle contient
4 carbones c'est une γ-lactone. |
|
Acide
4-hydroxybutanoïque ou Acide
γ-hydroxybutyrique |
γ-butyrolactone ou 4-butanolide |
|
|
|
|
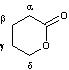
Le
cycle contient
5 carbones c'est une d-lactone. |
|
Acide
5-hydroxypentanoïque ou Acide
d-hydroxyvalérique |
d-valérolactone ou 5-pentanolide |
|
|
|
|
Le
cycle contient
6 carbones c'est une ε-lactone. |
|
Acide
6-hydroxyhexanoïque ou Acide
ε-hydroxycaproïque |
ε-caprolactone ou 6-hexanolide |
|
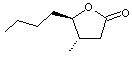
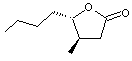
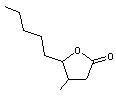
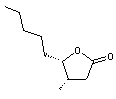
En
utilisant cette nomenclature, la molécule suivante
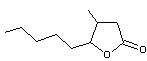
est
désignée par 3-Méthyl-4-butyl-γ-butyrolactone.
Remarque
2 :
Il existe
une autre façon de désigner les lactones, beaucoup moins courante que les
précédentes :
L'
α-acétolactone par exemple, peut être nommée 1,2-acétolactone.
On
considère alors que le carbone n°1 est celui du groupement carboxyle dans
l'acide correspondant et le numéro 2 celui du carbone de ce même acide portant
la fonction alcool.
|
|
|
Alors
l'ε-caprolactone
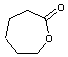
devient
la 1,6-caprolactone
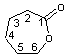
Remarque
3 :
- L'α-acétolactone qu'on peut considérer
comme l'époxyde du cétène H2C=C=O est une molécule très instable ;
elle a été détectée transitoirement dans des expériences de spectrométrie de
masse en 1997.
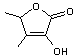
Par
contre la 2-méthyl-α-lactone
![]()
est un
composé stable.
- La 2-méthyl-α-lactone est
aussi couramment appelée l'α-propiolactone en considérant qu'il s'agit
d'une lactone α donc un cycle lactone à 2 carbones, le préfixe propio
indiquant que la molécule à 3 carbones en tout et donc qu'il existe une chaîne
latérale à 1 carbone.
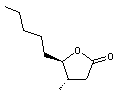
- De la même façon la molécule
suivante
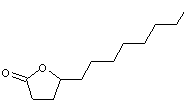
est
couramment désignée par γ-dodécalactone (lactone γ donc cycle lactone
à 4 carbones et chaîne latérale à 8 carbones, l'ensemble correspondant à 12
carbones d'où le préfixe dodéca).
- Le nom systématique d'une lactone
devrait être oxacycloalcan-2-one en vertu de la nomenclature des hétérocycles,
l'atome numéroté 1 dans le cycle étant alors l'atome d'oxygène.
Exemples :
|
|
|
|
|
oxacyclobutan-2-one |
oxacyclopentan-2-one |
5-méthyloxacyclopentan-2-one |
Ce
n'est pas celui qui est le plus couramment utilisé.
Dans ce
cas
* l'α-propiolactone
devient la 3-méthyloxacyclopropan-2-one
* la
γ-dodécalactone devient la 5-octyloxacyclopentan-2-one
2-2) Propriétés
organoleptiques de quelques lactones simples
Leurs propriétés
organoleptiques sont intéressantes et se caractérisent par une odeur fruitée,
en général agréable ; elles intéressent l'industrie alimentaire qui les
utilisent comme arômes ; on en trouve dans
un grand nombre d'aliments et de boissons.
Les
γ et les d
lactones sont les plus fréquentes (on parle aussi de 4-olides et 5-olides) ;
les γ-lactones étant plus fréquentes que les d-lactones ; ainsi 68%
des aliments contenant une ou plusieurs lactones renferment au moins une
γ-lactone contre 23% pour les d-lactones.
"Les
caractéristiques aromatiques des lactones sont influencées par la forme du
cycle, la longueur de la chaîne latérale, la présence de doubles liaisons, la
présence de substituants sur le cycle ou sur la chaîne" (Dufossé et col., 1994) ; on peut ajouter
la chiralité des molécules.
- Forme du cycle
|
γ-nonalactone |
Forte
odeur de noix de coco, arôme gras (Maga, 1976). Anis
réglisse (Aldrich,1990). Odeur
fruitée, amande (Dravnieks, 1985) |
|
d-décalactone |
Odeur
de pêche, huileux ; arôme de pêche, noix
de coco, beurre (Maga, 1976). Arôme
crémeux, doux, noix de coco, pêche, lait (Forss, 1972). |
- Longueur de la chaîne latérale
|
γ-pentalactone |
Arôme
doux, herbacé (Aldrich), odeur douce, légère, grasse, noix de coco,
bois/résineux (Dravnieks, 1985). |
|
γ-dodécalactone |
Odeur
grasse, pêche ; arôme de type pêche (Maga, 1976) ; beurre, musqué (Aldrich). |
- Présence de doubles liaisons
|
γ-pentalactone |
Arôme
doux, herbacé (Aldrich), odeur douce, légère, grasse, noix de coco,
bois/résineux (Dravnieks, 1985). |
|
γ-pent-3-ènolactone ou α-Angélicalactone |
Arôme
doux, odeur herbacée, proche de celle du tabac. |
- Présence d'autres fonctions sur la
chaîne
|
γ-nonalactone |
Forte
odeur de noix de coco, arôme gras (Maga, 1976). Anis
réglisse (Aldrich,1990). Odeur
fruitée, amande (Dravnieks, 1985) |
|
4-n-butylcarbonyl
γ-butyrolactone |
Odeur
d'agrumes (Ikan, 1986). |
- Chiralité des molécules
|
(R)-γ-décalactone |
Odeur
douce, agréable, fruitée ; arôme type pêche/abricot. |
|
(S)-γ-décalactone |
Odeur
douce de noix de coco. |
3) Quelques lactones simples
3-1) Lactones
dans quelques boissons alcoolisées
Le
vieillissement de certaines boissons alcoolisées (vins, Cognac, Whisky …) dans
des fûts de chêne améliorent leur saveur en apportant notamment des arômes
provenant du bois.
Les
chênes d'origine européenne (Quercus petraea, Quercus robur essentiellement)
sont les principales sources de la tonnellerie en France.
Parmi
les très nombreuses substances qui vont contribuer à l'arôme des boissons
vieillies en fûts de chêne, il y a des lactones qui se forment lentement au
cours du vieillissement à partir des substances propres à ces boissons, mais il
y a aussi les lactones provenant du bois de chêne, au rang desquelles des
γ-octa, nona et décalactones qui ont été identifiées. Elles confèrent aux
boissons des notes boisé/vanillé.
|
La
lactone du vin Elle se forme à partir du
8-carboxylinalol qui se cyclise et se convertit lentement au cours du temps
en lactone. |
Lactone
du vin
Formation
à partir du 8-carboxylinalol
|
"Cette lactone contribue
significativement au bouquet des vins blancs aromatiques tels que ceux de
Gewurztraminer. Cette molécule présente à de très faibles concentrations, se
forme très lentement au cours du vieillissement du vin" (Infowine,
revue Internet de viticulture et œnologie") ; elle n'est pas due au
vieillissement en fût de chêne. |
||||||||
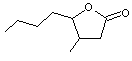
|
La
whisky lactone ou 3-méthyl-4-octanolide
Elle
possède 4 stéréo-isomères, la forme cis, en particulier l'isomère 3S,4S, est
la plus odorante. L'isomère
trans 3S,4R participe également au bouquet des boissons. |
Cis-3-méthyl-4-octanolide
Trans-3-méthyl-4-octanolide
|
Elle est apportée par le bois de
chêne lors du vieillissement en fût. Elles contribuent aux sensations de
"boisé", "vanille", "noix de coco". Il a été remarqué que la teneur en
ce composé continue à augmenter dans le vin même après la fin du contact du
vin avec le bois de chêne ; cela s'explique par la présence de précurseurs
glycosides qui se transforment en acide 3-méthyl-4- hydroxyoctanoïque
qui se lactonise. |
||||||||
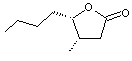
|
La
cognac lactone ou 3-méthyl-4-nonanolide
|
|
C'est l'analogue supérieure de la
whisky lactone et comme pour elle ce sont
les isomères 3S,4S et 3S,4R qui apportent des notes fruitées. Elles sont apportées par le bois de
chêne lors du vieillissement en fût. |
||||||||
|
Sotolone ou Sotolon ou 3-hydroxy-4,5-diméthylfuran-2(5H)-one Le nom
Sotolone formé du mot "soto", "sucre brut" en japonais et
"olone" contraction de énol lactone, est dû au fait que cette
molécule est responsable de la saveur du sucre brut. |
|
C'est un composé aromatique très puissant
présent dans le fenugrec (plante médicinale utilisée aussi comme condiment)
et la livèche (Levisticum officinale) une plante potagère. La sotolone est présente dans le
whisky, le calvados et certains vins doux (rancio). Elle n'est pas due au
vieillisement en fût de chêne. |
3-2) Les
lactones et les plantes
Des
lactones relativement simples jouent le rôle de régulateur de croissance pour
certains végétaux, d'autres d'inhibiteur de croissance et d'autres encore sont
produites par la plante en réaction à l'attaque d'un parasite.
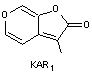
|
Les
karrikines Le nom
vient de "karrik" qui en langage aborigène des peuplades de l'ouest
de l'Australie signifie "la fumée". Certaines
plantes ont besoin de ces substances pour germer et ne se développent
qu'après un incendie ; les karrikines jouent un rôle analogue à la strigolactone,
une hormone de signalisation. Remarques : -
Toutes les plantes adaptées aux feux ne répondent pas aux karrikines. - Des
plantes comme les tomates ou certains arbres répondent aux karrikines bien
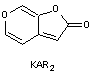
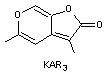
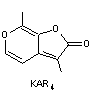
que n'étant pas des plantes adaptées aux feux. - KAR1
le premier à avoir été découvert en 2004 est appelé karrikinolode. |
|
Ce
sont des buténolides qui se forment dans la fumée des matières végétales
enflammées. Ils
stimulent le développement des plantes (régulateur de croissance) et la
germination des graines. C'est la transformation des glucides et de la
cellulose par chauffage qui y conduit :
Les
numéros des karrikines correspondent à l'ordre dans lequel elles ont été
trouvées. |
||||
|
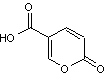
L'acide
coumalique C'est
un solide de formule moléculaire C6H4O4 qui se
présente sous forme de cristaux prismatiques jaune clair lorsque
recristallisé dans le méthanol. Sa
masse molaire est 140,094 g.mol-1 et son point de fusion de 207°C
température à laquelle il se décompose. |
|
Cette d-lactone inhibe la
croissance des radicelles de certaines céréales. |
||||
|
Les
coumarines On
distingue deux groupes de coumarines - Celles
dérivant de la 1-benzopyran-2-one par substitution d'un ou plusieurs hydrogènes
portés par les carbones 6,7 ou 8 par des groupes hydroxy (OH) ou méthoxy (OCH3)
; c'est le cas de L'ombelliférone,
présente dans les carottes, le coriandre. L'esculétine,
présente dans le marron d'Inde . Le
fraxétol que
l'on trouve dans l'écorce des frênes ou des marrons d'Inde. - Les
furocoumarines ou furanocoumarines, formées d'un noyau furane, accolé au noyau
1-benzopyran-2-one substitué ou non ; c'est le cas du de ou de |
Coumarine
Ombelliférone
Esculétine
Fraxétol
Psoralène
Angélicine
Impératorine |
Les
coumarines sont des molécules dérivées de la coumarine ou
1-benzopyran-2-one, qui
tire son nom d'un arbre de la famille des fabacées (papilionacées ou
légumineuses) le coumarou, encore appelé gaïac de Cayenne (dipteryx odorata) qui pousse en
Amérique centrale ou en Amérique du sud et dont la graine odorante appelée fève de tonka en contient. La
biosynthèse de la coumarine, du psoralène, de l'angélicine et de
l'ombelliférone, à partir de l'acide shikimique dans les végétaux supérieurs,
est donnée au paragraphe 7. - Propriétés
de la coumarine, l'ombelliférones et molécules apparentées : Ces
coumarines sont utilisées comme agents de saveur ou dans les parfums (la fève
de tonka est parfois utilisée pour l'aromatisation des tabacs) ; on les
utilise aussi dans l'industrie pharmaceutique, la coumarine a des propriétés
anti-inflammatoires, l'esculétine ou l'esculine sont des agents vitaminiques
P à action marquée sur la perméabilité capillaire, ou encore le dicoumarol découvert dans le mélilot
(Melilotus officinalis) et qui a
des propriétés anticoagulantes (antivitamines K) - Propriétés
des furanocoumarines : L'impératorine
est une furocoumarine que l'on trouve dans Zanthoxylum americanum, arbuste qui pousse au centre, à l'est des
USA et au Canada, de la famille des rutacées. D'une
façon générale, les furocoumarines
sont des phytoalexines à spectre relativement large (voir annexe 1). On les
trouve principalement dans les légumineuses, les moracées, les rutacées et
les apiacées. |
3-3) Diverses
autres lactones relativement simples :
|
Acide
L(+)-ascorbique ou (5R)-5-[(1S)-1,2-dihydroxyéthyl]-3,4-dihydroxyfuran-2-one C'est la γ-lactone de l'acide
2,3,4,5,6 pentahydroxyhex-2-ènoïque. Nomenclature : - On peut classer cette lactone dans
la famille des furanones eu égard à l'existence du noyau furane et à la
fonction cétone. - On peut aussi l'associer à la
famille des buténolides ; existence de 4 carbones dans le cycle, d'une double
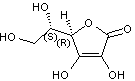
liaison carbone-carbone et de la fonction lactone. C6H8O6 Masse molaire 176,124 g.mol-1 |
Acide L(+)-ascorbique
Acide déhydroascorbique (Dha) Apports: Fruits frais (agrumes, kiwis),
certains légumes (tomates, poivrons, brocolis, persil, choux). Provoque le scorbut. Le scorbut qui a disparu de nos jours
dans nos pays, a marqué autrefois les grands voyages maritimes pendant
lesquels il n'était pas possible de consommer des légumes ou des fruits
frais. La vitamine C n'est pas présente dans
les conserves, car elle est détruite par la chaleur. L'apport quotidien recommandé (AQR)
en vitamine C est d'environ 100 mg. |
C'est la forme naturelle de la vitamine C. C'est une vitamine hydrosoluble. Elle intervient dans de nombreux métabolismes ; facilite de nombreuses
synthèses. Elle renforce les défenses naturelles de l'organisme. L'acide ascorbique est un réducteur, sa fonction énol étant très
oxydable. Lorsqu'il a été oxydé il devient l'acide déhydroascorbique (Dha)
Rôle biochimique :
transferts d'hydrogène (réduction du tocophérol,
dégradation de la tyrosine, réduction
de l'acide folique en
acide tétrahydrofolique). L'acide L-ascorbique se forme dans l'organisme animal à partir de l'acide glucuronique
par l'intermédiaire de l'acide
L-gulonique et de la γ-lactone
de l'acide gulonique. Utilisations : Additif alimentaire : E300 ; |
|
α-Angelicalactone ou γ-lactone de l'acide
4-hydroxypent-3-ènoique Composé cristallisé blanc à température ordinaire, l'angelicalactone
possède une odeur douce, huileuse, de solvant, de noix de coco. |
|
C'est un buténolide. Cette molécule est un anticarcinogène ; elle a un effet sur l'action de
l'enzyme glutathion-S-transférase (GST). |
|
C10H14O2 |
|
d-Lactone iridoïde que l'on
trouve dans Nepeta cataria et que
l'on a aussi isolé de Lonicera tatarica
(Chèvrefeuille de Tartarie) et qui a un effet attractif sur les chats (et les
tigres). La Cataire ou Chataire (Nepeta cataria) appartient à la
famille des lamiacées (dont les menthes font partie) et porte le nom
"d'herbe aux chats" ou "menthe aux chats" (Katzenminze en
allemand ; Menta de gato en espagnol ; Catnip en anglais). Les effets de la cataire
sur les chats sont voisins de ceux qu'exercent les valépotriates contenues
dans la valériane (Valeriana
officinalis L.)appelée aussi
"herbe aux chats". |
|
ou 4-Hydroxy-4H-furo[3,2-c]pyran-2(6H)-one C7H6O4 |
|
La
patuline est une mycotoxine c'est-à-dire une molécule toxique produite par
des moisissures (champignons microscopiques) tels que Aspergillus sp.et Penicillium
sp. Elle
est très difficilement décelable car elle n'altère pas les propriétés
organoleptiques des fruits (pommes, poires, coings, abricots, bananes,
pêches, raisin….) dans lesquelles elle est présente, ni des jus qui en
découlent (jus de pomme, jus de raisin..). Elle est détruite en milieu alcool
fort, mais la pasteurisation l'épargne. On
en trouve aussi dans le blé, le maïs, le riz, le soja, l'avoine, la luzerne
….). Elle
présente de sérieux risques pour l'homme même à faible dose (lésions aux
poumons, reins, rate…) |
4) Des lactones un
peu plus complexes
Certaines lactones ont une structure
un peu plus complexe, avec plusieurs cycles (terpénique ou stéroïdique) et des
propriétés intéressantes.
4-1)
Des lactones agissant sur la coagulation sanguine
|
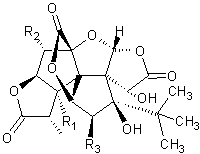
Les Ginkgolides Ginkgolide A : C20H24O9 Masse molaire : 480,4 g.mol-1 N° CAS : 15291-75-5 Solubilité : insoluble dans l'eau ; soluble dans le DMSO. Ginkgolide B : Masse molaire : 424,4 g.mol-1 Fusion : env.300°C N° CAS : 15291-77-7 Solubilité : insoluble dans l'eau ; soluble dans le DMSO. Ginkgolide C : Masse molaire : 440,4 g.mol-1 Fusion : env.300°C (se décompose). N° CAS : 15291-76-6 Solubilité : insoluble dans l'eau ; soluble dans le DMSO. Ginkgolide J : Masse molaire : 424,4 g.mol-1 N° CAS : 107438-79-9 Solubilité : insoluble dans l'eau ; soluble dans le DMSO. |
Remarque : Par dégradation les ginkgolides
conduisent à des trilactones sesquiterpéniques appelées bilobalides
biologiquement actives et que l'on trouve aussi dans les feuilles de
ginkgobiloba. |
Trilactones à structure
diterpénique, biologiquement actives présentes dans les feuilles de Ginkgo
biloba, arbre chinois de la famille des ginkgoacées. Action vasculoprotectrice ; contre
les douleurs dues au rétrécissement des artères par dépôt de cholestérol. Ces molécules permettraient
d'améliorer les facultés intellectuelles des sujets âgés. Les ginkgolides A,B,C,J,K,L,M sont
des antagonistes spécifiques et sélectifs des récepteurs du facteur
d'activation plaquettaire (PAFR) qui est un dérivé acétylé de la
glycérophosphorylcholine (dont un des principaux effets est d'entraîner une
agrégation plaquettaire). Le ginkgolide B est le plus
puissant. Le ginkgolide B possèderait également des effets
anti-inflammatoires, anti-allergiques, antioxydants et neuroprotecteurs. Elias J. Corey et son équipe ont
mené à bien la synthèse totale du ginkgolide B en 1988. |
||||||||||||||||||||||||||||
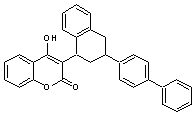
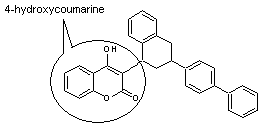
|
ou 2-hydroxy-3-[3-(4-phénylphényl)-1-tétralinyl]-4-chroménone. ou 3-(3-biphényl-4-yl-1,2,3,4-tétrahydro-1-naphthyl)-4-hydroxycoumarine. C31H24O3 Aspect : Solide cireux, rouge. |
|
C'est une d-lactone,
un dérivé coumarinique. Il agit comme anticoagulant et est utilisé comme
rodenticide (lutte contre certains rongeurs : rats, souris ….). Sa formule ne diffère de celle du brodifacoum, un
autre rodenticide que par l'existence dans ce dernier d'un atome de brome. |
4-2)
Des lactones à squelette stéroïdique
Les lactones sont fixées à
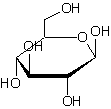
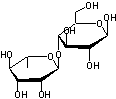
l'extrémité d'une structure stéroïdique, laquelle est liée à un glucide par
condensation au niveau de la fonction alcool en C3 (voir annexe
2).
Ce sont pour la plupart des
hétérosides cardiotoniques, toxiques pour l'homme et les mammifères en général
que l'on retrouve dans certains végétaux et qui sont pour ces plantes des
moyens de défense.
A)
Des γ-lactones
Ce sont essentiellement des
cardénolides, hétérosides à structure stéroïdique présents dans des plantes
toxiques.
|
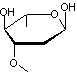
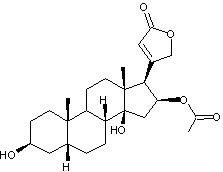
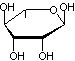
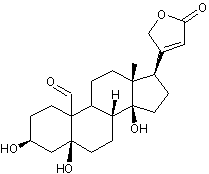
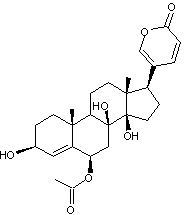
Digitaline ou Digitoxine C41H64O13 La partie glucidique est un
ensemble de 3 molécules de Digitoxose liées par liaisons 1->6
Remarque : La molécule de digitoxose peut également être dénommée : 2,6-didéoxy-D-altropyranose. |
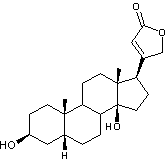
La partie aglycone de cet
hétéroside est la digitoxigénine
|
Hétéroside extrait de la digitale
(Digitalis purpurea plante toxique) et purifié pour la première fois par
Claude-Adolphe Nativelle après 25 ans d’efforts. La digitaline est un stéroïde
cardénolide, formé d'un noyau stérane, prolongé d'un cycle lactonique
à 5 côtés comportant une double liaison, fixé en C17 , ainsi que
deux fonctions alcool en C3, C14 et deux groupements
méthyle en C10 et C13. Elle traite les insuffisances
cardiaques. Voir l'annexe 2
pour la structure et la numérotation du noyau stérane et du noyau
cardénolide. |
|
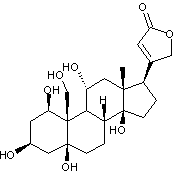
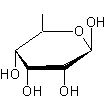
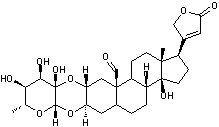
C41H64O14 La partie glucidique
est un ensemble de 3 molécules de β-Digitoxose liées par liaisons
1->6
|
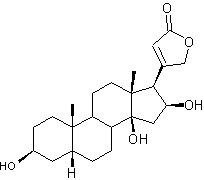
Gitoxigénine partie aglycone de la Gitoxine
|
Hétéroside dont la partie aglycone
est la gitoxigénine et qui est extrait de la digitale pourpre (Digitalis purpurea plante toxique). La
gitoxine est un stéroïde cardénolide ; Cette molécule ne diffère de
celle de digitaline que par la présence d'une
fonction alcool supplémentaire en C16. C'est un cardiotonique. Voir l'annexe 2
pour la structure et la numérotation du noyau stérane et du noyau
cardénolide. |
|
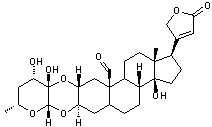
ou Lanoxine C41H64O14 La partie glucidique est un ensemble de 3 molécules de
β-Digitoxose liées par liaisons 1->6
|
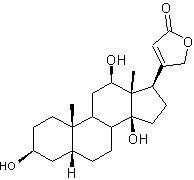
Digoxigénine partie aglycone de la digoxine
|
Hétéroside cardiotonique utilisé
dans les troubles du rythme cardiaque supraventriculaire. On en trouve dans la digitale
laineuse (digitalis lanata) de la
famille des plantaginacées, plante bi-annuelle ; ses fleurs ressemblent à des
doigts de gant et sont recouvertes de duvet laineux. C'est un stéroïde cardénolide. Cette molécule ne diffère de celle
de digitaline que par la présence d'une fonction
alcool supplémentaire en C12. Voir l'annexe 2
pour la structure et la numérotation du noyau stérane et du noyau
cardénolide. |
|
C32H48O9 La partie glucidique est le 2,6-didéoxy-3-O-méthyl-α-L-glucopyranose.
|
Oléandrigénine partie aglycone
de l'oléandrine
Cette molécule ne
diffère de celle de la gitoxigénine que par le fait que la fonction alcool en
C16 est ici estérifiée par l'acide éthanoïque. |
C'est un membre de la
famille des stéroïdes cardénolides ; c'est un hétéroside vénéneux présent
dans les feuilles, la sève, l'écorce
du "laurier" rose (Nerium
oleander) un arbuste de la famille des Apocynacées qui pousse dans le
bassin méditérranéen, l'Asie mineure, l'Inde et le Japon. C'est Wilhelm Neumann
(né en 1898, Professeur à Wurzbourg) qui a travaillé entre autres sur la
chimie des substances extraites du laurier rose (ou oléandre) et qui a établi
que l'oléandrine était un trait d'union entre les poisons cardiaques
stéroïdiques végétaux et animaux (venin de crapaud). |
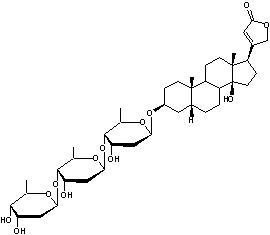
|
ou Strophanthine G C29H44O12 La partie glucidique est le 6-déoxy-α-L-mannopyranose
|
Ouabaïgénine partie aglycone de l'ouabaïne
|
Hétéroside que l’on
trouve dans les lianes et les racines d’un arbre d’Abyssinie l’Acokanthera ouabaio (apocynacées) et
dans les graines de Strophantus gratus (apocynacées). Cette molécule possède
des propriétés cardiotoniques par inhibition de la pompe à sodium Na+/K+-ATPase. L’ouabaïne servait à
empoisonner les flèches des guerriers somalis. |
|
C29H42O10 La partie glucidique est le 6-déoxy-β-D-Allopyranose
|
Convallatoxigénine partie aglycone
de la convallatoxine
|
C'est une toxine
contenue dans le muguet (Convallaria
majalis). C'est un hétéroside
cardiotonique à structure et propriétés voisines de l'ouabaïne. C'est un stéroïde
cardénolide. |
|
ou 4'β-hydroxy-19-oxogomphoside C29H40O10 |
|
Cette molécule a été
isolée des feuilles, tiges, racines, latex de Calotropis procera, arbuste à latex de la famille des Asclépiadacées
(Afrique intertropicale : régions sèches). Elle fait partie du groupe des
cardénolides. Composé toxique
(provoque des arrêts cardiaques). |
|
C29H40O9 |
|
On trouve cette
molécule (qui appartient aussi au groupe des cardénolides) dans Calotropis procera, arbuste à latex de
la famille des Asclépiadacées (Afrique intertropicale : régions sèches). Le
latex en contient une quantité notable. C'est un dangereux cardiotoxique qui
était utilisé lors de la confection de flèches empoisonnées. |
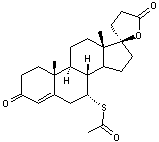
|
C24H32O4S |
|
Lactone à structure
stéroïdique anti-hypertenseur et à faible effet diurétique. C'est un anti-aldostérone |
B)
Des d-lactones
Ce sont essentiellement des
bufadiènolides, des hétérosides à structure stéroïdique, que l'on retrouve chez
de nombreuses plantes, Crassulacées, Iridacées, Renonculacées
mais aussi dans le venin d'animaux, crapauds (Bufo) d'où dérive leur
nom, serpents. Ils sont toxiques pour les hommes et les animaux et cela pose de
nombreux problèmes dans l'élevage en Australie et en Afrique du sud.
Le mot Bufadiènolide a été construit
à partir de Bufo (crapaud), diène (deux liaisons C=C dans le
noyau lactone) et olide (lactone).
|
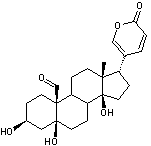
C32H44O12 La partie glucidique est le β-D-Glucopyranose.
|
Scillirosidine partie
aglycone de la Scilliroside
|
Cet hétéroside
apparenté aux digitaliques (digitaline) est contenu dans le bulbe de la
scille rouge ; c'est un bufadiénolide c'est-à-dire un stéroïde possédant
notamment un cycle lactonique à 6 côtés (d-lactone), doublement insaturé, fixé en C17
(voir annexe 2). Le nom de cette famille
(bufadiénolide) dérive de celui du crapaud buffle (Bufo toad) qui a des
glandes produisant certains de ces
hétérosides. La scille (Scilla maritima ou Urginea maritima) est une plante à
bulbe de petite taille ; espèces ressemblant aux jacinthes. Il existe deux
variétés de scille, la scille rouge (d'Espagne) et la scille blanche
(d'Italie). Ce sont des plantes toxique du fait des
hétérosides qu'elles contiennent et qui agissent sur le rythme cardiaque.
Seule la scille rouge contient du scilliroside. Le scilliroside est
diurétique à petite dose ; c'est aussi un rodenticide. |
|
Helléborine ou 3β-(O-4-β-D-glucopyranosyl-α-L-rhamnopyranosyloxy)-5,14-dihydroxy-19-oxo-5β,14-β-bufa-20,22-diènolide. C36H52O15 La partie glucidique est un
enchaînement de α-L-rhamnopyranose et de β-D-glucopyranose par
liaison 1-4-O-glycosidique.
|
Hellébrigénine partie
aglycone de l' Helléborine
C'est un stérol
bufadiénolide c'est-à-dire un stérol lié en C17 à un cycle
lactonique à 6 côtés, doublement insaturé (voir annexe 2). |
On trouve cet hétéroside
dans l'hellébore noir, qui est une renonculacée à fleurs blanches. Cette
espèce fleurit de décembre à mars ("rose de Noël"). Elle passait pour
guérir la folie chez les Anciens et cette célébrité est restée sous forme
d'anecdote. Cette plante est un poison violent, agissant sur le cœur, un
purgatif très énergique et elle peut provoquer des avortements. |
|
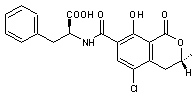
Ochratoxine A C'est une d-lactone. Sa découverte dans les boissons à base
de raisin est relativement récente. |
|
L' ochratoxine A (OTA) est une
mycotoxine produite par des moisissures appartenant aux genres Aspergillus
(Aspergillus ochraceus )ou Penicillium (Penicillium verrucosum). |
|
C28H21NO8 C'est une d-lactone. |
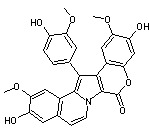
|
Molécule antitumorale extraite des
ascidies, organismes marins. Elle tue les cellules cancéreuses
par apoptose (très forte inhibition de la topoisomérase I ; cet enzyme
nucléaire peut couper un brin de l'ADN ; il est nécessaire lors des étapes de
réplication ; si on l'inhibe, la seule issue est la mort de la cellule). Elle appartient à la famille des
lamellarines, alcaloïdes pyrroliques hexacycliques, d'origine marine. |
|
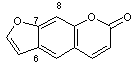
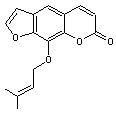
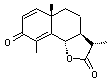
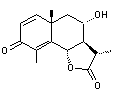
Santonine C'est une γ-lactone |
|
Molécule utilisée dans le
traitement et le contrôle des infestations par nématode. Cette molécule est présente dans
les capitules d'Artemisia cina (ou A. pauciflora) de la famille des
composées (ou Astéracées), plante que l'on trouve en Russie, en Chine, au
Turkestan et dans la partie sud de l'Oural. |
|
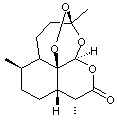
C'est une d-lactone. |
|
C'est une lactone, sesquiterpénique portant un groupe
peroxyde (C-O-O-C), dont un des nombreux stéréoisomères (la molécule présente
sept carbones asymétriques) synthétisé par l'armoise annuelle (Artemisia
annua) s'est révélé actif contre le parasite du paludisme (malaria en
anglais), Plasmodium falciparum. |
|
Artémisine C'est une γ-lactone |
|
Substance extraite de Artemisia
annua, plante du nord de la Chine connue sous le nom d'armoise annuelle
(différente de l'armoise commune). A ne pas confondre avec l'artémisinine qui est une molécule employée dans le
traitement du paludisme. |
|
Absinthine C'est une di-γ-lactone |
|
Molécule présente dans l'absinthe
(Artemisia absinthium) à 0,2-0,3%.
C'est elle qui donne l'amertume à la boisson que l'on fabrique à partir de
cette plante. Ce composé a une activité
anti-inflammatoire. |
|
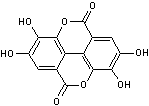
Acide ellagique C'est une di-d-lactone |
|
Substance présente dans les tanins
(ellagitanins) produits par de nombreux fruits ; On en trouve par exemple
dans ·
Vaccinium myrtillus (Canneberge) ·
Punica granatum (grenadier) ·
Fragaria vesca (fraisier) famille des rosacées. ·
Juglans regia (noyer commun) famille des juglandacées. L'acide ellagique est un composé
astringent soluble dans l'eau. |
Certaines lactones dites à
macrocycle peuvent comporter un cycle à 14,15 ou 16 sommets et sont appelées
macrolides.
Exemple de macrolide à 14 sommets (13 carbones)
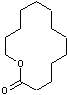
5-1) Des
antibiotiques
Les macrolides sont généralement
indiqués lorsqu'un traitement par β-lactamine est impossible.
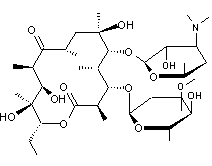
C'est une molécule produite
naturellement par Saccharopolyspora erythraea .
Son spectre est comparable à celui
des pénicillines. Il est parfois utilisé dans les cas d'intolérance aux
pénicillines
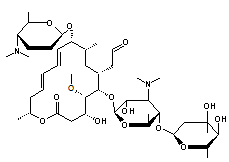
Utilisée pour des aérobies à Gram
(+) comme Streptococcus pneumoniae, des aérobies à Gram (-) comme legionella,
ou d'autres comme chlamydia.
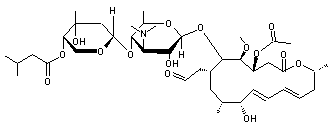
Cet antibiotique à large spectre
peut être obtenu par fermentation de Streptomyces narbonensis.
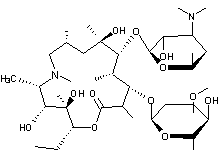
Macrolide dont le macrocycle a 15
atomes.
C'est un antibiotique utilisé pour
les infections génito-urinaires et les infections des voies respiratoires.
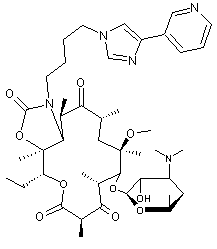
Il s'agit d'un dérivé
semi-synthétique de l'érythromycine.
Cet antibiotique est utilisé pour
traiter les pneumonies dues à Streptococcus pneumoniae, Hemophilus
influenzae ou encore Chlamydophila pneumoniae.
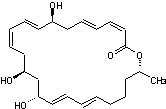
Molécule découverte en 1989 par le
Professeur William Fenical (Scripps Research Institute de San Diego) et
extraite la première fois d'un micro-organisme des fonds marins.
Cette molécule, la plus abondante
des 14 extraites du micro-organisme est une macrolactone à 24 chaînons avec 3
systèmes diéniques conjugués dont 2 (Z,E) et 4 carbones asymétriques oxygénés.
C'est un antibiotique à large
spectre s'avérant efficace notamment contre l'entérocoque résistant à la vancomycine
(VRE) et le staphylocoque doré, résistant à la méthicilline (MRSA).On l'obtient
à partir de Bacillus polyfermenticus KJS-2.
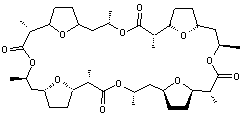
-
Nonactine
Antibiotique ionophore, formant des
complexes avec notamment les ions potassium (K+). Un ionophore rend
les membranes cellulaires perméables à certains ions.
5-2)
D'autres macrolides
-
Tacrolimus ou FK-506 ou Fujimycine (C44H69NO12)

Le tacrolimus est un médicament (nom
commercial : Prograf ®, Advagraf ®, ou Protopic ®) immunosuppresseur, produit
naturellement par un actinomycète (Streptomyces
tsukubaensis) champignon microscopique. Cette molécule a été isolée au
japon près de la ville de Tsukuba et son efficacité a été mise en évidence pour
la première fois par Thomas Starzl (Université de Pittsburgh en Pennsylvanie)
en 1989 sur des patients ayant subi une greffe hépatique.
Il constitue une alternative à la ciclosporine
(particulièrement dans les cas de rejet réfractaire à la ciclosporine) et a une
activité in vitro 100 fois supérieure
à celle-ci.
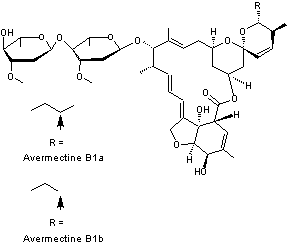
-
Abamectine et avermectines
6) Lactones et
polymérisations par ouverture de cycle
Certains polymères s'obtiennent par
une polymérisation dite "par ouverture de cycle" ; il s'agit
notamment du PGA (poly(glycolide)), du PLA (Poly(lactide)) et du PCL
(poly(ε-caprolactone)) et du PHB (poly-β-hydroxybutyrate)
qui sont issus de monomères lactones.
6-1)
Le poly(glycolide) ou poly(acide glycolique) PGA
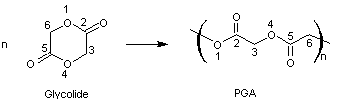
Le glycolide ou p.dioxanne-2,5-dione
est une dilactone, monomère du PGA (poly(glycolide)).
Le PGA est un polymère
thermoplastique, le plus simple des polyesters aliphatiques linéaires, le
premier polymère biodégradable qui a été utilisé pour des fils de suture.
Le PGA est plus hydrophile que le
PLA.
Le polymère est dégradable dans
l'organisme par hydrolyse des fonctions esters qui conduit d'abord à des
oligomères puis à l'acide
glycolique ; on peut traduire cette dégradation globale par
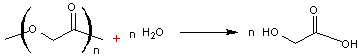
Celui-ci entre dans le processus
métabolique, le terme ultime de la dégradation étant CO2 et H2O.
Le PGA est hautement cristallin ; il
a un point de fusion élevé et une faible solubilité dans les solvants
organiques.
6-2)
Le poly(lactide) ou PLA
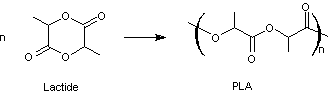
Le lactide est un monomère du PLA
(poly(lactide)).
Le polymère hydrophobe obtenu, qui
se déforme dès 50°C, est thermoplastique et dégradable sous l'effet d'enzymes excrétées
par des microorganismes (bactéries, champignons, algues).
La biodégradation du PLA a lieu en
deux étapes :
- La
première est une hydrolyse des liaisons esters autocatalysée par les
acides libérés conduisant à la réduction du poids moléculaire et à la
formation de fragments à bas poids moléculaire (oligomères).
- La
deuxième étape correspond à l'assimilation par les microorganismes de ces
fragments pour une minéralisation complète en formant CO2 et H2O.
C'est un polyester entièrement
biocompatible et biorésorbable, qui a permis dans les années 1980 de créer une
fibre qui a tout de suite intéressé le domaine médical ; les chirurgiens
l'utilisent (sutures, implants).
Il sert également, de nos jours, à
confectionner de nouveaux tissus (en ameublement par exemple) et en association
avec de la soie, pour des vêtements.
On peut également obtenir le PLA par
polymérisation de l'acide lactique, lui-même obtenu par fermentation du
D-glucose issu de l'amidon de maïs.
6-3)
Le poly(ε-caprolactone) ou PCL
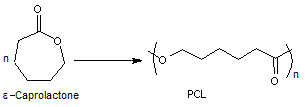
Le poly(ε-caprolactone) est un
polymère synthétique biodégradable. Il est surtout utilisé comme comme
plastifiant, mais aussi dans les emballages et les adhésifs.
C'est un hydrophobe comme le PLA ;
sa densité est de 1,1 et son point de fusion aux alentours de 60°C ; sa qualité
principale est sa flexibilité (sa déformation à la rupture peut atteindre
1100%).
Dans le domaine de la pharmacie, on
l'utilise dans le processus de libération contrôlée des principes actifs.
Par copolymérisation on peut obtenir
un copolymère polyuréthane thermoplastique (TPU)/PCL servant de charpente lors
de la régénération de tissus de la peau.
Par mélange de polyuréthane
thermoplastique (TPU) (25%) et de PCL (75%) on obtient un produit ayant une
mémoire de forme et permettant de fabriquer des fils de suture se nouant seuls.
6-4)
Le poly(3-hydroxybutyrate) ou PHB
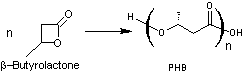
Le Le poly(3-hydroxybutyrate) est
un polymère biodégradable, qui est
produit naturellement par des micro-organismes (Bacillus megaterium par
exemple) mais qui peut être synthétisé à partir de la β-butyrolactone ; il
trouve des applications dans le médical lorsqu'on a besoin d'un matériau
biodégradable.
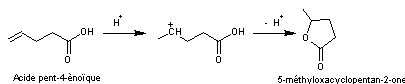
7-1)
A partir des acides insaturés
Lorsqu'un acide carboxylique est
insaturé, la double liaison carbone-carbone se situant au-delà de la position
α-β, il peut y avoir formation d'une lactone à 5 ou 6 atomes dans le
cycle par le mécanisme suivant :
7-2)
A partir de γ- ou d-hydroxy acides
En chauffant des γ- ou d-hydroxy
acides une estérification interne intervient qui conduit à des lactones à 5 ou
6 atomes dans le cycle :
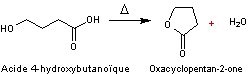
Remarque :
Dans des conditions similaires des
β-hydroxy acides sont déshydratés en acides α-β-insaturés
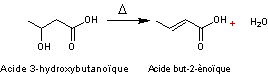
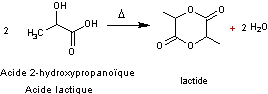
Deux molécules d' α-hydroxy
acides réagissent, si on les chauffe, en formant des dilactones à 6 atomes dans
le cycle appelées lactides.
8) Biosynthèse de
deux lactones dans les végétaux supérieurs
Suivi de la biosynthèse de
l'angélicine et du psoralène à partir de l'acide shikimique dans les végétaux
supérieurs
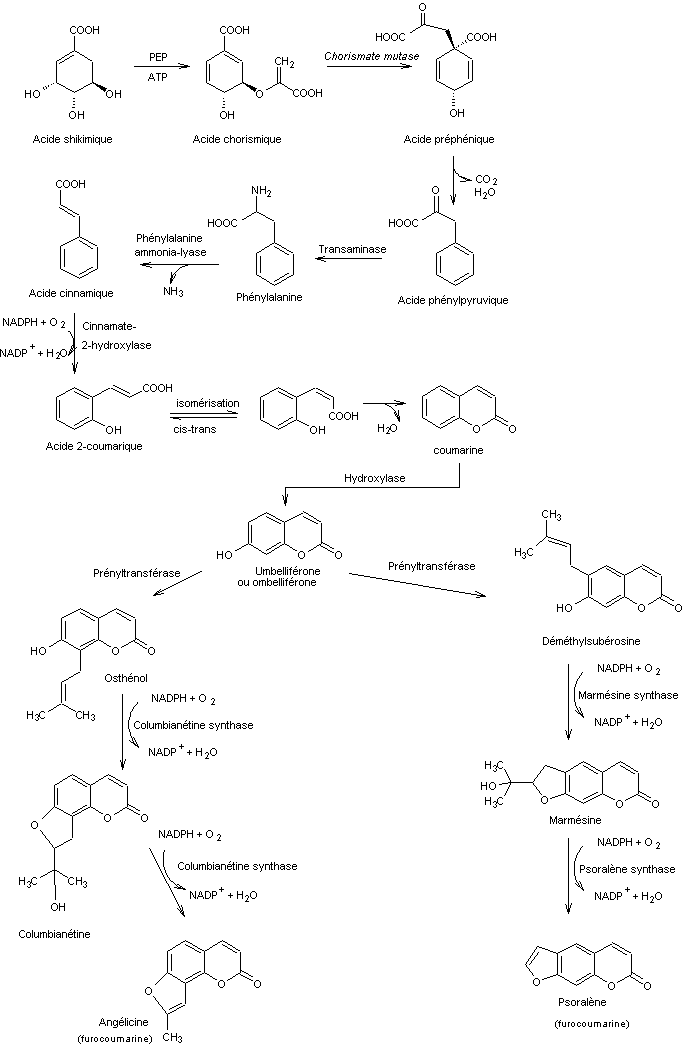
Les phytoalexines
(Les phytoalexines sont des molécules qui ont un rôle
important dans la résistance des végétaux aux maladies. Les plantes réagissent
à l’attaque d’un parasite en biosynthétisant ces molécules. Il y a souvent une
relation entre la famille à laquelle appartient la plante parasitée et le type
de molécule synthétisé. Ainsi les solanacées produisent des composés
terpéniques alors que les papilionacées plutôt des flavonoïdes). Elles protègent la plante
contre les herbivores et les microorganismes pathogènes. Elles sont
principalement localisées à la surface et dans les organes les plus exposés à
la prédation (jeunes feuilles, fruits, graines) dans un souci " d'économie
métabolique".
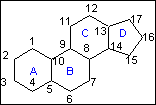
|
La
structure du noyau stérane
|
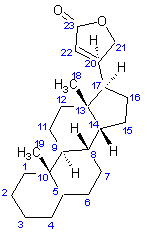
La
structure du noyau cardénolide
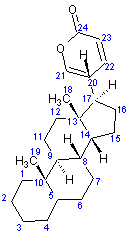
|
La
structure du noyau bufadiènolide
|