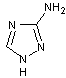
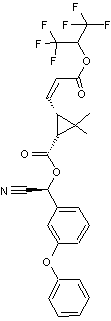
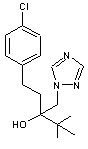
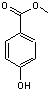
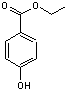
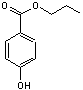
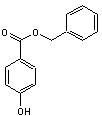
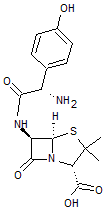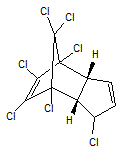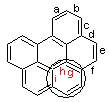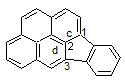Les
MICROPOLLUANTS
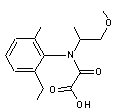
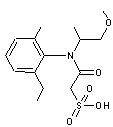
Gérard Gomez
avec la collaboration de
Jacques Baron
Plan de l'étude
1) Définition
2) Exemples
3) Caractéristiques de quelques micropolluants
3-2) Composés
organiques
3-2-1) Les composés organiques volatils
3-2-2) Les hydrocarbures aromatiques polycycliques
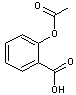
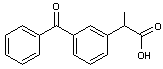
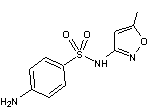
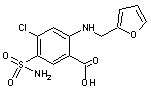
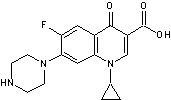
3-2-3) Les produits pharmaceutiques
3-2-4) Des résidus de produits phytopharmaceutiques et de
biocides
3-2-5) Des alkylphénols
3-2-6)
PCB et dioxines
3-2-7)
Les PFAS
3-2-8)
D'autres micropolluants
B)
Le bisphénol A, des filtres UV, les parabènes
C)
Les microbillesde plastique
4) Elimination des micropolluants des eaux souterraines et des eaux
usées
4-1) Eaux
souterraines
4-2) Eaux
usées
Annexe 1 Méthodes de détermination de la teneur
en formaldéhyde de l'atmosphère
Annexe 2 Stéréoisomérie du métolachlore
Annexe 3 Liste des 20 PFAS concernés par la directive
européenne Eau potable 2020
Annexe 4 Deux métabolites du métolachlore
Annexe 5 Nomenclature des arènes condensés
Les
micropolluants sont des substances naturelles ou anthropiques (c'est-à-dire
provenant des activités humaines), à effets toxicologiques notables même à très
faible concentration pour les écosystèmes (10-6 (micro) ou même 10-9
(nano) gramme par litre), non biodégradables qui s'accumulent dans
l'environnement, rivières, lacs, nappes souterraines notamment et qui peuvent
parvenir à l'homme via la chaîne alimentaire.
Ils
sont très nombreux (plusieurs dizaines ou plusieurs centaines de milliers de
composés) et de nature très diverse :
- Composés inorganiques : Les ET
(éléments traces) dont certains sont métalliques ETM (éléments traces
métalliques) comme Fer (Fe), Mercure (Hg) ….
et d'autres non métalliques, Arsenic (As), Sélénium (Se)….
- Composés organiques ; ce sont par
exemple les COV (composés organiques volatils) ou des hydrocarbures aromatiques
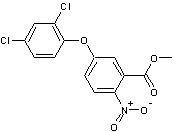
polycycliques (HAP) comme le benzo[a]pyrène, ou des substances médicamenteuses
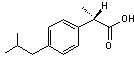
ou des résidus de produits phytopharmaceutiques ou de produits cosmétiques.
3) Caractéristiques de quelques micropolluants
- Les éléments traces
métalliques (ETM)
Ce sont
les éléments métalliques naturels de masse volumique supérieure à 5g/cm3
(exception faite pour l'aluminium) que l'on retrouve sous forme de traces dans
l'eau, l'air et le sol ; Ils sont présents dans la croûte terrestre à des
concentrations inférieures à 0,1% soit 1g.kg-1 : aluminium (Al),
cadmium (Cd), cobalt (Co), chrome (Cr), cuivre (Cu), fer (Fe), mercure (Hg),
manganèse (Mn), nickel (Ni), plomb (Pb), zinc (Zn), notamment.
Leur
origine peut être naturelle
- Eruptions volcaniques qui les
disséminent dans l'environnement
- Erosion des sols qui en
contiennent, dues aux pluies ou aux cours d'eau.
Elle
peut être aussi due à l'activité humaine qui va participer à leur diffusion
dans l'environnement
v Industrie
métallurgique
v
Industrie minière : rappelons que
pendant de nombreuses années les industries rejetaient leurs effluents dans les
cours d'eau près desquels elles étaient installées, l'eau de ceux-ci leur
servant d'eau de refroidissement
Parmi
ces éléments, certains ont une utilité dans le processus biologique et même
pour certains d'entre eux (oligo-éléments) sont indispensables à la vie (Fe,
Cu, Ni, Cr, …) ; ils ne deviennent toxiques qu'à partir d'une certaine
concentration dans l'organisme.
Mais
trois d'entre eux Hg, Pb, Cd, sont des éléments uniquement toxiques entraînant
notamment des lésions neurologiques plus ou moins graves
Leur
toxicité est bien connue et depuis longtemps pour certains, le mercure par
exemple depuis l'antiquité. Elle se développe par bio-accumulation dans les
organismes. Elle concerne le système nerveux, la moëlle osseuse, le sang.
Pendant
longtemps on ne s'est intéressé qu'à eux comme micropolluants ; ces métaux ont
été appelés des métaux lourds au regard de leur masse molaire élevée.
Les
concentrations maximales du mercure, du plomb et du cadmium dans les eaux
potables sont indiquées dans le tableau ci-dessous.
|
Métal |
Concentration
maximale |
|
Mercure |
1
µg/L |
|
Plomb |
10
µg/L |
|
Cadmium |
5
µg/L |
A) Impact
des ETM sur les végétaux
On peut
citer par exemple :
Ø La diminution de la chlorophylle dans
une plante
Les
ETM peuvent perturber l'activité de l'enzyme Rubisco, qui, dans la première
étape du cycle de Calvin (voir photosynthèse), permet la
fixation du CO2 sur le RUBP (Ribulose biphosphate).
Ø Des perturbations dans la division
cellulaire des végétaux
C'est
le cas du Hg, du Pb,et du Cd qui peuvent inhiber les activités enzymatiques des
enzymes ADNase (Désoxyribonucléase) et ARNase (Ribonucléase).
B) Impact
des ETM sur les organismes humains
Les
éléments traces sont bioaccumulables, ce qui signifie que tout au long de la
chaîne alimentaire, ils s'accumulent ; les organismes qui en contiennent les
stockent et quand ces organismes sont
consommés par d'autres, les éléments
viennent s'ajouter à ceux que l'organisme consommateur contient déjà. Ainsi
l'homme placé en haut de la chaîne se retrouve particulièrement exposé via la
nourriture (La pollution au mercure par le thon par exemple).
Mais
ils sont présents également dans notre environnement, notre logement par
exemple : acier (poutres), zinc (tuiles, cheneaux et descentes d'eaux
pluviales) …. mais aussi dans nos véhicules : plomb (batteries
d'accumulateurs).
Quelques
effets des ETM
:
Ø
Le
mercure
: C'est sous la forme de monométhylmercure (on abrège souvent en
méthylmercure), un ion organique CH3Hg+ qu'on le
rencontre le plus souvent dans la nature. Il a été formé par la méthylation du
mercure non
organique
(Hg) par des microorganismes (bactéries méthanogènes notamment). Le
méthylmercure peut se concentrer très fortement dans les organismes aquatiques.
Les intoxications graves ou aiguës par cet ion correspondent à l'hydrargyrisme.
C'est chez les mammifères que les conséquences
les plus graves ont été remarquées.
Il est
toxique pour le système nerveux central de l'homme en particulier in utero
et au cours de la petite enfance. Il peut entraîner des troubles
comportementaux légers ou des retards de développement. Il peut provoquer aussi
des insuffisances rénales et des lésions gastro-intestinales.
Ø
Le
plomb
: La plombémie correspond au taux de plomb dans le sang. Chez les jeunes on
parle de saturnisme si la plombémie est supérieure ou égale à 50µg/L de sang.
Absorbé par voie digestive, respiratoire ou par la peau, les
muqueuses,
le plomb est stocké à 90% au niveau des os et peut être relargué longtemps
après l'exposition d'où des effets tardifs.
Selon
la durée, les effets peuvent être
v
réversibles : anémie, troubles
digestifs
v
irréversibles : chez l'enfant retard
mental et /ou psychomoteur. Chez l'adulte il agit sur le système nerveux, la
moëlle osseuse, les reins.
L'interdiction
du plomb tétraéthyle (Pb(C2H5)4) pour
améliorer l'indice d'octane des moteurs des voitures a considérablement réduit
les cas de saturnisme chez les enfants. On trouvait autrefois, des cas de
saturnisme chez les plombiers qui travaillaient sur les tuyaux d'évacuation des
eaux qui étaient en plomb.
Ø
Le
cadmium :
C'est un métal blanc bleuâtre mou et
très malléable qui n'existe pas à l'état natif mais qui est obtenu dans
l'industrie comme sous-produit de la métallurgie du zinc. On le trouve
principalement sous forme de chlorure, d'oxyde, de sulfate, de nitrate ….. On
l'utilise dans la fabrication de certains accumulateurs électriques (batteries
Cd-Ni), mais aussi pour la fabrication de pigments pour la métallisation des
surfaces.C'est principalement via l'alimentation que l'homme est exposé aux
méfaits de ce micropolluant sur la santé. L'épandage de matières fertilisantes,
notamment les engrais minéraux phosphatés, contribue à la bioaccumulation de ce métal dans les sols et le transfert
vers l'homme via les végétaux. Le tabac représente pour les fumeurs une source
importante d'exposition.
C'est
un polluant reconnu cancérogène, mutagène et toxique pour la reproduction.
Il
augmente le risque d'ostéoporose ou de fractures osseuses ; en effet il se
substitue au calcium dans l'os et en modifie les propriétés mécaniques.
3-2) Composés
organiques
3-2-1) Les composés organiques volatils (COV)
La
directive européenne du 11 mars 1999 définit réglementairement les composés
organiques volatils :
Un
COV concerne tout composé organique ayant une pression de vapeur de 0,01kPa ou
plus à une température de 293,15 K, ou ayant une volatilité correspondante dans
les conditions d'utilisation particulières.
Il
s'agit donc de composés très volatils qui se répandent facilement dans
l'atmosphère des maisons, des ateliers et des bureaux et qui agissent
directement ou indirectement sur les êtres vivants et l'environnement.
Ce sont
pour la plupart des solvants utilisés comme tels mais aussi comme dégraissants,
agents de nettoyage, agents de synthèse ….. dont les plus connus sont, par
ordre de volatilité décroissante :
|
Le
méthanal ou formaldéhyde |
|
Ebullition : -19,3°C |
Pression de vapeur saturante à
293,15K 440 kPa |
|
Chlorure
de vinyle |
|
Ebullition : -13,7°C |
Pression de vapeur saturante à
293,15K 333 kPa |
|
Le
dichlorométhane |
|
Ebullition : 40°C |
Pression de vapeur saturante à
293,15K 47,4 kPa |
|
L'acétone |
|
Ebullition : 56,2°C |
Pression de vapeur saturante à
293,15K 22,8 kPa |
|
Le
trichlorométhane ou chloroforme |
|
Ebullition : 62°C |
Pression de vapeur saturante à
293,15K 21,2 kPa |
|
Le
benzène |
|
Ebullition : 80,1°C |
Pression de vapeur saturante à
293,15K 15,8 kPa |
|
Le
tétrachlorométhane ou tétrachlorure
de carbone |
|
Ebullition : 76,7°C |
Pression de vapeur saturante à
293,15K 11,9 kPa |
|
1,2-
dichloroéthane |
|
Ebullition : 83,5°C |
Pression de vapeur saturante à
293,15K 8,7 kPa |
|
Le
trichloréthylène |
|
Ebullition : 87°C |
Pression de vapeur saturante à
293,15K 7,8 kPa |
|
L'éthanol |
|
Ebullition : 78,32°C |
Pression de vapeur saturante à
293,15K 5,9 kPa |
|
Le
toluène |
|
Ebullition : 110,6°C |
Pression de vapeur saturante à
293,15K 2,9 kPa |
|
Le
tétrachloroéthylène |
|
Ebullition : 121°C |
Pression de vapeur saturante à
293,15K 1,9 kPa |
Impact
sur les organismes humains
Prenons
comme exemple le méthanal encore appelé formaldéhyde ; le formol est une
solution à 37% de méthanal.
Il
est aujourd'hui considéré par les autorités sanitaires françaises comme un des
polluants prioritaires à gérer (en dehors de l'amiante, du radon et du monoxyde
de carbone), du fait de son caractère cancérigène certain (d'après le CIRC qui
dépend de l'OMS) et de la fréquence de sa présence dans notre environnement :
panneaux de particules agglomérées, mousses isolantes urée-formol, certaines
moquettes, peintures au latex, adhésifs, vernis, papiers peints, carton
blanchi, certains détergents à vaisselle, des assouplissants, certains produits
cosmétiques (vernis à ongles et durcisseurs d'ongles), fumées de foyers et de
poêles à bois, fumées de cigarettes, émanations de véhicules dans les garages
adjacents…..
En
général le formaldéhyde est émis sous forme gazeuse et cette émission tend à
diminuer avec le temps et finit par cesser au bout d'une durée qui varie de
quelques semaines à quelques mois voire quelques années suivant la nature des
sources.
Risques
encourus
:
Ils
dépendent du niveau d'exposition ; on mesure ces niveaux en microgrammes de
formaldéhyde par mètre cube d'air (µg/m3) :
- Jusqu'à environ 50 µg/m3
pour une exposition de court terme (2 heures) ou 10 µg/m3 pour une
exposition de long terme, on ne distingue aucun effet critique sur la santé ;
le risque encouru est qualifié de faible.
- Entre 50 et 125 µg/m3
environ une exposition à long terme peut causer des problèmes respiratoires
comme la toux, la respiration sifflante et une sensibilité allergique, en
particulier chez les enfants ; le risque est qualifié de moyen.
- Au-delà de 125 µg/m3
une irritation des yeux, du nez et de la gorge apparaît et à court terme les
syndromes respiratoires décrits pour une exposition moyenne à long terme
apparaissent ; il s'agit d'un risque élevé.
- Pour des concentrations très
importantes pendant de longues durées (risques professionnels pour certains
travailleurs industriels) on peut observer des cancers de la cavité nasale.
Mais ces risques ne peuvent survenir aux concentrations que l'on trouve dans la
plupart des maisons ou appartements individuels (En France la moyenne
rencontrée dans les appartements est 20 µg/m3).
Méthodes
de détermination de la teneur en formaldéhyde de l'atmosphère :
Il
existe plusieurs méthodes qui dépendent des circonstances dans lesquelles cette
détermination est effectuée ; s'il s'agit de déterminer ponctuellement la
teneur de l'air en formaldéhyde, lors d'un pic de pollution par exemple, on ne
procède pas exactement comme lorsqu'il s'agit de déterminer une valeur moyenne,
dans une pièce sur la journée (Voir annexe 1).
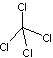
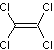
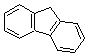
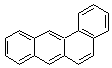
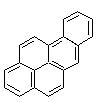
3-2-2) Les hydrocarbures aromatiques polycycliques (HAP)
Ils
apparaissent lors de la pyrolyse ou de la combustion incomplète de matières
organiques (combustion du bois, des ordures ménagères, fonctionnement des
moteurs à essence ou des diesels). Ils sont rarement présents à forte
concentration mais se présentent souvent comme des mélanges complexes de HAP et
de leurs dérivés oxygénés, nitrés ….
On
retrouve dans les eaux superficielles les HAP provenant de dépôts
atmosphériques.
Les
fumées de cigarettes renforcent leur présence dans les espaces intérieurs.
Des
sources non-anthropiques (naturelles) participent à leur production et à leur
dissémination (volcans, végétation, érosion du sol ….).
La
principale source d'exposition aux HAP pour les humains est l'alimentation mais
d'autres voies d'exposition existent (pulmonaire, cutanée).
Les
effets toxicologiques chez l'homme sont assez mal connus mais les essais chez
l'animal ont montré qu'ils pouvaient induire de nombreux effets sur la santé :
sur le foie, sur le sang, effets immunologiques, effets sur la reproduction ;
ce sont des agents génotoxiques et cancérigènes.
Parmi
les plus étudiés on trouve le benzo [a] pyrène. Les outils d'analyse chimique
permettent de mesurer actuellement des concentrations en HAP inférieures à 1
ng/m3 dans l'air et des concentrations de leurs métabolites
urinaires de moins de 1 ng/L.
Les
principaux HAP
|
|
|
|
|
|
Anthracène |
Acénaphtène |
Acénaphtylène |
Fluorène |
|
|
|
|
|
|
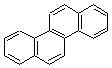
Benzo[a]anthracène |
Benzo[a]pyrène |
Benzo[g,h,i]pérylène |
Chrysène |
|
|
|
|
|
|
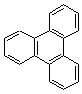
Triphénylène |
Fluoranthène |
Indéno[1,2,3 - cd]pyrène |
Naphtalène |
|
|
|
|
|
|
Phénanthrène |
Pyrène |
|
|
Remarque : Dénomination de
certaines molécules d'hydrocarbures aromatiques à noyaux condenses (voir annexe
5)
3-2-3) Les
produits pharmaceutiques
Il
s'agit essentiellement de molécules que l'on retrouve dans les eaux usées
(médicaments, que nous rejetons dans les toilettes sous une forme plus ou moins
dégradée avec les urines ou les fèces, mais aussi des détergents et
désinfectants utilisés aux fins de nettoyage ou d'asepsie par exemple dans les
établissements de soins) ou dans les eaux pluviales en milieu urbain.
Il
s'agit de la première famille de micropolluants retrouvés dans les eaux douces
de surface, les concentrations allant du µg/L au ng/L.
La
France s'avère être le quatrième consommateur mondial de médicaments après les
Etats-Unis, le Japon et l'Allemagne.
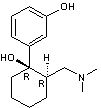
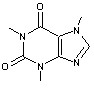
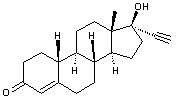
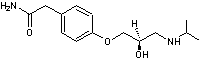
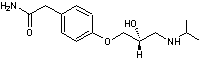
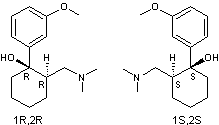
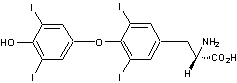
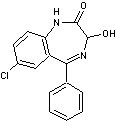
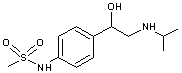
Les
principaux principes actifs que l'on retrouve sont extrêmement nombreux et
parmi les plus fréquemment présents dans les eaux de surface et les eaux
souterraines :
|
|
|
|
|
Paracétamol Antipyrétique
et analgésique(il fait baisser la fièvre),principe actif du Dafalgan®, du
Doliprane® notamment, concurrent de l'aspirine, mais avec moins
d'effets secondaires. |
S-(+)- Ibuprofène Molécule
utilisée comme médicament ; le stéréoisomère S-(+) est anti-inflammatoire non
stéroïdien et le composé R-(-) est très faiblement actif. In
vivo,
l'ibuprofène s'isomérise de R-(-) en S-(+), essentiellement dans les tissus
du foie humain ou dans la paroi intestinale. |
Codéine Alcaloïde
de l'opium, antalgique et sédatif Ne
diffère de la morphine que par un OH remplacé par un CH3 |
|
|
|
|
|
Amoxicilline Aminopénicilline
à spectre large ; elle couvre tout le spectre des pénicillines conventionnelles
(comme l’ampicilline) et beaucoup d’autres souches comme les entérocoques. |
Cholécalciférol Vitamine
D3 ; Stéroïde que l'on trouve dans les huiles de foie de poissons (flétan,
thon …) |
Acide
acétylsalicylique Principe actif de l'aspirine, c est un antipyrétique, un analgésique et
un antirhumatismal (anti-inflammatoire de l'arthrite). Elle interfère dans la
biosynthèse des
prostaglandines (en inhibant la cyclo-oxygénase enzyme clé de cette
synthèse) diminuant la fièvre, la douleur, l'inflammation. |
|
|
|
|
|
Carbamazépine Utilisé
dans le traitement de l'épilepsie. |
Metformine Utilisé dans le
traitement du diabète de type 2. |
Erythromycine A Produite
naturellement par Saccharopolyspora erythraea Parfois
utilisé en cas d'intolérance aux pénicillines. |
|
|
|
|
|
Abacavir Antiviral
et antirétroviral inhibiteur nucléosidique de la transcriptase inverse. Traitement
du VIHN |
Estrone Hormone
femelle qui règle avec l'estradiol le cycle menstruel. |
Acide niflumique Anti-inflammatoire
non stéroïdien (AINS). Médicament
commercialisé en particulier sous le nom Nifluril® et utilisé pour le
traitement de certaines pathologies comportant des signes inflammatoires :
rhumatismes, arthroses, traumatismes (tendinites, entorses), douleurs O.R.L… |
|
|
|
|
|
Acide fénofibrique Métabolite
actif du fénofibrate, un médicament indiqué dans le traitement de l'excès de
cholestérol et des triglycérides. |
Kétoprofène AINS
(Anti-inflammatoire non stéroïdien, arylcarboxylique à action antalgique et
antipyrétique à faible dose ; anti-inflammatoire à dose plus forte). |
Sulfaméthoxazole Antibactérien
utilisé pour lutter contre les infections urinaires. |
|
|
|
|
|
Furosémide Diurétique
utilisé contre l'hypertension et dans le traitement des oedèmes d'origine
hépatique, rénale ou cardiaque. |
Ciprofloxacine Fluoroquinolone
(quinolone de deuxième génération à large spectre). |
O-desmethyltramadol Analgésique
opioïde, principal métabolite actif du tramadol. |
|
|
|
(R)
(S) |
|
Caféine Alcaloïde de la famille des xanthines, excitant du système
nerveux central et stimulant du système cardio-vasculaire, présent dans le
thé et le café. |
Noréthistérone (Progestatif de
synthèse) |
Aténolol Bêta-bloquant
pour traiter l'hypertension artérielle, l'infarctus du myocarde …. C'est
un antagoniste des récepteurs β1 responsables de
l'augmentation de la fréquence cardiaque. |
|
|
|
|
|
Tramadol Le chlorhydrate est
largement utilisé comme analgésique ; c'est un agoniste des récepteurs
morphiniques. |
Lévothyroxine Hormone isolée de la
thyroïde ; stimulation du métabolisme. |
Métronidazole Antibiotique et
antiparasitaire utilisé contre les bactéries anaérobies et les protozoaires |
|
|
|
|
|
Oxazépam Famille des
benzodiazépines ; anxiolytique, anticonvulsivant, myorelaxant. |
Sotalol Médicament
antiarythmique. Bêta-bloquant non sélectif. |
Trimétazidine Traitement de
l'angine de poitrine. |
|
|
|
|
|
Econazole Antifongique utilisé
au niveau dermatologique et gynécologique Elle inhibe la
synthèse de l'ergostérol molécule constitutive de la membrane fongique. |
|
|
3-2-4) Des résidus de produits phytopharmaceutiques et de
biocides
Ø Produits
phytopharmaceutiques
Selon
la réglementation européenne les produits phytopharmaceutiques sont des
produits constitués de substances actives, phytoprotecteurs ou
synergistes (c'est-à-dire qui renforcent l'action d'un produit en agissant par
synergie) ou en contenant et destinés à l'un des usages suivants :
- Protéger les
végétaux ou les produits végétaux contre tous les organismes nuisibles ou
prévenir l'action de ceux-ci, sauf si ces produits sont censés être utilisés
principalement pour des raisons d'hygiène plutôt que pour la protection des
végétaux ou des produits végétaux.
- Exercer une
action sur les processus vitaux des végétaux, telles les substances, autres
que les substances nutritives, exerçant une action sur leur croissance.
- Assurer la
conservation des produits végétaux, pour autant que ces substances ou
produits ne fassent pas l'objet de dispositions particulières concernant les
agents conservateurs.
- Détruire les
végétaux ou les parties de végétaux indésirables, à l'exception des algues.
- Freiner ou
prévenir une croissance indésirable des végétaux, à l'exception des algues.
Quelques
exemples de produits phytopharmaceutiques :
|
|
|
|
|
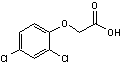
2,4 D Ou Acide
(2,4-Dichlorophénoxy) acétique Herbicide
systémique sélectif, le plus utilisé dans le monde, qui imite une hormone de
croissance (l'acide indol-3-acétique
ou auxine) mais en induisant une croissance incontrôlée qui aboutit à la
destruction de la plante. |
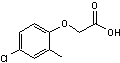
2,4 MCPA Ou Acide (4-chloro-2-méthylphénoxy)
acétique Herbicide puissant et sélectif
(efficace surtout pour les dicotylédones). Il est très utilisé. Il imite une hormone de croissance
(l'acide indol-3-acétique ou
auxine) mais en induisant une croissance incontrôlée qui aboutit à la
destruction de la plante.plante. |
Aclonifène Herbicide
de la famille des diphényléthers. Il agit au niveau de la chlorophylle en
inhibant la protophyrinogène oxydase, enzyme nécessaire à sa biosynthèse et
au niveau de la biosynthèse de certains caroténoïdes qui protègent la
chlorophylle. |
|
|
|
|
|
Bentazone C'est
une molécule obtenue par synthèse, de la famille des diazines. Elle a un rôle
d'herbicide sélectif après émergence de la plante visée ; elle agit en
interrompant le processus de photosynthèse après contact avec les feuilles,
détruisant ainsi les réserves glucidiques de la plante. Elle détruit aussi
les chloroplastes des membranes. Utilisé
dans les cultures de lentilles, de pois, de haricots, de pommes de terre,
ainsi que pour les céréales (avoine, blé, orge, maïs) … |
Bifénox Herbicide
utilisé en préémergence dans les cultures de soja, maïs et sorgho et en
postémergence pour le riz. Le
bifénox agit par contact sur les organes jeunes en provoquant la rupture des
membranes cellulaires. |
Boscalide C'est
un fongicide de la famille des carboxamides. Il inhibe la production d'ATP
mitochondriale dans les cellules des champignons pathogènes. |
|
|
|
|
|
Cyhalothrine Pyréthrinoïde de synthèse ayant
une meilleure stabilité à la lumière que les pyréthrines
naturelles. Son effet insecticide consiste à
perturber le transport du sodium dans les cellules bloquant ainsi la
transmission de l'influx nerveux et provoquant la mort par paralysie
notamment chez les poux, les mites et autres arthropodes. Cette molécule est toxique pour
les abeilles et très toxique pour les poissons. Elle est interdite par l'UE depuis
1995. |
Perméthrine (cis) Insecticide
de type pyréthrinoïde. Stable
à la chaleur ; plus stable en milieu acide qu'en milieu basique. La perméthrine
est interdite dans l'UE depuis 2001. |
Fenbuconazole Fongicide
systémique de la famille des triazoles, utilisé contre tavelure et monoliose
sur les arbres fruitiers : abricotier, cerisier, poirier, pommier, prunier
mais aussi dans les cultures de melon et de courgette. Il agit par
inhibition de la 14-α- déméthylation des stérols. |
|
|
|
|
|
Aldrine Insecticide
chloré, non systémique et non biodégradable, de moins en moins utilisé. Interdit
en France depuis 1994 à cause de -
sa forte toxicité, -
sa persistance (notamment dans les régions tempérées), -
de la bioaccumulation des résidus de la substance dans la chaîne alimentaire. C'est un des douze composés répertoriés comme
polluants majeurs lors de la convention de Stockholm (2001, elle regroupe 124
membres) |
Chlordécone Utilisé
comme insecticide dès 1958 contre les coléoptères du bananier, du cotonnier,
du tabac. |
Mirex Solide
cristallin, blanc, inodore a été utilisé comme insecticide (1955) et comme
retardateur de feu. Son utilisation comme insecticide a été interdite en
1978. |
|
|
|
|
|
Aminotriazole Herbicide
systémique, non sélectif absorbé par les feuilles et les racines, de la famille
des triazoles, utilisé pour détruire le chiendent et d'autres plantes à
enracinement profond dans les vignes, les vergers mais aussi au bord des
routes. C'est
un composé stable qui agit par inhibition de la synthèse de certains pigments
de la photosynthèse (caroténoïdes). |
Acrinathrine Molécule
à propriétés insecticides utilisée contre les insectes s'attaquant à la vigne
et aux arbres fruitiers. |
Tébuconazole Protège
le blé contre les septorioses, des maladies cryptogamiques engendrées par
diverses espèces de champignons du genre Septoria (Septoria
nodorum et Septoria tritici) qui se manifestent par des taches sur les
feuilles ou les tiges et contre les rouilles, dues aussi à des champignons (Puccinia
recondita et Puccinia striiformis). |
|
|
|
|
|
Heptachlore Composé organo-chloré qui a été utilisé comme
insecticide. D'un point de vue environnemental c'est un polluant organique persistant
qui demeure plusieurs années dans le sol. C'est un composé liposoluble qui
s'accumule dans les graisses humaines et animales ; il provoque une
hyperexcitation du système nerveux et cause des dommages au foie. |
Métolachlore Herbicide
agissant sur les graminées (maïs en particulier). Molécule
chirale à laquelle correspondent 4 stéréoisomères. Seuls
les stéréoisomères S du carbone asymétrique sont actifs (voir annexe 2). C'est
un micropolluant des eaux usées essentiellement par ses produits de
transformation (métabolites) l'OXA-métolachlore et l'ESA-métolachlore (voir annexe 4). |
Fongicide
de contact ; utilisé dans la culture des pommes de terre. Il empêche la
germination des spores. C'est
une molécule phototoxique, qui conduit à des composés toxiques après
absorption de la lumière. C'est
un phytopharmaceutique interdit en France depuis 2020. C'est aussi
un micropolluant que l'on retrouve dans l'eau du robinet (1/3 de l'eau
distribuée en 2023 selon l'Anses). |
Ø Biocides
On
lit sur le site du Ministère de l'environnement, de l'énergie et de la mer la
définition suivante d'un biocide :
"[c'est
un] ensemble de produits destinés à détruire, repousser ou rendre inoffensifs
les organismes nuisibles, à en prévenir l'action ou à les combattre, par une
action chimique ou biologique…."
Ces
produits sont classés en 4 grands groupes :
- Les désinfectants (par
exemple pour les mains, pour l'eau ….)
- Les produits de
protection (protection du bois contre les insectes ou les champignons,
protection du cuir …)
- Les produits de
lutte contre les nuisibles (rodenticides, insecticides).
- Les produits
antisalissures des coques de bateaux ou ceux employés en taxidermie ou
thanatopraxie …
Deux
exemples de biocides :
|
|
|
|
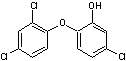
triclosan C'est
un biocide (antifongique et antibactérien à large spectre) initialement
utilisé pour le lavage chirurgical des mains. On le trouve aujourd'hui dans
nombre de produits cosmétiques (hygiène) savons dentifrices, déodorants,
désinfectants pour les mains ….Il est même incorporé à certains tissus
(tissus d'ameublement, chaussettes anti-odeurs, éponges anti-germes). Il
est suspecté d'être un perturbateur endocrinien de par les dioxines (en très faible quantité)
auxquelles il peut conduire par action des UV sur le 2,4-dichlorophénol, un de
ses produits de dégradation. |
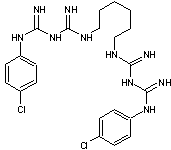
Chlorhexidine Agent
cationique qui réagit avec les groupements chargés négativement de la paroi
bactérienne. Molécule
utilisée dans le domaine : -
Dentaire : Fortement antibactérienne elle est incorporée dans certains
dentifrices et dans certains « spray » buccaux. -
Médical : Antiseptique à large spectre d’action. Antisepsie des
petites plaies et brûlures superficielles peu étendues. |
3-2-5) Des alkylphénols
On
les trouve dans les effluents et les boues des stations d'épuration, ainsi que
dans les eaux de mer du Nord-Ouest de la Méditerranée.
Les
taux baissent en même temps que les performances des moyens d'élimination
augmentent.
Ce
sont des perturbateurs endocriniens ayant une action oestrogénique ; ils
peuvent entraîner des malformations génitales (hypospadias).
Quatre
des principaux alkyl phénols rencontrés :
|
|
|
|
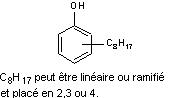
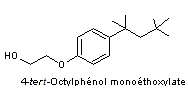
Octylphénols |
Octylphénolmonoéthoxylates |
|
|
|
|
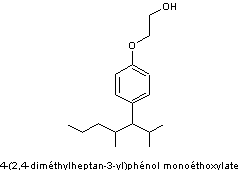
Nonylphénols |
Nonylphénolmonoéthoxylates |
On
suspecte les nonylphénols et les nonylphénoléthoxylés de causer la féminisation
des poissons et des crustacés et des difficultés de reproduction chez ces
espèces.
Les
octylphénols sont des intermédiaires chimiques dans la production industrielle
de résines phénoliques.
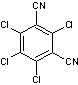
3-2-6) PCB et Dioxines
- PCB
Encore
appelées biphényles polychlorés ces molécules sont connues en France sous le
nom de pyralènes et sont des substances toxiques qui persistent dans
l'environnement et s'accumulent dans la chaîne alimentaire.
Cette
appellation regroupe 209 composés aromatiques chlorés dérivés du diphényle. Ces
molécules de même structure de base avec un nombre d'atomes substitués
différent sont qualifiées de congénères.
La
structure de base
est le diphényle :
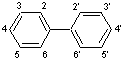
Les
atomes substitués
: de 1 à 10 atomes de chlore répartis sur les carbones 2,3....6, 2',3'.....6'.
Leur
formule chimique générale est C12H(10-n)Cln avec 1 ![]() n
n ![]() 10.
10.
Ces molécules ont été utilisées pour le refroidissement des transformateurs
électriques jusqu'en 1968 environ car les produits, sous forme liquide qu'elles
constituent sont très isolants électriquement et ininflammables.
Malheureusement à la chaleur elles se transforment en composés hautement
toxiques. Les polychlorodibenzofurannes (PCDF) notamment mais aussi les
dioxines et en particulier la dioxine ou T.C.D.D). Leur
utilisation est interdite en France dans tout appareil électrique.
Ces molécules ont également été utilisées (autrefois, mais cela n'est plus
le cas depuis longtemps) comme additifs ignifugeants dans les matières
plastiques, comme agents plastifiants (peintures,vernis, laques, colles,
encres, papiers….) et comme additifs de certains insecticides et pesticides.
La principale affection constatée lors d’une intoxication aux PCB est une
chloracné sévère.
Nous mentionnerons 4 représentants de la famille.
Remarque : ces molécules ayant un nom difficile à énoncer il a été décidé de leur
donner un nom commun : PCB x, x étant un nombre de1 à 209.
|
|
|
|
|
|
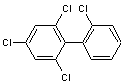
PCB 28 ou 2,4,4'-trichlorobiphényle |
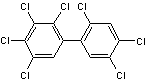
PCB 50 ou 2,2',4,6
-tétrachlorobiphényle |
PCB 180 ou 2,2',3,4,4',5,5'
heptachlorobiphényle |
PCB 209 ou 2,2',3,3',4,4',5,5',6,6'
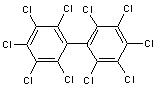
décachlorobiphényle |
-
Dioxines
Les dioxines sont libérées au cours de processus naturels, mais
aussi, principalement de nos jours, par des activités humaines : incinération
de déchets domestiques, procédés thermiques en métallurgie.
Les efforts qui ont été réalisés ces dernières années ont permis
de réduire de façon significative l'exposition humaine à ces substances.
Un certain niveau de contamination subsiste cependant dans les
sols, les sédiments aquatiques et marins…ce qui entraîne une contamination de
la chaîne alimentaire : lait, viande, poisson.
Deux grandes familles,
Ø Les polychlorodibenzo-para-dioxines (PCDD) de formule
générale
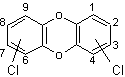
Le nombre de congénères PCDD est de 75.
Ø Les polychlorodibenzofuranes (PCDF) de formule générale
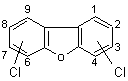
Le nombre de congénères de PCDF est de 135.
Les propriétés physicochimiques de ces deux familles sont
étroitement liées au degré de chloration des molécules.
Ce sont des composés peu volatils, peu solubles dans l'eau mais
solubles dans les lipides, ce qui leur donne la possibilité de traverser les
membranes cellulaires et de s'accumuler dans les tissus gras de l'organisme.
Résistance à la chaleur : Ils sont stables jusqu'à 800°C
Résistance à la lumière : La photodéchloration des
congénères les plus chlorés est la réaction qui se produit le plus souvent
lorsqu'ils sont soumis à l'action de la lumière. Ainsi l'octachlorodibenzo-para-dioxine
(OCDD) composé majoritaire dans les émissions de dioxines conduit à la
formation de 2,3,7,8-tétrachlorodibenzo-para-dioxine (TCDD).
Stabilité biochimique : très importante, en
particulier pour les composés les plus chlorés. Certains micro-organismes
(bactéries, levures, champignons) sont capables de les métaboliser.
Remarque :
La dioxine est un composé dont le nom systématique est 2,3,7,8-Tétrachlorodibenzo-p-dioxine
(TCDD) et la formule moléculaire C12H4O2Cl4
:
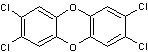
C'est la dioxine de Seveso, du nom de la ville italienne de la
province de Milan (Lombardie) ou se produisit le 10 juillet 1976 l'explosion
d'un réacteur dans l'usine Icmesa filiale du groupe Givaudan-Hoffmann-Laroche
qui produisait du 2,4,5-trichlorophénol en vue de la fabrication d'herbicides.
Il en résulta un nuage de dioxine correspondant à la libération de 1 à 5 kg de
2,3,7,8-TCDD qui contamina environ 1800 ha et provoqua une grande panique. Cet
accident industriel resté dans les mémoires a donné lieu a deux directives :
SEVESO 1 et SEVESO 2 précisant les mesures de sécurité à prendre dans certaines
usines chimiques.
Le nom de dioxines a été également donné aux autres composés chlorés
de ce noyau dibenzo-p-dioxine qui se forment en particulier par décomposition
des PCB par la chaleur.
Les dioxines sont toxiques : Parmi les 210 congénères
cités, 17 composés ayant des atomes de chlore en position 2,3,7,8 (7 PCDD et 10PCDF) et une conformation stérique qui
favorise leur fixation dans les cellules, s'accumulent fortement dans les
organismes vivants, ce sont les plus toxiques.
Elles peuvent créer des problèmes au niveau de la procréation, du
développement, léser le système immunitaire, interférer avec le système
hormonal et causer des cancers
Formation des dioxines :
- PCDD
A partir du 2,4,5-trichlorophénol

-
PCDF
A partir des
3,3',4,4'-tétrachlorobiphényles

3-2-7)
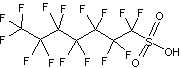
Les PFAS
Ce sigle correspond aux substances per et polyfluoroalkylées
apparues dans les années 1950 et qui ont donné lieu à de très nombreuses
applications.
- Dans les molécules
perfluorées, chaque atome de carbone est entièrement saturé par des atomes de
fluor et la chaîne comporte, à une extrémité, un groupement fonctionnel, en
général –COOH ou –SO3H
Exemple :
CF3 – CF2 – CF2 – COOH acide
perfluorobutanoïque (PFBA).
- Dans les
molécules polyfluorées, la chaîne est principalement fluorée mais peut contenir
aussi des liaisons entre les carbones et d'autres éléments, par exemple
l'hydrogène
Exemple :
|
|
Les PFAS constituent une importante famille de composés (plus de
4000) dont les propriétés antiadhésives, imperméabilisantes, tensio-actives, de
résistance aux fortes chaleurs ont fait qu'ils ont été largement utilisés dans
l'industrie mais aussi pour des usages domestiques : tissus (produits
d'imperméabilisation Scotchgard®), emballages alimentaires, mousse
anti-incendie, cosmétiques, phytopharmaceutiques ….
Les nombreuses liaisons C-F qu'ils contiennent font qu'ils ne se
dégradent pas ce qui pose des problèmes environnementaux (on les appelle
"polluants éternels"). Pour s'en débarrasser, il faut les incinérer à
haute température.
Ces composés peuvent être des gaz, des liquides ou des solides.
Ils contaminent les eaux souterraines comme les eaux de surface.
Leurs actions sur la santé : ils peuvent augmenter le taux de
cholestérol et diminuer la fertilité ; ils sont cancérigènes et perturbateurs
endocriniens ; ils agissent sur le système immunitaire (diminution de la
réponse à la vaccination).
Deux de ces molécules sont particulièrement étudiées à cause de
leur action sur l'environnement et sur la santé :
|
|
|
|
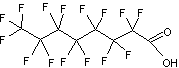
PFOA ou Acide perfluorooctanoïque |
PFOS ou Acide perfluorooctane sulfonique |
Le PFOS voit ses utilisations restreintes depuis 2009 et le PFOA
est interdit à l'export et à la production depuis 2020.
La directive européenne 2020/2184 qui concerne la qualité des eaux
de consommation humaine a été entièrement révisée pour suivre la présence des
PFAS dans les analyses de l'eau. Ainsi 20 PFAS sonr ciblés (voir la liste à l'annexe 3). La limite de qualité est fixée à 0,10 µg/L
pour la somme de ces 20 molécules dans les eaux de consommation.
La présence de PFAS dans les milieux aquatiques peut avoir
plusieurs origines : rejets de stations d'épuration, rejets industriels
(électronique, toners/encres, cosmétique, imperméabilisants, nettoyants de
surface métallique, de sols, vernis …), contaminations par des mousses
anti-feux (à proximité des aéroports, de sites d'exercices d'incendie, ….).
3-2-8)
D'autres micropolluants :
Ce sont des composés apparentés à l'acide phtalique
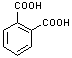
Ils sont surtout utilisés dans les plastiques et notamment les PVC
où ils interviennent comme plastifiants (Ils rendent les substances plus
malléables ou plus résistantes).
Mais on les trouve aussi dans des produits industriels, ménagers,
d'hygiène, dans des cosmétiques (shampoings, parfums, crèmes hydratantes,
laques pour cheveux …),
Quelques exemples :
Les usages indiqués varient au gré des interdictions des Etats qui
permettent ou non leur utilisation, pour des raisons sanitaires.
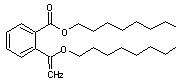
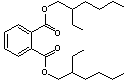
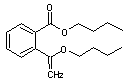
|
|
|
|
|
Phtalate
de di-n-octyle (DNOP) |
Phtalate de bis(2-éthylhexyle) (DEHP) |
Phtalate de di-n-dibutyle (DBP) |
|
Tubes
medicaux, poches de stockage du sang, fils et câbles dalles de sol et
adhésifs, cosmétiques et pesticides…. |
Parfums, rideaux de douche, tuyaux d'arrosage, couches culottes,
matériels médicaux …… C'est le plus utilisé. |
Plastiques nitrocellulosiques, matière explosive, vernis à
ongles, laques ; utilisé aussi dans les peintures les encres d'imprimerie,
les adhésifs, le PVC. |
Les phtalates sont des perturbateurs endocriniens et métaboliques
associés à des effets nuisibles (asthme, infertilité….).
b) Le
bisphénol A, des filtres
UV, les parabènes :
Ø Le Bisphénol A
|
|
|
Le bisphénol A (BPA) est utilisé dans la fabrication du polycarbonate, une matière
plastique transparente et rigide utilisée dans la production de biberons,
d’assiettes, de tasses, de bols, de gobelets, de récipients destinés aux
fours à micro-ondes et à la conservation. Il est également couramment utilisé
dans la production de résines époxy-phénoliques qui
forment la couche de protection intérieure des canettes et des boîtes de
conserve, ainsi que le revêtement des conteneurs d’eau et des cuves à vin. Le
BPA peut migrer en petites quantités dans les boissons et les aliments
stockés dans des matériaux contenant cette substance. Par action de l'épichlorhydrine, il conduit à la résine DGEBA (résine
diglycidyléther du bisphénol A) qui associée à un durcisseur constitue une
colle (Araldite). Son utilisation pour la fabrication des biberons est interdite
en France depuis juin 2010. On le soupçonne d'être néfaste pour la santé
(Activité hormonomimétique et perturbateur endocrinien notamment). |
Ø Filtres UV
Une des méthodes pour protéger la peau des rayons UV du soleil en été
est l'absorption du rayonnement par des filtres chimiques ; ce sont des
molécules dont le spectre d'absorption se situe dans l'ultraviolet (UV)
Les rayons UV qui
transportent relativement beaucoup d'énergie, provoquent une modification de la
situation des électrons dans la molécule protectrice, particulièrement les
électrons π, qui sont les plus mobiles. Ces perturbations entraînent une
absorption d'énergie qui ne sera donc pas captée par la peau.
Parmi les molécules qui participent à l'élaboration des crèmes
solaires on trouve :
- La
benzophénone 3 (ou oxybenzone)
C'est un dérivé de la benzophénone
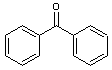
qui est un intermédiaire de synthèse (colorants, parfums,
médicaments, agrochimie, encres, vernis….).
Elle sert aussi de photo-amorceur (générateur de radicaux) dans
les encres dites UV ; elle est aussi
incorporée à certaines crèmes solaires anti UV.
La formule de l'oxybenzone est :
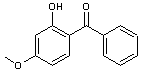
- Le
butylméthoxydibenzoylméthane (ou Avobenzone)
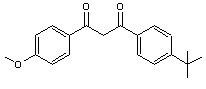
Sa dénomination commerciale est le Parsol® 1789.
Son absorption maximale se situe à 357 nm il offre une protection
contre les UVA.
C'est une molécule utilisée dans les crèmes solaires à large
spectre.
C'est une molécule stable qui persiste dans l'environnement ; ses
produits de dégradation (composés benzéniques) peuvent avoir des effets
néfastes sur la santé.
Ø Les parabènes
Cet acronyme désigne les esters de l'acide parahydroxybenzoïque
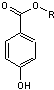
où R désigne un groupement hydrocarboné.
Ils comprennent principalement, le méthylparabène (E 218
et 219 pour son sel de sodium) , l'éthylparabène (E214 et E215 pour son sel de
sodium), le propylparabène (E216 et E217 pour le sel de sodium), le
benzylparabène….
|
|
|
|
|
|
Méthylparabène |
Ethylparabène |
Propylparabène |
Benzylparabène |
Les parabènes sont utilisés comme conservateurs (antimicrobiens et
antifongiques) :
- en
cosmétique et notamment dans des produits tels que les autobronzants, les
déodorants, les produits d'hygiène buccodentaire, produits capillaires,
produits de soin pour bébés, les maquillages, les soins pour la peau, produits
de rasage et d'épilation, vernis à ongles, gels hydroalcooliques. Ils gardent
ce pouvoir de "conservateur" même à de très faibles doses et ne
provoquent pas d'effets sensibilisants (réactions allergiques) (Académie de
pharmacie, 2013).
- dans
certains médicaments ; c'est le propyl parabène qui est principalement
utilisé à cet effet ; il permet d'éviter une dégradation du médicament.
- dans
certains aliments, ils existent à l'état naturel à faibles concentrations :
carotte ou oignon, fraise, cassis, mûres, orge, vanille …. et l'industrie
alimentaire les utilise pour de nombreux produits.
- dans
d'autres produits industriels : vernis, colles, adhésifs, cirages,
certaines lessives, tabac.
Il en résulte que les expositions aux parabènes se font par voie
cutanée (cosmétiques), par voie alimentaire (aliments, médicaments) ou par
inhalation (tabacs, vernis …).
Les parabènes sont suspectés d'être des perturbateurs endocriniens
et des facteurs prédicteurs de l'obésité
chez l'enfant. Il n'a pas été prouvé qu'ils occasionnent des cancers du sein
comme cela a été avancé.
C) Les microbilles de plastique
La
pollution aux plastiques est, on le sait, généralisée et ce problème a donné lieu
à une prise de conscience et à des décisions au niveau mondial pour en atténuer
les conséquences.
Parmi les
substances qui participent à cette pollution, il y une émergence, qui commence
à inquiéter les scientifiques, celle des microbilles de plastique.
Il s'agit
de petites billes de l'ordre de grandeur de 1µm, qui sont utilisées dans
plusieurs domaines dont celui de la cosmétique et qui seront susceptibles
d'être rejetées dans l'environnement aquatique après le traitement des eaux
usées. Il a été démontré que ces microbilles causaient des effets à court et à
long terme chez les organismes de laboratoire.
Les
polymères synthétiques des microbilles qui sont utilisées à des fins
cosmétiques sont très divers :
|
|
|
|
|
|
Polyéthylène |
Poly(méthacrylate
de méthyle) |
Polytétrafluoroéthylène |
Polypropylène |
|
|
|
|
Polyamide
6-6 |
Polyéthylène
téréphtalate |
Ces
billes sont utilisées dans des produits de soins personnels : exfoliants,
nettoyants pour le visage, fonds de teint, vernis à ongles, ombres à paupières,
fards à joues mais aussi dentifrices, fixatifs capillaires, produits pour
bébés, lotions solaires …….. Les quantités varient considérablement entre les
produits : de 137 000 à 2 800 000 par flacon de 150mL.
Elles
sont utilisées aussi dans des produits industriels : c'est le cas des chantiers
navals ou on utilise comme milieu abrasif des microbilles de polyéthylène.
4) Elimination des micropolluants des eaux souterraines et des eaux
usées
4-1) Eaux
souterraines
Pour les
eaux souterraines il s'agit de rendre les eaux potables.
Il y a 3
méthodes principales pour éliminer les micropolluants :
- Une oxydation chimique à l'ozone
Une
technique de restauration des sols et des eaux souterraines consiste à injecter
de l'ozone dans la zone vadose (surface du sol et partie du sous-sol située au
dessus de la nappe phréatique) afin de dégrader tout ou partie des
contaminants.
L'oxydation
est produite directement à partir de O3 ou indirectement à partir
des radicaux hydroxyle OH* formés à
partir de O3. Ceux-ci sont plus réactifs que O3 et
oxydent un grand nombre de composés chimiques. Si l'oxydation est complète on
obtient CO2 et H2O. L'oxydation est très rapide, quelques
semaines à 1 mois.
Les
contaminants ciblés :
Ø Biphényles polychlorés (partiellement éliminés)
Ø Chlorobenzène
Ø Composés phénoliques
Ø Explosifs
Ø Hydrocarbures aliphatiques chlorés (partiellement éliminés)
Ø Hydrocarbures aromatiques monocycliques
Ø Hydrocarbures aromatiques polycycliques (partiellement éliminés)
Ø Hydrocarbures pétroliers (partiellement éliminés)
Ø Produits phytosanitaires (partiellement éliminés)
Si la réaction est incomplète, il y a formation de sous-produits
qui, en général (mais pas toujours) sont moins toxiques, plus mobiles et plus
biodégradables que leurs précurseurs.
Exemples :
Les hydrocarbures pétroliers conduisent à de l'acétone et des
alcools.
Les explosifs (RDX et HMX) conduisent à des nitrates.
- L'adsorption aux charbons actifs
L'adsorption
est la propriété de certains matériaux de fixer à leur surface des ions ou des
molécules.
Dans
cette technique, on utilise un solide, le charbon, en poudre ou granulaire,
produit spécifiquement pour avoir une très grande surface interne, entre 500 et
1500m2/g (charbon actif), pour enlever des substances solubles dans
l'eau.
Il
retient la matière organique à faible polarité difficilement attaquable par
l'ozone : phénols, hydrocarbures saturés, huiles minérales,
phytopharmaceutiques, agents tensio-actifs, mais aussi les métaux lourds.
Les
performances des filtres à charbon actif sont fonction de la température et du
polluant traité ; ils doivent être changés périodiquement. Les filtres
granulaires peuvent être régénérés par exemple en oxydant la matière organique
qu'ils contiennent ; leur efficacité diminue alors d'environ 10%.
Cette
technique est utilisée pour purifier les eaux souterraines ; elle est peu
utilisée pour l'épuration des eaux usées ; notons tout de même qu'on l'utilise
parfois pour les débarrasser du phénol qu'elles peuvent contenir.
- La filtration membranaire
(nanofiltration ou osmose inverse)
C'est une
technique de purification des eaux, qui dresse une barrière physique empêchant
le passage des micropolluants.
L'eau est
envoyée sous pression au travers d'une membrane semi-perméable ; en fonction de
la taille des pores on parlera de
Ø Microfiltration (0,1 à 5 µm) pour retenir bactéries,
macromolécules, colloïdes,matières en suspension.
Ø Ultrafiltration (0,001 à 0,1 µm) pour retenir les virus, les
macroprotéines, les antibiotiques….
Ø Nanofiltration (0,1 nm à 0,001µm) pour retenir la majorité des
molécules, les colorants….. Elle permet l'élimination des phytopharmaceutiques,
des nitrates des eaux souterraines, les métaux lourds des eaux usées.
Remarque : Osmose inverse
On peut purifier une eau contenant des impuretés en solution par
osmose inverse ; le principe est le suivant :
On exerce dans le compartiment contenant l'eau à purifier (à
gauche dans notre schéma) une pression supérieure à la pression osmotique ; on oblige
ainsi l'eau contenue dans ce compartiment à traverser la membrane
semi-perméable et à rejoindre l'autre compartiment débarrassée de ses
impuretés. Celles-ci se concentrent donc dans le compartiment de gauche,
contrairement au phénomène naturel d'osmose où la solution la plus concentrée
subit une dilution.
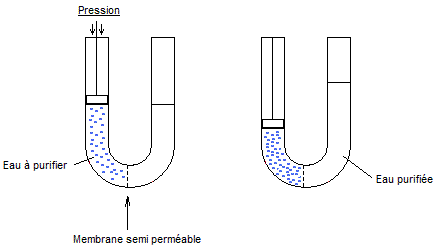
C'est un procédé industriel de désalinisation de l'eau de mer ; il
faut exercer une pression supérieure à 30 bars (pression osmotique dans ce
cas), en pratique 70 à 80 bars.
Des systèmes domestiques existent pour adoucir l'eau utilisée par
les particuliers pour enlever le calcaire mais aussi les nitrates et les
composés chlorés ; dans ce cas en plus de l'osmose inverse il existe des
filtres en amont notamment des filtres à charbon actif.
Il convient d'ailleurs dans toutes ces techniques membranaires, de
débarrasser préalablement l'eau des polluants qui peuvent être enlevés par
d'autres méthodes, de façon à ne laisser que ceux dont la taille est adaptée
aux pores des membranes et ceci afin de ne pas encrasser trop rapidement
celles-ci.
4-2) Eaux usées
Pour les
eaux usées il s'agit d'un problème qui concerne le travail des stations
d'épuration qui ont des cahiers des charges stricts concernant la qualité des
eaux qu'elles doivent rejeter après traitement.
L'agence
de l'eau nous indique qu'il existe 5 étapes pour épurer les eaux usées :
·
Les eaux usées sont
acheminées jusqu'à la station d'épuration par des réseaux d'assainissement;
·
Le dégrillage : le dégrilleur,
une sorte de tamis, débarrasse les eaux usées des parties les plus grosses,
chiffons, morceaux de bois, plastiques ….. Puis passage par des grilles plus
serrées ; c'est le tamisage.
·
Le dessablage et le
dégraissage : on réduit la vitesse d'écoulement et on fait passer l'eau dans un
bassin, le dessableur où les matières les plus lourdes (sables graviers….) se
déposent. Puis dans un second bassin où les graisses sont récupérées en surface
par raclage. Une aération de l'eau par des pompes permet de faciliter la
remontée des graisses.
·
Le traitement biologique
est la principale étape du processus : On achemine les eaux dans un bassin où
des bactéries vont décomposer les matières organiques et les transformer en
boues. Ce phénomènes peut être aérobie (en présence d'oxygène) ou anaérobie (à
l'abri de l'air). Le procédé le plus répandu en France est le premier
(aérobie). Les bactéries les plus nombreuses utilisées sont de type Tetrasphaera,
Trichoccocus, Candidatus Microthrix, Rhodoferax, Rhodobacter, Hyphomicrobium.
·
La clarification : L'eau
est ensuite amenée dans un bassin de décantation (clarificateur) où les boues
se déposent. 80 à 90% des impuretés ont disparu à ce stade ; l'eau peut alors
être rejetée dans le milieu naturel.
Remarque : Les boues récupérées vont subir un traitement de stabilisation
biologique et pourront être utilisées en agriculture comme engrais ou être
incinérées ou mises en décharge.
Annexe 1
Méthodes
de détermination de la teneur en formaldéhyde de l'atmosphère :
-
Prélèvement sur cartouche imprégnée de 2,4-DNPH et analyse ultérieure :
Il
s'agit d'une méthode de référence dont le principe est le suivant (source INRS)
:
On
fait circuler l'air à analyser avec un débit qui dépend de l'importance
supposée de la teneur en formaldéhyde (0,1
à 2 L par minute) sur une cartouche de silice imprégnée de 2,4-DNPH
(tube de verre de 150mm de long et de 8 mm de diamètre intérieur) ; Le
formaldéhyde (et les autres composés carbonylés éventuellement présents) réagit
sur la 2,4-DNPH suivant l'équation :
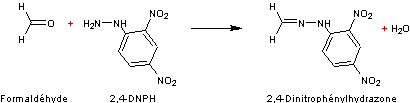
On
obtient donc (si plusieurs composés carbonylés sont présents) un ensemble
d'hydrazones qu'il convient de séparer par HPLC (Chromatographie liquide haute
performance) en éluant avec de l'acétonitrile, puis de détecter par
spectrométrie UV à 360nm. Le repérage du pic du formaldéhyde se fait par le
temps de rétention et la quantification par la surface sous le pic en se
référant à des courbes d'étalonnage réalisées préalablement.
On
peut aussi remplacer la technique de séparation par HPLC en utilisant la CPG
(Chromatographie en phase gazeuse) avec un détecteur à ionisation de flamme
éventuellement couplé à un spectromètre de masse ou avec un détecteur
thermoionique.
La
méthode est assez sensible et permet d'évaluer des teneurs de l'ordre de 36 µg
de formaldéhyde par m3 d'air.
-
Capteurs :
La
méthode précédente, surtout si elle utilise la CPG comme moyen de détection et
de quantification reste une méthode lourde et peu utilisable sur le terrain
pour évaluer des pics de pollution. Il existe à cet effet des capteurs
chimiques ou biologiques dont nous allons donner le principe.
a) Capteurs chimiques :
Les
molécules gazeuses de formaldéhyde sont piégées sélectivement et, par réaction
chimique, donnent une substance changeant de couleur ou fluorescente ; la
quantification du formaldéhyde se fait alors par dosage colorimétrique ou
directement par mesure de la fluorescence.
#
Le formaldéhyde peut par exemple réagir avec l'oxo-3-butanoate d'éthyle
(acétylacétate d'éthyle) :
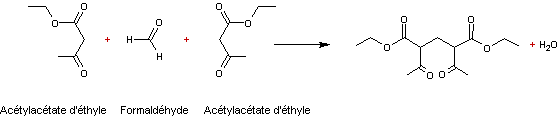
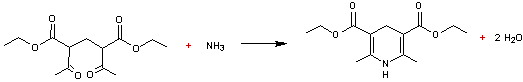
puis
condensation du composé obtenu avec l'ammoniac conduisant à une dihydropyridine
:
Après
oxydation de cette molécule suivie de l'hydrolyse de la fonction ester et d'une
décarboxylation :
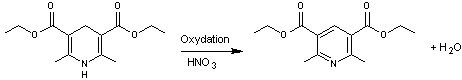
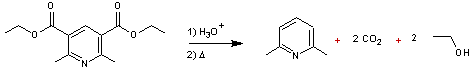
on
obtient la 2,6-diméthylpyridine ou lutidine qui est un composé
ayant une fluorescence dans le bleu. La série de réactions décrite plus haut
est appelée réaction de Hantzsch.
#
Le formaldéhyde peut aussi réagir sur le fluoral-P (4-aminopent-3-èn-2-one) :
![]()
pour
donner la 3,5-diacétyl-1,4-dihydro-2,6-lutidine (DDL) . L'équation chimique est
comparable (Thèse de Stéphanie Carquiny (Douai 2011) :
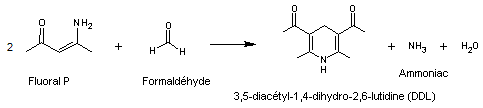
La DDL est une substance fluorescente
permettant la quantification du formaldéhyde par mesure fluorimétrique ; la DDL
excitée à 410 nm se désexcite par émission de fluorescence à 510 nm.
Au
CEA de Saclay, l'équipe de Mme Thu-Hoa TRAN-THI a mis au point un capteur
Sol-Gel pulsé (xérogel, polymère poreux de silice) constituant des matrices
nanoporeuses agissant comme des éponges et dopées de fluoral-P (molécule-sonde)
qui permettent de détecter optiquement le polluant via la fluorescence du DDL.
Le
principe est l'utilisation d'enzymes pour obtenir des réactions biochimiques
spécifiques du formaldéhyde ; par exemple utilisation de la formaldéhyde
déshydrogénase (FDH) qui couplée à NAD+ oxyde le formaldéhyde en acide formique
et produit une molécule fluorescente, le NADH que l'on peut mesurer par
fluorimétrie.
D'une
façon générale ces capteurs sont moins avancés que les capteurs chimiques.
Stéréoisomérie
du métolachlore
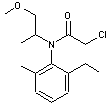
Deux
éléments de chiralité :
- Un
atome de carbone asymétrique (1') et un axe chiral entre le cycle aromatique et
l'atome d'azote qui empêche la rotation autour de la liaison ; cela conduit à 4
stéréoisomères.
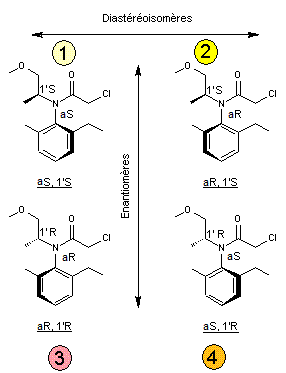
Les
stéréoisomères 1 et 2 sont "S". Ce sont eux qui ont un caractère
herbicide.
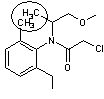
Remarque :
Le
schéma ci-dessous permet de visualiser l'empêchement stérique à la
libre-rotation autour de la liaison cycle aromatique – atome d'azote qui
explique le deuxième élément de chiralité :
Liste des 20 PFAS
concernés par la directive européenne Eau potable 2020
Ce sont :
- Acide perfluorooctanoïque
(PFOA)
- Acide perfluoroheptanoïque
(PFHpA)
- Acide perfluorohexanoïque
(PFHxA)
- Acide perfluoropentanoïque
(PFPeA)
- Acide perfluorobutanoïque
(PFBA)
- Acide perfluorobutane
sulfonique (PFBS)
- Acide perfluorododécanoïque
(PFDoDA)
- Acide perfluorononanoïque
(PFNA)
- Acide perfluorodécanoïque
(PFDA)
- Acide perfluoroundécanoïque
(PFUnDA)
- Acide perfluoroheptane
sulfonique (PFHpS)
- Acide perfluorotridécanoïque
(PFTrSA)
- Acide perfluorodécane
sulfonique (PFDS)
- Acide perfluorooctane
sulfonique (PFOS)
- Acide perfluorohexane
sulfonique (PFHxS)
- Acide perfluoropentane
sulfonique (PFPeS)
- Acide perfluorononane
sulfonique) (PFNS)
- Acide perfluoroundécane
sulfonique
- Acide perfluorododécane
sulfonique
- Acide perfluorotridécane
sulfonique
Deux métabolites du métolachlore
|
|
|
|
OXA-métolachlore |
ESA-métolachlore |
ESA signifie Ethan Sulfonic Acid
OXA vient de acide OXAnilique (dont cette molécule dérive)
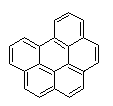
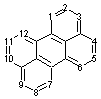
Justification de la dénomination des arènes
condensés.
L'Union internationale de chimie pure et
appliquée (IUPAC) a adopté une nomenclature dont l'utilisation s'est
généralisée.
Rappelons l'essentiel :
- On aligne
horizontalement autant de cycles que possible et on place le plus grand nombre
de cycles restants dans le quadrant supérieur droit ; exemple : le pyrène
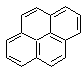
- La numérotation débute avec le premier
atome de carbone qui n’est pas commun à deux cycles dans le cycle de droite de
la ligne supérieure.
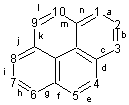
- Les atomes de carbone suivants porteurs d’hydrogène
sont numérotés dans le sens des aiguilles d’une montre : 2,3 ….
- Aux côtés
extérieurs des cycles sont attribuées des lettres dans l’ordre alphabétique,
-a- pour le côté compris entre les
carbones 1 et 2, -b- pour le côté compris entre les carbones 2 et 3 ……
Remarque : On
désigne également par des lettres les côtés extérieurs aboutissant à des
carbones non numérotés (par exemple c et d ou f et g …)
Exemple 1 :
pour clarifier les choses, on prendra le benzo(a)pyrène. Benzo(a)
signifie qu’un cycle aromatique, celui entouré dans la formule, est condensé
avec le pyrène en position a.
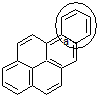
Un autre cycle peut également être condensé en position b, ou en position e, et ainsi de
suite.
Toutefois, les positions a, b, h et i sont équivalentes, de même que les
positions e et l, comme le montrent ces
rotations d'un demi-tour autour des axes de symétrie D1 et D2 de la molécule
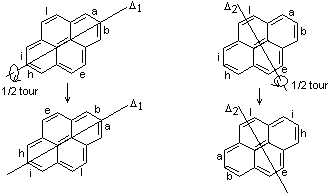
Par conséquent, il n’existe que deux isomères, le benzo(a)pyrène
et le benzo(e)pyrène. Seule la première lettre est utilisée, et les
formules sont présentées conformément aux règles énoncées ci-dessus.
Un cycle peut aussi être condensé aux positions cd, fg, etc. du pyrène; on obtient
alors un composé, le 2H-benzo(cd)pyrène, qui est saturé en position 2,
ce qui est noté par la lettre H, appelée «hydrogène indiqué».
Exemple 2 :
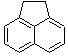
Le Benzo (g,h,i) pérylène
|
|
|
|
Pérylène |
Benzo
(g,h,i) pérylène |
Exemple 3 :
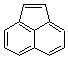
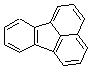
L'indéno [1,2,3-cd] pyrène
|
|
|
|
|
Pyrène |
Indène |
Indéno
[1,2,3-cd] pyrène |